白藜芦醇及其衍生物和类似物抗肿瘤研究进展
2014-03-04韩雪莲
韩雪莲
(江苏省安全生产科学研究院,江苏 南京 210042)
白藜芦醇(resveratrol,Res)于1940年由日本Tokaoka首次从毛叶藜芦的根部分离得到并被命名,至今已经在21个科、31个属的72种植物中得以发现。在葡萄、虎杖等植物中含量较为丰富。目前人们已经发现Res具有多种生理活性,包括抗癌、心血管保护、抗菌、神经保护、免疫调节、肝细胞保护,以及抗肝纤维化、抗衰老、治疗休克、美容减肥等多种作用。由于 Res 的生物利用度较低,Res的衍生物和类似物研究也得到了广泛开展。
1 Res的结构及理化性质
1.1 Res的结构
Res为蒽醌萜类(非黄酮类)多酚化合物,又称芪三酚,别名虎杖苷元,化学名 3,5,4'-三羟基-反-二苯代乙烯(3,5,4'-trihy-droxy- trans-stilbene),分子式C14H12O3,相对分子质量228.25,具有酚和芪的特性。关于Res及其衍生物的晶体结构实验和从头计算阐述了其结构特征对于生物活性的重要性。Res分子结构显示反式二苯乙烯骨架具有相对的共面性,而在固态时,3个羟基与邻近苯基上的氧原子交替形成和打破氢键,从而显示出广泛的氢键网络。氢键的交替形成和破坏,赋予了Res分子中3个羟基中氢原子的流动性,即可以转移到邻近的高电子密度的活性氧原子[1]。见图1、图2。
1.2 Res的理化性质
Res为白色针状晶体,无味,难溶于水,易溶于有机溶剂。自然界中 Res有顺、反两种结构,植物中主要以反式形式存在,一般认为反式异构体的生物活性更为广泛。高纯度的Res对光不稳定,自然条件下,Res仅有少量以游离态存在,常与葡萄糖结合以苷的形式存在,在肠道中糖苷酶作用下,白藜芦醇糖苷释放出Res[2]。
2 Res的抗肿瘤作用机制
2.1 Res的分子靶点
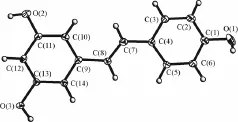
图1 晶体X射线衍射获得的反式Res分子结构
图2 晶体X射线衍射显示反式Res分子间广泛的氢键网络
Res对多种体外培养癌细胞和移植瘤表现出抑制或延缓作用,关于Res抗肿瘤作用机制的研究结果也极为丰富,数量众多,但结果颇不相同。包括抑制氧活性自由基、抑制细胞色素 P450对致癌物的活化、阻断蛋白激酶C介导的信号通路、免疫调节、激素调节、引起细胞周期阻滞并诱导细胞凋亡等均被认为是其可能的机制。关于其分子靶点更是多种多样,pRb、MEK1、AP-1、c-Myc、Caspases 3/9、p53、p21、 p27、Bax、Bcl-2、 cyclin B/D1/E、Cdk1/4、pCdc2(tyr15)、ATM/ATR、chk1/2、pCdc25C、MMP-2、MMP-9、MKP5、P53、 p53(ser15)、MAKP、p21、 AMPK、ROS、PI3K、pAKT、Src-Stat3、ROS、caspase-2、ATF3、M IC-1、NO、BCL6、Myc、pAKT、pp70S6K、Cyclin B、PKC、PKCα等均被认为是Res发挥抗肿瘤作用的可能靶点[3-7]。
2.2 Res对细胞周期的影响
包括对白血病、结肠癌、乳腺癌、前列腺癌、肝癌和食道癌细胞等多种人类肿瘤细胞株的研究认为,Res可以引起细胞周期阻滞,并诱导分化或凋亡。Res可以诱导CDK2及Cyclin E表达增加,抑制肝癌细胞HepG2及结肠癌SW 480细胞系癌细胞从S期进入G2/M期,并存在剂量依赖关系;通过ATM/Chk途径诱导多发性骨髓瘤IM 9细胞S期细胞周期阻滞并诱导细胞凋亡;通过增加 G1/S和G2/M 调节因子相关激酶的表达,引起人乳腺癌MCF-7细胞S期阻滞和细胞凋亡;通过引起G0/G1期阻滞、下调bcl-2基因、上调bax基因表达诱导前列腺癌细胞PC-3细胞凋亡[8-10]。目前有越来越多的观点倾向于Res主要通过细胞S期或G0/G1期阻滞和诱导细胞凋亡而起到抗肿瘤作用。
鉴于实验结果的多种多样,可能Res并不是通过单一机制发挥抗肿瘤作用,而是通过多种途径、多种层次的生化途径产生作用。Res作用于细胞整个通路,而不是单个的酶,因此作用更为缓和(副作用较少),并且能够取得更好的疗效和动态平衡。
3 Res的毒性
3.1 Res的遗传毒性
高浓度Res(200μmol/L)能够对鼠L5178Y淋巴瘤细胞产生毒性,产生微核和中期染色体位移,在V79中国仓鼠细胞中,同样能看到微核的产生。Ferry-Dumazet等[11]采用细菌反向突变试验(Ames试验)、体外染色体畸变(CA)实验、体外微核(MN)实验和姐妹染色单体交换(SCE)试验测试了 Res对CHL中国仓鼠肺细胞遗传毒性,结果发现Ames试验阴性,但 Res能够造成结构性 CAs(2.5~20μg/m L)和微核细胞,并显示轻微的非整倍体倾向。另外,Res的 SCE作用具有剂量依赖性,在10mg/m L浓度下,Res能够产生6倍的SCE作用,相当于丝裂霉素。Res对白血病细胞和正常造血细胞的生长抑制IC50分别是12μmol/L和59μmol/L。关于肝癌 Bel-7404细胞的实验发现,Res浓度>25μmol/L时可抑制 Bel-7404细胞增殖并诱导凋亡,浓度>100μmol/L时正常肝细胞 L02 的增殖也受到抑制,并产生凋亡。Helene Ferry-Dumazet 等[11]发现Res对未激活的淋巴细胞无影响,但是在低浓度下(IC50<8μmol/L)即可降低正常健康志愿者细胞周期内的外周血淋巴细胞活性,并诱导其凋亡。同时还可以以剂量依赖性方式(IC50=60μmol/L)诱导正常CD34+造血干细胞凋亡并降低集落生成熟。说明Res通过复杂的信号通路产生作用,而且对正常细胞也有抗增殖和诱导凋亡活性。
3.2 Res的急慢性毒性
关于 TSGp53杂合子基因敲除小鼠的研究发现,连续6个月灌胃给药4000mg/(kg·d),并没有改变肿瘤的发生率,除了肾积水和尿路上皮增生,没有发现其他明显的改变。小鼠血浆游离Res浓度(给药剂量4000mg)最高可达20~40μmol/L,代谢产物浓度可达10倍。这证明Res不具有致癌性,但同时说明Res具有一定的肾及膀胱毒性,并将限制其在体内的用量[12]。
同时,也有实验证据说明Res对正常细胞无毒性或者具有较大的安全性。大鼠的最大耐受剂量达300mg/kg;小鼠口服较高剂量的 Res,4周后检测各项血液生化指标,均未发现异常改变。细胞水平研究表明,Res不影响小鼠成纤维细胞(3T3)的生长增殖活性,但明显抑制HepG2、HL-60细胞及胆囊癌 GBC细胞的生长增殖[13-15]。目前,关于 Res毒性报道并不一致,因实验所采用的浓度、细胞类型、细胞状态等不同而不同。总体来说,多数报道倾向于Res对正常细胞无毒或低毒。
4 Res的代谢动力学
4.1 Res的吸收、转运及体内分布
对人结肠腺癌 Caco-2细胞的体外研究表明,Res可被大量吸收,而数项动物及人体内实验证明,Res的肠道吸收率极低。同时,由于迅速代谢,其半衰期极短(约8~14m in),峰浓度极低[16]。健康受试者通过不同介质(白葡萄酒,葡萄汁,蔬菜汁/匀浆)口服后,30m in达峰值,血浆峰浓度 10~40nmol/L。静脉注射给药后,Res在体内广泛分布,主要分布于肝、肺、脾、肾、胃和肠,其中以肝脏分布最多,肾次之,提示Res的抗肿瘤作用可能与其组织分布特点有关,即在特定的靶组织高浓度分布。人体内静脉注射30min后,Res大部分转化为硫酸盐。目前口服后详细的血浆代谢过程还不清楚,血清和尿液中主要以葡萄糖醛酸和硫酸结合物存在。在血浆中,Res可与脂蛋白、白蛋白结合,白蛋白是其主要的血浆载体。Res必须和蛋白结合和/或转化才能保持高浓度,其疗效与其和蛋白结合转运的能力(选择性和亲和力)有关[17-19]。
4.2 Res的代谢场所和代谢产物
Res分子代谢广泛,主要代谢场所为肝脏和肠道,肝细胞通过被动吸收和载体介导两种途径摄取Res,但 Res的细胞内蛋白靶点尚需进一步研究。Res在肝细胞中的代谢产物为硫酸盐和葡萄糖苷酸结合物,经质谱和核磁共振检测,在体外培养的人类肝细胞中可以检测出3种Res代谢产物,分别是trans-resveratrol-3-O-4'-O-disulfate(S1)、transresveratrol-4'-O-sulfate(S2)和 trans-resveratrol-3-O-sulfate (S3)。与人类重组磺酸基转移酶(SULTs)共同孵育,发现S1几乎全部由SULT1A1催化生产,只有极少部分由SULT1A2,1A3和1E1催化生成,S2选择性地由SULT1E1催化生成,S3则因Res的浓度不同,由SULT1A1,SULT1E1,SULT1A2和1A3催化[20]。
而对单层培养的人结肠腺癌 Caco-2细胞检测发现,Res的代谢产物为 trans-resveratrol-4'-O-glucuronide (G1)、trans-resveratrol-3-O-glucuronide(G2)、trans-resveratrol-3-O-sulfate(S3),G1和G2的生成遵循米氏动力学,而主要代谢产物S3的产生受Res浓度影响,高浓度Res抑制S3的产生。这可能是因为大量的Res造成了代谢饱和或抑制,人体肠道可能存在同样机制,因此影响了Res的吸收和生物利用度[21]。
4.3 Res的代谢与疗效间的矛盾
尽管其生物利用度极低,Res在体内的疗效却不可否认,因此,有学者提出也许Res的代谢物才是其活性形式,尽管对药物的修饰,包括转化为葡萄糖苷酸和硫酸盐,通常会降低细胞对药物的通透性和有利于药物的排出。然而,对CYPs的抑制作用被认为是Res产生生理活性的途径之一,而实验证明S3硫酸盐却并不能够抑制CYPs[22]。
Res的血浆浓度极低(血浆峰浓度为 10~40nmol/L),而在体外实验中,能够产生生物学活性需要的浓度为5~100μmol/L。因此在很多动物试验中,Res的用量极大才能得出预期效果,甚至由于用量过大产生了毒性作用。由于代谢动力学研究较为零星,对于Res疗效的影响还缺乏说服力,如将Res实际应用于临床,需要对其毒理学及代谢动力学进行系统的研究。
为了获得生物利用度更高、疗效更高的化合物,越来越多的学者致力于寻找Res的类似物或者对其结构进行改造,以期小剂量应用即可获得理想效果。目前已通过化学合成、天然成分提取等方法发现了了多种Res类似物及衍生物,经抗肿瘤活性实验,多种具有较强活性。
5 Res类似物和衍生物的抗肿瘤作用
5.1 羟基化类似物和衍生物的抗肿瘤作用
白皮杉醇(piceatannol,3,5,3',4'-四羟基反式二苯乙烯)是Res的3位羟基化类似物,最早发现于大戟属植物lagascae中,也存在于葡萄、大黄等植物中,具有和Res类似的生物学作用。从结构上看,piceatannol比Res多一个羟基,因而增加了水溶性;从功能上看,piceatannol对急性白血病和淋巴瘤细胞表现出细胞毒作用,对结肠癌细胞中也有抗增殖作用。对21例原发性儿童急性淋巴细胞性白血病的体外培养研究表明,piceatannol具有显著地凋亡诱导作用,而Res则没有显示出抗增殖活性[24]。研究表明,在肿瘤细胞中过度表达的CYP1B1,可将Res催化羟化生成piceatannol和另外两个尚未确证的单羟基和双羟基白藜芦醇类似物。说明通过CYP1B1催化,Res可以转化为具有化学预防作用和抗肿瘤活性的化合物[23]。
3 '-羟基Res能通过诱导神经酰胺浓度增加而抑制无雄激素受体的前列腺癌细胞PC3增殖。与具有其他取代基的白藜芦醇类似物相比,具有邻羟基基团的类似物具有3倍的HL-60白血病细胞增殖抑制活性,这可能是由于核苷酸还原酶抑制的解除以及dNTP的耗尽。
Matsuoka等[25]合成了6种Res类似物,进行了CA、MN和SCE实验。其中3,4'-羟基反式二苯乙烯(3,4'-dihydroxy-trans-stilbene)和 4-羟基反式二苯乙烯(4-hydroxy-trans-stilbene)在3种实验中均显示明显的活性,两种类似物的遗传活性接近或者高于Res,而其他不具有4'羟基的类似物没有活性。据此,Matsuoka等提出了结构活性学说,认为 4'羟基是产生遗传毒性所必需的基团。Stivala等[26]则认为反式结构和4'位羟基均为Res增殖抑制及抗氧化作用所必需。
5.2 甲基化类似物和衍生物的抗肿瘤作用
顺式 3,5,4'-三甲氧基二苯乙烯具有很强的抑制血管内皮细胞增殖作用,能够抑制内皮细胞增殖、出芽、胶原浸入和形态形成(ID50=0.3~3.0μmol/L),其活性是Res的30~100倍,同时还能够引起微管分解和微管蛋白解聚,是一个具有显著血管靶向活性的抗血管生成剂[27]。Cardile等[28]对甲基化衍生物对DU-145人前列腺癌细胞的抑制生长研究显示,与Res相比,这些衍生物对细胞增殖抑制活性相当或高于白藜芦醇(GI50= 24.09μmol/L),对非致瘤性人的成纤维细胞显示低或非常低的毒性,其中以Res的三甲基化产物活性最强。三甲氧基二苯乙烯类化合物 12(GI50=2.92μmol/L)和 19(GI50= 25.39μmol/L)的比较表明,取代基的位置对活性非常重要,这并不是因为空间位阻的原因,而是因为其化学性质不同。
Zhang等[29]对其合成的Res甲氧基类似物的研究表明,与Res相比,具有邻位甲氧基的类似物具有更强的醌还原酶(QR)的诱导活性,这与甲基能够增加脂溶性并提高代谢稳定性有关。此外,具有甲氧基的衍生物能同时激活辅酶Ⅰ和辅酶Ⅱ,而Res则很快被辅酶Ⅱ代谢失活。对系列甲氧基 Res衍生物的合成和活性研究表明,3,5-二甲氧基是二苯乙烯衍生物促凋亡活性的活性基团。Pterosfilbene(紫檀芪,3,5-二甲氧基 4'-羟基二苯乙烯)是 Res的 3,5-二甲氧基天然类似物,具有抗氧化、抗细胞增殖、降血脂、抗炎、诱导凋亡、降血糖和抗真菌作用,其抗真菌活性为Res的5倍,对streptozotocen致糖尿病大鼠的降糖作用与二甲双胍相近;Pterosfilbene能够显著抑制恶性黑色素瘤细胞B16M-F1增殖,抑制α-和λ- DNA聚合酶活性,并抑制猴病毒40(SV40)DNA的复制,其活性接近aphidicolin(蚜肠霉素)[30]。
3 '-hydroxypterostilbene(3'-羟基紫檀芪)是piceatannol的 3,5-二甲氧基天然类似物,在相同浓度下,其诱导细胞凋亡的能力远远超过 Res,且对正常造血干细胞几乎没有任何细胞毒性。3,5-二甲氧基为其活性所必需[31]。
5.3 其他取代基类似物和衍生物的抗肿瘤作用
陈国良等[32]将Res的A环上3、5位羟基甲基化,B环上羟基用硝基、二甲胺基或吡啶等杂环替代合成了一些Res衍生物,发现大部分衍生物有较好的抗TPA促癌作用,其中3,5-二甲氧基-3',4'-亚甲氧基二苯乙烯的作用强于Res;Yang等[33]以磺胺基取代Res A环上的羟基,合成了6种化合物,其中两种化合物对BT-549乳腺癌细胞和HT-29结肠癌细胞具有选择抑制作用,同时结构-活性研究还认为,以磺胺基取代Res A环上的羟基,大大提高了Res的细胞毒性以及选择性。
目前已经发现多种Res类似物和衍生物,按照取代基不同,大致可分为甲基化、羟基化、其他取代基衍生物,每一类衍生物都发现了具有抗肿瘤作用的化合物,其中多种化合物抗肿瘤作用显著强于Res,具有良好的开发前景。对于影响其生物活性的结构性决定因素,也做了较多讨论,包括4'羟基、甲氧基、分子内氢键以及数量和位置、空间立体结构等均被认为可能影响其抗肿瘤活性,但究竟哪些结构起到了关键作用尚不明确。
6 Res类似物和衍生物的抗肿瘤作用机制
Savioa等[34]的的研究发现,与Res相比,4,4'-二羟基反式二苯乙烯抗增殖活性高于 Res,而且具有不同的机制,4,4'-二羟基反式二苯乙烯显著增加G1期细胞积累,而Res阻碍G1/S期过渡。在体外实验中,两种化合物都能够抑制DNA聚合酶δ的活性,但4,4'-二羟基反式二苯乙烯不影响DNA聚合酶 α活性。4,4'-二羟基反式二苯乙烯提高P21CDKN1A和p53蛋白水平,而Res导致S期限制点蛋白Chk1的磷酸化。
Chen等[35]合成了一种 Res脂肪酸,并发现,Res脂肪酸有效抑制TLR2的表达,并通过对TLR2抑制降低血清磷酸化Akt和磷酸化糖原合酶激酶3β(GSK3β)水平,因此阻断TLR2介导的正常人胚胎肾HEK293细胞凋亡。因此认为,Res脂肪酸通过抑制Akt/ GSK3β相关的TLR2途径参与细胞凋亡调节。
Ciolino等[36]认为,与Res类似,piceatannol通过抑制雌激素CYP1A1,CYP1A2 和CYP1B1活性发挥作用,而且其对CYP1B1的抑制作用更强。
目前对于Res类似物和衍生物的抗肿瘤作用机制研究相对较少,已有的研究结果显示,不同的类似物和衍生物抗肿瘤作用机制与Res不尽相同,彼此间也各不相同。
7 Res及其类似物和衍生物的制备
7.1 从天然产物中提取
常见的提取方法包括:超声波提取法、酶提取法、微波辅助提取法、纤维素酶提取法、超临界流体萃取法等。提取出的Res及其类似物和衍生物为混合物,需要进一步纯化才能得到高纯度的产物。常见的纯化方法有:有机溶剂萃取、硅胶柱色谱、高效液相色谱、薄层色谱、大孔吸附树脂等。近年来通过新的分离提纯方法,得到了更多种类的天然Res类似物和衍生物。如,He等[37]采用高速逆流色谱法进行分离纯化,从葡萄中得到了3种Res寡聚体;Guebailia等[38]采用反相板制备HPLC并结合柱层析法分离得到了Res及5种衍生物。纯化后的Res及其类似物和衍生物纯度较高,为天然绿色产品,目前市场上出售的产品多数为天然产物提取物。
7.2 化学合成
由于从天然产物中提取Res及其类似物和衍生物产量低、成本高,同时也为了得到更多种类的衍生物和类似物,利用化学法合成Res及其类似物和衍生物得到了广泛开展。主要包括:芳香醛和乙酸酐反应合成肉桂酸(形成双键)的Perkin反应;羰基与膦叶立德(W ittig试剂)发生亲核加成反应、形成双键的W ittig反应以及用简单易得的膦酸酯代替磷叶立德的W ittig-Horner 反应;在钯催化下有机卤化物或三氟磺酸酯和烯烃之间偶联的 Heck 反应;以及利用碳负离子与羰基化合物进行缩合反应等[39]。
化学法合成路线长、产品收率相对低,而且所使用的原料多数为有毒有害物质,目前基本处于实验室研究阶段,但已经发现多种合成Res类似物和衍生物具有较强的体外抗肿瘤作用,具有继续研究的价值。
7.3 生物合成
生物合成是将细胞作为生物反应器,通过调控细胞的代谢,提高Res及其衍生物和类似物含量,然后通过细胞培养获得高产细胞,目前Res的生物合成大部分通过花生和葡萄细胞悬浮培养进行。通过转基因技术将Res及其类似物和衍生物的合成酶基因导入不合成Res及其类似物和衍生物的物种,如酵母菌、大肠杆菌、烟草、胡萝卜等,培养高产植株,可以获得更多产品[39]。
生物合成成本低,产量高,不破坏资源和环境,随着生物技术的迅速发展,利用生物法获得Res及其类似物和衍生物将具有更加广阔的前景。
8 结 语
综上所述,关于Res及其衍生物和类似物的研究范围广泛,数量庞大,也取得了丰富的成果,但关于其生物作用机制、结构与活性的关系、毒理学、药代动力学研究结果仍不明确,动物体内试验资料缺乏。而且目前的研究虽然涉及的肿瘤细胞种类和化合物种类繁多,但均相对孤立,重复性差,难以互相印证,作为一类很有希望的的新型抗肿瘤药物,还需要对Res及其衍生物和类似物开展更为系统的研究。
[1] Caruso F,Tanski J,Estrada A V,et al.Structural basis for antioxidant activity of trans-resveratrol:Ab initio calculations and crystal and molecular structure[J].J.Agric.Food Chem.,2004,52(24):7279-7285.
[2] Chan M M.Antim icrobial effect of resveratrol on dermatophytes and bacterial pathogens of the skin[J].Biochem.Pharmacol.,2002,63(2):99-104.
[3] Benitez D A,Pozo-Guisado E,Alvarez-Barrientos A,et al.Mechanisms involved in resveratrol-induced apoptosis and cell cycle arrest in prostate cancer-derived cell lines[J].J.Androl.,2007,28(2):282-293.
[4] Nonn L,Duong D,Peehl D M.Chemopreventive anti-inflammatory activities of curcum in and other phytochem icals mediated by MAP kinase phosphatase-5 in prostate cells[J].Carcinogenesis,2007,28(6):1188-1196.
[5] Golkar L,Ding X Z,Ujiki M B,et al.Resveratrol inhibits pancreatic cancer cell proliferation through transcriptional induction of macrophage inhibitory cytokine-1[J].J.Surg.Res.,2007,138(2):163-169.
[6] 贺永贵,孙玉洁,谢宇曦,等.糖原合成酶激酶313在白藜芦醇诱导的大鼠心肌线粒体保护中的作用及其机制[J].中华心血管病杂志,2012,40(10):858-863.
[7] 王冲,华子春.白藜芦醇的免疫调节作用研究进展[J].中国生化药物杂志,2012,33(1):84-87.
[8] Shimizu T,Nakazato T,Xian M J,et al.Resveratrol induces apoptosis of human malignant B cells by activation of caspase-3 and p38 MAP kinase pathways[J].Biochem.Pharmacol.,2006,71(6):742-750.
[9] 徐万海,乔振奎,王晓民.白藜芦醇诱导前列腺癌细胞系PC-3凋亡的实验研究[J].哈尔滨医科大学学报,2008,42(6):571-573
[10] Matsuoka A,Furuta A,Ozaki M,et al.Resveratrol,a naturally occurring polyphenol,induces sister chromatid exchanges in a Chinese hamster lung (CHL) cellline[J].Mutat.Res.,2001,494(1-2):107-113.
[11] Ferry-Dumazet H,Garnier O,Mamani-Matsuda M,et al.Resveratrol inhibits the grow th and induces the apoptosis of both normal and leukem ic hematopoietic cells[J].Carcinogenesis,2002,23(8):1327-1333.
[12] Horn T L,Cw ik M J,Morrissey R L,et al.Oncogenicity evaluation of resveratrol in p53(+/-)(p53 knockout) m ice[J].Food Chem.Toxicol.,2007,45(1):55-63.
[13] 赵克森.白藜芦醇的生物学特性和效应[J].中国病理生理杂志,2012,28(9):1709-1711,1717.
[14] Clément M V,Hirpara J L,Chawdhury S H,et al.Chemopreventive agent resveratrol,a natural product derived from grapes,triggers CD95 signaling-dependent apoptosis in human tumor cells[J].Blood,1998,92 (3):996-1002.
[15] 田雪梅,张展霞.白藜芦醇促进Ca2+介导的线粒体通透转变孔道开放[J].药学学报,2003,38(2):81-84.
[16] Asensi M,Medina I,Ortega A,et al.Inhibition of cancer grow th by resveratrol is related to its low bioavailability[J].Free Radic.Biol.Med.,2002,33(3):387-398.
[17] Goldberg D M,Yan J,Soleas G J.Absorption of three w ine-related polyphenols in three different matrices by healthy subjects[J].Clin.Biochem.,2003,36(1):79-87.
[18] 陈波,俞惠新,谭成,等.碘标白藜芦醇及其小鼠体内分布[J].原子能科学技术,2008,42(6):508-511.
[19] Walle T,Hsieh F,DeLegge M H,et al.High absorption but very low bioavailability of oral resveratrol in humans[J].Drug Metab.Dispos.,2004,32(12):1377-1382.
[20] M iksits M,Maier-Salamon A,Aust S,et al.Sulfation of resveratrol in human liver:Evidence of a major role for the sulfotransferases SULT1A1 and SULT1E1[J].Xenobiotica,2005,35(12):1101-1119.
[21] Maier-Salamon A,Hagenauer B,Wirth M,et al.Increased transport of resveratrol across monolayers of the human intestinal Caco-2 cells is mediated by inhibition and saturation of metabolites[J].Pharm.Res.,2006,23(9):2107-2115.
[22] Yu C,Shin Y G,Kosmeder J W,et al.Liquid chromatography/tandem mass spectrometric determ ination of inhibition of human cytochrome P450 isozymes by resveratrol and resveratrol-3-sulfate[J].Rapid Commun.Mass Spectrom.,2003,17(4):307-313.
[23] Wolter F,Clausnitzer A,Akoglu B,et al.Piceatannol,a natural analog of resveratrol,inhibits progression through the S phase of the cell cycle in colorectal cancer cell lines[J].J.Nutr.,2002,132(2):298-302.
[24] W ieder T,Prokiop A,Bagci B,et al.Piceatannol,a hydroxylated analog of the chemopreventive agent resveratrol,is a potent inducer of apoptosis in the lymphoma cell line BJAB and in primary,leukem ic lymphoblasts[J].Leukemia,2001,15:1735-1742.
[25] Matsuoka A,Takeshita K,Furuta A,et al.The 4'-hydroxy group is responsible for the in vitro cytogenetic activity of resveratrol[J].Mutat.Res.,2002,521(1-2):29-35.
[26] Stivala L A,Savio M,Carafoli F,et al.Specific structural determ inants are responsible for the antioxidant activity and the cell cycle effects of resveratrol[J].J.Biol.Chem.,2001,276(25):22586-22594.
[27] Schneider Y,Chabert P,Stutzmann J,et al.Resveratrol analog (Z)-3,5,4'-trimethoxystilbene is a potent anti-mitotic drug inhibiting tubulin polymerization[J].Int.J.Cancer.,2003,107(2):189-196.
[28] Cardile V,Lombardo L,Spatafora C,et al.Chemo-enzymatic synthesis and cell-grow th inhibition activity of resveratrol analogues[J].Bioorg.Chem.,2005,33(1):22-33.
[29] Zhang W,Go M L.Quinone reductase induction activity of methoxylated analogues of resveratrol[J].Eur.J.Med.Chem.,2007,42(6):841- 850.
[30] Ferrer P,Asensi M,Segarra R,et al.Association between pterostilbene and quercetin inhibits metastatic activity of B16 melanoma[J].Neoplasia,2005,7(1):37-47.
[31] Tolomeo M,Grimaudo S,Di Cristina A,et al.Pterostilbene and 3'-hydroxypterostilbene are effective apoptosis-inducing agents in MDR and BCR-ABL-expressing leukemia cells[J].Int J.Biochem.Cell.Biol.,2005,37(8):1709-1726.
[32] 陈国良,单韦,徐颖,等.白藜芦醇及其类似物的合成及抗TPA促癌作用研究[J].沈阳药科大学学报,2004,21(4):261-263.
[33] Yang L M,Lin S J,Hsu F L,et al.Antitumor agents.Part 3:Synthesis and cytotoxicity of new trans-stilbene benzenesulfonamide derivatives[J].Bioorg.Med.Chem.Lett.,2002,12(7):1013-1015.
[34] Savio M,Coppa T,Bianchi L,et al.The resveratrol analogue 4,4'-dihydroxy-trans-stilbene inhibits cell proliferation w ith higher efficiency but different mechanism from resveratrol[J].Int.J.Biochem.Cell.Biol.,2009,41(12):2493-2502.
[35] Chen L,Zhang Y,Sun X,et al.Synthetic resveratrol aliphatic acidinhibits TLR2-mediated apoptosis and an involvement of Akt/GSK3β pathway[J].Bioorg.Med.Chem.,2009,17(13):4378-4382.
[36] Ciolino H P,Yeh G C.Inhibition of aryl hydrocarbon-induced cytochrome P-450 1A1 enzyme activity and CYP1A1 expression by resveratrol[J].Mol.Pharmacol,1999,56(4):760-767.
[37] He S,Lu Y B,Jiang L Y,et al.Preparative isolation and purification of antioxidative stilbene oligomers from Vitis chunganeniss using high-speed counter-current chromatography in stepw ise elution mode[J].J.Sep.Sci.,2009,32(14):2339-2345.
[38] Guebailia H A1,Chira K,Richard T,et al.Hopeaphenol: The first resveratrol tetramer in wines from north africa[J].J.Agric.Food.Chem.,2006,54(25):9559-9564.
[39] 黄卫文,李忠海,黎继烈,等.白藜芦醇的合成研究进展[J].中南林业科技大学学报,2010,30(10):72-77.
