艾司洛尔对脓毒症大鼠心肌细胞凋亡及心功能的影响
2014-03-04刘德红刘映峰孟新科徐志伟
刘德红,刘映峰,孟新科,徐志伟
(1.南方医科大学珠江医院心血管内科,广州510282;2.广东省深圳市第二人民医院急诊科 518035)
心脏是脓毒症早期受损的主要靶器官之一,全身器官衰竭和心功能下降互为因果,随后诱发的脓毒性休克和多器官功能障碍综合征(MODS)是临床医生所面临的困境[1]。而此过程的中心环节是心肌细胞凋亡,可以造成患者左室射血分数(LVEF)下降30%左右[2]。无论是在心衰还是在围术期中的使用,β受体阻滞剂对心脏的保护作用已得到人们的认可,但有关短效β受体阻滞剂艾司洛尔对全身炎性反应中心功能改善的报道甚少。因此,本研究旨在探讨艾司洛尔对脓毒症大鼠心肌细胞凋亡及心功能的保护作用和相关机制,为临床早期治疗脓毒症,挽救濒死心肌,延缓病情发展和降低病死率提供实验依据和新的思路,现报道如下。
1 材料与方法
1.1 材料 选取96 只清洁级健康雄性SD 大鼠,体质量(250±20)g,由南方医科大学实验动物中心提供。适应性饲养7d后开始实验,分为假手术组32只,脓毒症组32只,治疗组32只。
1.2 方法
1.2.1 标本采集 采用盲肠结扎加穿孔法建立大鼠脓毒症模型[3]。假手术组仅开腹探查盲肠,不行盲肠结扎穿孔。手术完成后,治疗组大鼠于尾静脉持续泵入艾司洛尔1mg·kg-1·min-1至处死,脓毒症组泵入等量生理盐水。脓毒症组和治疗组大鼠在建模3h内出现反应变差,活动减少,叫声减弱,在后期处死后腹腔可闻及恶臭,结扎盲肠呈现深色,肠黏膜充血水肿表示建模成功。3组大鼠建模成功后3、6、12、24h每个时间点各取8只大鼠麻醉开胸,采集主动脉血5mL,促凝后离心分离上清液测心肌肌钙蛋白I(cTnI)水平;摘取心脏,取心尖部心肌组织分成2份,1份液氮冻存以制备组织匀浆测定caspase-3活性,1份甲醛固定石蜡包埋以测定心肌细胞凋亡指数。3组大鼠在第24h开胸前采用GE VIVID7超声仪测定左室舒张末内径(LVEDd)、左室收缩峰压(LVPP)、短轴缩短率(FS)和LVEF,探头频率为5 MHz。
1.2.2 cTnI测定 cTnI测定采用南京基蛋生物科技有限公司提供的cTnI检测试剂盒,测定方法为干式免疫荧光定量法,所有试验操作严格按照有关说明书进行。
1.2.3 心肌细胞caspase-3活性测定 心肌组织匀浆后离心取上清液50μL,加入1μL 抑制剂和50μL 缓冲液(抑制剂和缓冲剂按照标准操作说明配取),37 ℃水浴1h后再次加入5 μL缓冲液,混匀后加5μL酶作用底物再次水浴1h,以配制的蛋白样品(1mg/mL)为标准对照管,蒸馏水空白管,采用荧光分光光度仪测定第2次水浴前后的荧光值,使用曲线软件curveexpert进行分析计算caspase-3活性。
1.2.4 心肌病理标本制作和心肌细胞凋亡指数测定 标本在石蜡包埋固定后切片,常规HE 染色,光学显微镜观察。常规甲醛固定石蜡包埋脱水后,用蛋白酶K 室温孵育,3%过氧化氢室温下再次孵育以阻断过氧化物酶活性,加入TUNEL反应液,滴加转化剂,冲洗后滴加DAB底物溶液,苏木素染色后光学显微镜下观察,心肌细胞核发现棕黄色颗粒为凋亡细胞。随机选取5个400 倍光镜视野,计算凋亡细胞所占比例,取平均值。
1.3 统计学处理 采用SPSS 20.0统计软件进行分析,计量资料以±s表示,计数资料用百分比表示。3组间计量资料比较采用单因素方差分析,两两比较采用LSD 检验,3组内两两比较采用LSD 检验,计数资料比较采用χ2检验或Fisher确切概率法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 脓毒症模型制备结果和病理切片观察 假手术组各个时间点和脓毒症建模后3、6h大鼠成活率为100.0%。脓毒症组和治疗组12h成活率分别为87.5%和100.0%,而24h成活率分别为75.0%和87.5%。光镜下假手术组心肌细胞结构紧密,未见明显水肿,充血及细胞质渗出;脓毒症组可见大量坏死心肌细胞,且水肿明显,细胞核肿胀,心肌纤维断层改变,细胞间质血管充血扩张(为对比明显,选用心肌坏死较为明显的染色图片进行对比观察);治疗组心肌细胞水肿较轻,坏死灶不明显,可见少量心肌纤维断层改变,见图1。
2.2 3组大鼠血清cTnI水平和心肌细胞凋亡指数比较 假手术组血清cTnI水平无显著性变化(P>0.05)。脓毒症组和治疗组各时间点cTnI水平均较假手术组升高(P<0.05),其中脓毒症组在12h达峰值,治疗组在6h达峰值,6、12、24h脓毒症组较治疗组cTnI明显升高(P<0.05)。假手术组心肌凋亡细胞较少,脓毒症组和治疗组均出现不同程度的细胞凋亡,但治疗组凋亡的心肌细胞明显少于脓毒症组(图2)。随着时间延长,脓毒症组心肌细胞凋亡指数逐渐升高,治疗组只在24 h升高,二者差异有统计学意义(P<0.05)。脓毒症组在4个时间点心肌细胞凋亡指数均高于治疗组(P<0.05),见表1。
2.3 3组大鼠心肌细胞caspase-3活性比较 脓毒症组和治疗组各时间点caspase-3活性均较假手术组升高(P<0.05);其中脓毒症组在12h达峰值,治疗组在6h达峰值,且脓毒症组12h 和24hcaspase-3 活性都较治疗组显著升高(P<0.05),见表2。

图1 建模24h心肌细胞HE染色(×200)
表1 不同时相血清cTnI水平(ng/mL)和心肌细胞凋亡指数(%)变化(±s)

表1 不同时相血清cTnI水平(ng/mL)和心肌细胞凋亡指数(%)变化(±s)
*:P<0.05,与假手术组比较;#:P<0.05,与治疗组比较;△P<0.05,与3h比较。
组别 3h 6h 12h 24h F P假手术组 cTnI 0.40±0.03 0.45±0.04 0.46±0.06 0.42±0.06 2.05 0.071 凋亡指数 1.50±0.35 2.64±0.89 2.87±0.43 2.73±0.31 2.84 0.075脓毒症组 cTnI 2.48±0.54*# 5.94±0.57*#△ 6.96±0.47*#△ 3.91±0.58*#△ 111.08 <0.001 凋亡指数 23.84±5.19*# 42.51±7.24*#△ 52.51±8.12*#△ 55.48±8.44*#△ 74.25 <0.001治疗组 cTnI 1.98±0.19* 3.19±0.84*△ 3.18±1.01*△ 1.99±0.45* 7.82 0.001 凋亡指数 17.54±3.51* 19.54±3.94* 20.63±4.33* 30.48±4.82*△ 84.10 <0.001
2.4 3组大鼠第24小时心功能比较 脓毒症组和治疗组第24小时LVEF、LVPP和FS均较假手术组下降,LVEDd明显升高(P<0.05),治疗组LVEF 较脓毒症组明显升高(P<0.05),而治疗组LVPP 与脓毒症组没有差异(P>0.05),见表3。
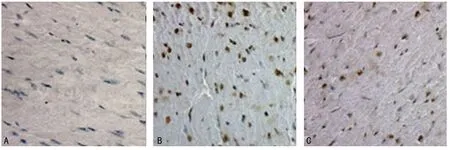
图2 心肌细胞TUNEL染色(×400)
表2 不同时相心肌细胞caspase-3活性变化(±s,μm·h-1·mg-1)

表2 不同时相心肌细胞caspase-3活性变化(±s,μm·h-1·mg-1)
*:P<0.05,与假手术组比较;#:P<0.05,与治疗组比较;△:P<0.05,与3h比较。
组别 3h 6h 12h 24h F P假手术组 7.01±1.81 7.52±2.58 8.01±2.34 6.80±1.56 1.55 >0.05脓毒症组 12.86±3.59* 16.91±4.27* 20.95±4.57*#△ 18.54±7.24*# 109.57 <0.001治疗组 10.07±3.00* 14.27±3.66*△ 11.27±2.95* 8.99±2.28* 18.25 <0.001 F 4.57 85.84 187.54 145.40 P 0.005 <0.001 <0.001 <0.001
表3 第24小时心功能指标的变化(±s)

表3 第24小时心功能指标的变化(±s)
*:P<0.05,与假手术组比较;#:P<0.05,与治疗组比较。
组别 LVEDd(mm) LVEF(%) LVPP(mm Hg) FS(%)假手术组 4.62±0.41 78.81±12.64 137.54±15.27 56.19±4.80脓毒症组 7.16±0.89*# 50.16±6.84*# 109.24±12.90* 21.43±3.18*#治疗组 6.27±0.57* 63.86±7.06* 112.51±12.57* 39.62±3.94*F 7.12 9.05 6.14 28.517 P 0.003 0.002 0.007 <0.001
3 讨 论
肾上腺素能系统在脓毒症时被高度激活,大量的儿茶酚胺释放可以引起心肌损害,并损害心功能[4-5]。目前,大鼠盲肠结扎加穿孔法是临床相关性最强的脓毒症模型,大鼠在其中表现出的早期高代谢和晚期低动力循环都表明,维持正常的心功能和血流动力学是成功救治脓毒症的关键[6-7]。
徐秋林等[8]研究发现,脓毒症大鼠不仅有血管内皮的损伤,还有肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)的升高,且三者存在一定相关性。2010年,Ackland 等[9]通过对大鼠的实验发现β受体阻断剂能抑制脓毒症过程中的全身炎性反应,并保护心脏,改善预后。我国学者也发现,美托洛尔可通过减轻炎症反应和抑制细胞因子生成来发挥抗细胞凋亡的作用[10]。艾司洛尔是一种高选择性β1受体阻断剂,其半衰期短,不良反应小逐渐引起人们的关注[11]。有报道称艾司洛尔在心肺复苏过程中有保护心脏,预防室颤的作用[12]。本研究发现,脓毒症发生过程中,心肌损伤特异性标志物cTnI升高明显,提示脓毒症状态下心肌损伤严重。而且,本研究中光镜下观察病理结果也证实了心肌细胞大量坏死。治疗组结果则表现出应用艾司洛尔可以抑制脓毒症对心肌的损伤。以往的观点认为,β1 受体阻断剂对心肌收缩力及血压存在负性作用,本研究发现在应用艾司洛尔后大鼠的心率明显减慢,但心功能的损害反而得到改善,这也从另一方面说明脓毒症在很大程度上通过增加心率来代偿心输出量的减少。除减慢心率外,艾司洛尔可还能与其抑制肾上腺素能系统,减轻炎性反应,抑制心肌凋亡有关。因此,脓毒症患者应用短效β受体阻断剂可以改善心功能,而进一步获得相对稳定的血流动力学[13]。
心肌细胞凋亡是由多种基因调控的主动死亡过程,一般认为与Bcl-2家族基因、Fas/FasL 基因和caspase家族基因等有关[14]。本研究中大鼠在脓毒症后3hcaspase-3大量表达,并于12h达到峰值,艾司洛尔干预后caspase-3表达下降,峰值提前。caspase-3被认为在心肌细胞凋亡的级联反应中占据核心地位,它的大量表达可以激活限制性内切酶将DNA 水解和片段化[15]。β受体阻断剂可以明显抑制细胞内质网的应激状态,而caspase-3是内质网应激反应所具有的特异指标。本研究发现,caspase-3活性增强与cTnI和心肌细胞凋亡指数变化趋势一致,提示艾司洛尔可能通过抑制caspase-3的活性从而降低心肌细胞凋亡的发生。
综上所述,早期使用艾司洛尔可以抑制脓毒症过程中的心肌细胞凋亡,减轻脓毒症带来的心功能损害,并获得相对稳定的血流动力学。但本研究存在观察例数少、干预时间短等不足,艾司洛尔在脓毒症患者中的应用有待进一步深入地研究。
[1] Muriova K,Malaska J,Otevrel F,et al.Myocardial dysfunction in sepsis--definition and pathogenetic mechanisms[J].Vnitr Lek,2010,56(3):220-225.
[2] Smeding L,Plotz FB,Groeneveld AB,et al.Structural changes of the heart during severe sepsis or septic shock[J].Shock,2012,37(5):449-456.
[3] 常瑞明,肖建强,杨涛,等.盲肠不同部位结扎穿孔致脓毒症模型的研究[J].岭南现代临床外科,2012,12(1):20-22.
[4] An G,Namas RA,Vodovotz Y.Sepsis:from pattern to mechanism and back[J].Crit Rev Biomed Eng,2012,40(4):341-351.
[5] 刘洁,于莺,史迪,等.脓毒症心功能障碍研究进展[J].中国急救医学,2011,31(9):847-850.
[6] 郭海雷,卢才教,胡德林,等.脓毒症大鼠早期心肌损害与功能障碍的实验研究[J].中华急诊医学杂志,2012,21(7):725-727.
[7] 向国艳,王玉中.128 例严重脓毒症患儿院内死亡预后评估方程 的 建 立 与 评 价[J].重 庆 医 学,2012,41(7):663-665.
[8] 徐秋林,刘静贤,郭晓华,等.血管内皮细胞损伤在脓毒症大鼠心肌损伤中的作用[J].中国动脉硬化杂志,2012,20(12):1064-1068.
[9] Ackland GL,Yao ST,Rudiger A,et al.Cardioprotection,attenuated systemic inflammation,and survival benefit of beta1-adrenoceptor blockade in severe sepsis in rats[J].Crit Care Med,2010,38(2):388-394.
[10] 李志强,张印纲,程爱斌,等.美托洛尔对脓毒症大鼠心肌细胞凋亡的影响[J].实用医 学 杂志,2011,27(3):399-402.
[11] Wiest DB,Haney JS.Clinical pharmacokinetics and therapeutic efficacy of esmolol[J].Clin Pharmacokinet,2012,51(6):347-356.
[12] Jingjun L,Yan Z,Wei J,et al.Effect and mechanism of esmolol given during cardiopulmonary resuscitation in a porcine ventricular fibrillation model[J].Resuscitation,2009,80(9):1052-1059.
[13] Rudiger A,Singer M.The heart in sepsis:from basic mechanisms to clinical management[J].Curr Vasc Pharmacol,2013,11(2):187-195.
[14] 李玉珍,刘秀华.PUMA 与心肌细胞凋亡的研究进展[J].生物化学与生物物理进展,2012,39(11):1045-1049.
[15] Li Z,Jo J,Jia JM,et al.Caspase-3activation via mitochondria is required for long-term depression and AMPA receptor internalization[J].Cell,2010,141(5):859-871.
