鼻咽癌放疗患者铜绿假单胞菌感染基因型同源性
2014-03-03李传杰李军陶建萍高健全梁锦辉蔡永林
李传杰李军陶建萍高健全梁锦辉蔡永林
鼻咽癌放疗患者铜绿假单胞菌感染基因型同源性
李传杰1★李军2陶建萍3高健全4梁锦辉4蔡永林2
目的探讨鼻咽癌放疗患者铜绿假单胞菌(PA)感染的病原菌临床分布、耐药特点及其基因型(同源)亲缘关系。方法采用BD phoenix 100全自动微生物鉴定药敏系统和CLSI M100-S23指南对临床分离菌进行鉴定和耐药表型分组,应用随机引物扩增多态性(RAPD)技术进行基因分型同源性分析。结果49株PA来源于43位发生不同程度医院感染的鼻咽癌放疗患者,主要分布在咽拭子(46.94%)、痰(32.65%)、口腔分泌物(10.20%)等临床感染标本,耐药表型分组分别为Ⅰ组32株、Ⅱ组7株、Ⅲ组5株、Ⅳ组5株。49份PA样本经扩增后电泳出46个电泳图谱,分19个基因型别。在放疗二区高分布的H型菌株(57.14%)与在放疗四区高分布的J型菌株(60.00%)高度同源,耐药Ⅲ组、Ⅳ组的组内及组间型别亲缘关系不明显。不同病区鼻咽癌放疗患者之间存在基因型高度同源的PA感染局部流行,不同型别高耐药菌株的感染散发,部分亲缘关系密切菌株的耐药表型相似。结论应用基因分型技术检测分析病原菌同源性对医院感染监测和追踪具有重要意义。
鼻咽癌;放疗;铜绿假单胞菌;医院感染;同源性
放射治疗既是治疗鼻咽癌的首选方法,同时也损伤机体防疫系统,降低机体抵抗力,增加内源性和外源性感染铜绿假单胞菌(pseudomonas aeruginosa,PA)等条件致病菌机会[1-2]。我市及周边地区是世界鼻咽癌高发区之一[3],为了解鼻咽癌放疗患者PA感染之间的同源性,本文对2013年1月-12月鼻咽癌住院放疗患者临床分离PA的临床特征、耐药表型及其基因型别同源性进行了研究分析,现报告如下。
1 材料与方法
1.1材料
1.1.1一般资料
49株PA来源于2013年1月-12月本院4个放疗病区43位发生不同程度医院感染鼻咽癌住院放疗患者的临床感染标本,其中男35例,女8例,年龄27~83岁,平均51.1±9.8岁。同一病人不同感染时间或感染部位的临床分离菌按不同株统计。
1.1.2主要仪器和试剂
BD phoenix 100全自动微生物鉴定药敏系统;ABI 9700 PCR仪,DYY-6C型电泳仪(北京六一仪器厂),Centrifuge 5415D离心机(Eppendorf公司),凝胶成像系统(Kodark Elctrophoresis Documentation and Analysis System 120+),ABI 3900 DNA合成仪;DNA提取试剂QIAamp DNA Mini and Blood Mini Kit(Qiagen公司),Taq PCR(Qiagen公司),引物(英潍捷基公司)。
1.2方法
1.2.1细菌鉴定和耐药表型分组
按照卫生部2001年制定的《医院感染诊断标准(试行)》诊断医院感染,采用BD phoenix 100系统对医院感染的临床标本分离菌株进行鉴定和药敏实验。参照CLSI M100-S23推荐的药敏试验分组,对头孢菌素类(头孢他啶、头孢吡肟),青霉素类(哌拉西林、哌拉西林/他唑巴坦),碳青霉烯类(亚胺培南、美洛培南),单环β-内酰胺类(氨曲南),氨基糖苷类(庆大霉素、阿米卡星),氟喹诺酮类(环丙沙星、左氧氟沙星)共6类11种代表性抗菌药物的耐药表型进行分组对比,Ⅰ组:对6类11种全部敏感;Ⅱ组:对6类都有敏感,仅个别品种耐药,Ⅲ组:氨曲南耐药,其他各类都有敏感,Ⅳ组:6类都有耐药,仅个别品种敏感。
1.2.2RAPD扩增和电泳
应用随机引物扩增多态性(randomly amplifiled polymorphic DNA,RAPD)技术对临床分离菌进行分子生物学基因分型[4-6],RAPD引物序列为:ACGGCCGACC。DNA提取:将菌液1.5 ml置于Eppendorf管经多次孵育、振荡、离心,提取DNA溶液备用。扩增反应条件:93℃2 min,94℃5 min,36℃5 min,循环4次,72℃1 min,94℃1 min,36℃1 min,循环30次,72℃2 min,72℃10 min。产物检测:取扩增产物5 μL与1 μL 6×Loading buffer充分混匀,于3%琼脂糖凝胶、150 V电压电泳55 min,使用紫外线凝胶成像分析仪观察、照相。
1.2.3图像分析和结果分型
用Cross Checker软件对条带进行识别(自动识别错误的条带用手工识别调整)形成NTS文件,导入NTSYSpc 2.0软件模拟计算遗传距离。计算结果导入后选择“SAHN”功能做聚类分析,分析结果再次导入生成亲缘关系树状图。DNA基因型别同源性判断:以每一分离物的所有可见带具有相同的移动距离定为同一型,带的形状移动的距离不同或所有可见带的移动距离相同但缺少两条带以上定为另一型。各个菌株的扩增电泳条带数目和移动相同,表示这些菌株之间高度同源。
2 结果
2.1临床分布
49株PA按照临床分离的时间顺序分别编为1-49号,其病区分布分别为放疗一区14株、二区17株、三区7株、四区11株,在咽拭子、痰、口腔分泌物、皮肤黏膜和伤口分泌物、血液等临床标本中的构成比分别占46.94%、32.65%、10.20%、8.16%、2.04%,其中有12株分离自6例病人在不同住院时间的相同感染部位(见表1)。

表1 1-49号菌株的病区和标本来源分布Table 1 The strain distribution of No.1-49 in Ward and specimen source
2.2耐药表型
分离菌对6类11种代表性抗菌药物耐药率分别为头孢他啶18.37%、头孢吡肟18.37%;哌拉西林22.45%、哌拉西林/他唑巴坦14.29%;亚胺培南12.24%、美洛培南10.20%;氨曲南26.53%;庆大霉素20.41%、阿米卡星8.16%;环丙沙星8.16%、左氧氟沙星12.24%。耐药表型分别为Ⅰ组32株、Ⅱ组7株、Ⅲ组5株、Ⅳ组5株。
2.3基因分型
49株PA的菌样经RAPD扩增电泳出46个图谱,经Cross Checker软件和NTSYSpc 2.0软件进行条带识别和类聚分析分为19个基因型别,其中:电泳条带太弱未分型3株(1、4、28号样本),H型7株(15、16、20、25、44、45、46号样本),C型6株(5、7、9、12、17、41号样本),J型5株(21、22、23、30、33号样本),L型4株(32、33、34、38号样本),S型4株(6、26、27、49号样本),E型3株(10、11、24号样本),I型3株(18、19、29号样本),N型2株(37、40号样本),P型2株(42、43号样本);其他型各1株(见图1至图3)。
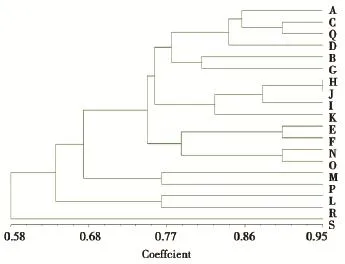
图119 个不同型别PA亲缘关系树状图Figure 1The genetic relation dendrogram of 19 different gene type of PA
2.4亲缘关系及型别分布
46株不同型别PA临床分布见表2。在放疗二区高分布的H型菌株(57.14%)与在放疗四区高分布J型菌株(60.00%)的亲缘关系密切,主要分离自咽拭子标本,耐药表型主要表现为耐药Ⅰ组。耐药性都只表现为耐药Ⅰ组的E型和N型菌株的基因型别亲缘相对较近,而表现为耐药Ⅲ组(H、C、S型)和Ⅳ组(L、I型)菌株的组内及组间基因型别亲缘关系不明显。

图219 个不同型别PA典型电泳图Figure 2The typical electrophoresis diagram of 19 different gene type of PA
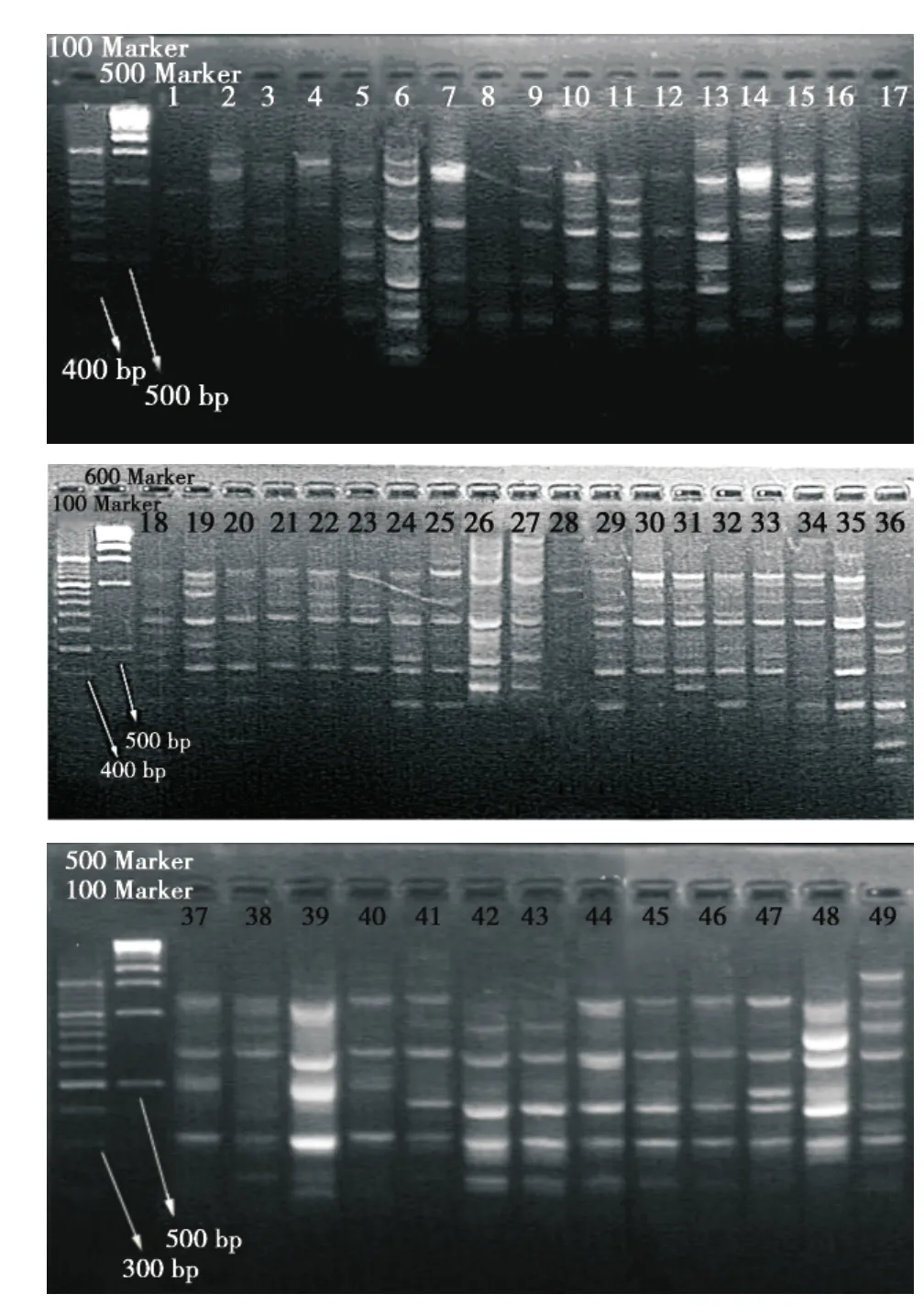
图349 株PA的RAPD电泳图Figure 3The RAPD electrophoresis diagram of 49 strains of PA
12株源自6例病人不同时期相同部位分离菌的基因分型中同型1例,不同型3例,条带弱未分型2例,其中来自同一病人的1号条带弱未分型,11号为E型,4号条带弱未分型,26号为S型,5号为C型,14号为G型,6号为S型,13号为F型,32号和34号同为L型,42号为P型,44号为H型。
3 讨论
肿瘤患者免疫力低下,容易发生感染,而且以下呼吸道感染、口腔感染为主[7],铜绿假单胞菌感染高达14.92~16.40%[1,8]。鼻咽癌患者放疗由于放射线对口腔黏膜的损害和对骨髓的抑制,损伤机体黏膜防疫屏障和细胞免疫系统,导致白细胞减少,同时造成体质变弱,体质量减轻、血红蛋白减少,抗感染能力下降,增加医院感染机会,甚至感染率高达79.33%[2]。
本组资料PA在咽拭子、痰、口腔分泌物中的构成分别占46.94%、32.65%、10.20%,说明我院当前鼻咽癌患者放疗医院感染的类型仍以口咽部感染为主,与文献报道基本一致[2,6]。PA在放一区(28.52%)、放二区(34.70%)高分布的原因主要与这两个病区以收治放射剂量较高的三期、四期易感病人为主有关。与国内文献关于对8种常用抗菌药物耐药率均在57%以上[9]和对阿米卡星、环丙沙星耐药率为0.00%等报道[10]相比,本组PA不仅对头孢他啶、头孢吡肟,哌拉西林、哌拉西林/他唑巴坦,亚胺培南、美洛培南,氨曲南,庆大霉素、阿米卡星,环丙沙星、左氧氟沙星等6类11种代表性抗菌药物高度敏感,而且表现为除氨曲南(26.53%)、庆大霉素(20.41%)外对其他抗菌药物的耐药率都低于20%,这应与本院近年强化抗菌药物临床使用管理,降低抗菌药物使用强度有关。
病原菌常通过患者和被污染的医护人员双手、衣物、医疗器械以及其它物体表面等媒介,在不同病区、同一病区不同病房或同一病人不同感染部位之间交叉感染传播,耐药菌的同一克隆株可在同一医院的不同病区播散引起流行暴发[5]。近年随着医院感染越发被重视和分子生物学技术的快速发展,国内外通过分子生物学基因分型技术研究医院交叉感染同源性的方法和报道不断增多[11-15]。本文RAPD分型结果显示,主要分离自咽炎标本并分别高分布于放疗二区的H型菌株和四区的J型菌株之间高度同源性,可能与病区间病人交换、共用放疗器械以及消毒隔离措施有关;相同病人在不同时期相同部位分离株的同源性并不显著;耐药性都只表现为耐药Ⅰ组的E型和N型菌株的基因型别亲缘相对密切,而表现为耐药Ⅲ组(H、C、S型)和Ⅳ组(L、I型)菌株的组内及组间基因型别亲缘关系不明显。
结果表明,不同病区鼻咽癌放疗患者之间存在基因型别高度同源的PA感染局部流行;部分亲缘关系密切菌株的耐药表型相似,耐药率较低;不同型别高耐药表型菌株的感染散发,未体现出交叉感染。应用分子生物学基因分型技术对不同病区同种疾病医院感染的病原菌进行分布特征、耐药表型及其基因型别的同源性分析,有助于判断不同病区、不同感染部位以及不同耐药性菌株之间是否存在交叉感染和传播,对医院感染监测和追踪具有重要意义。
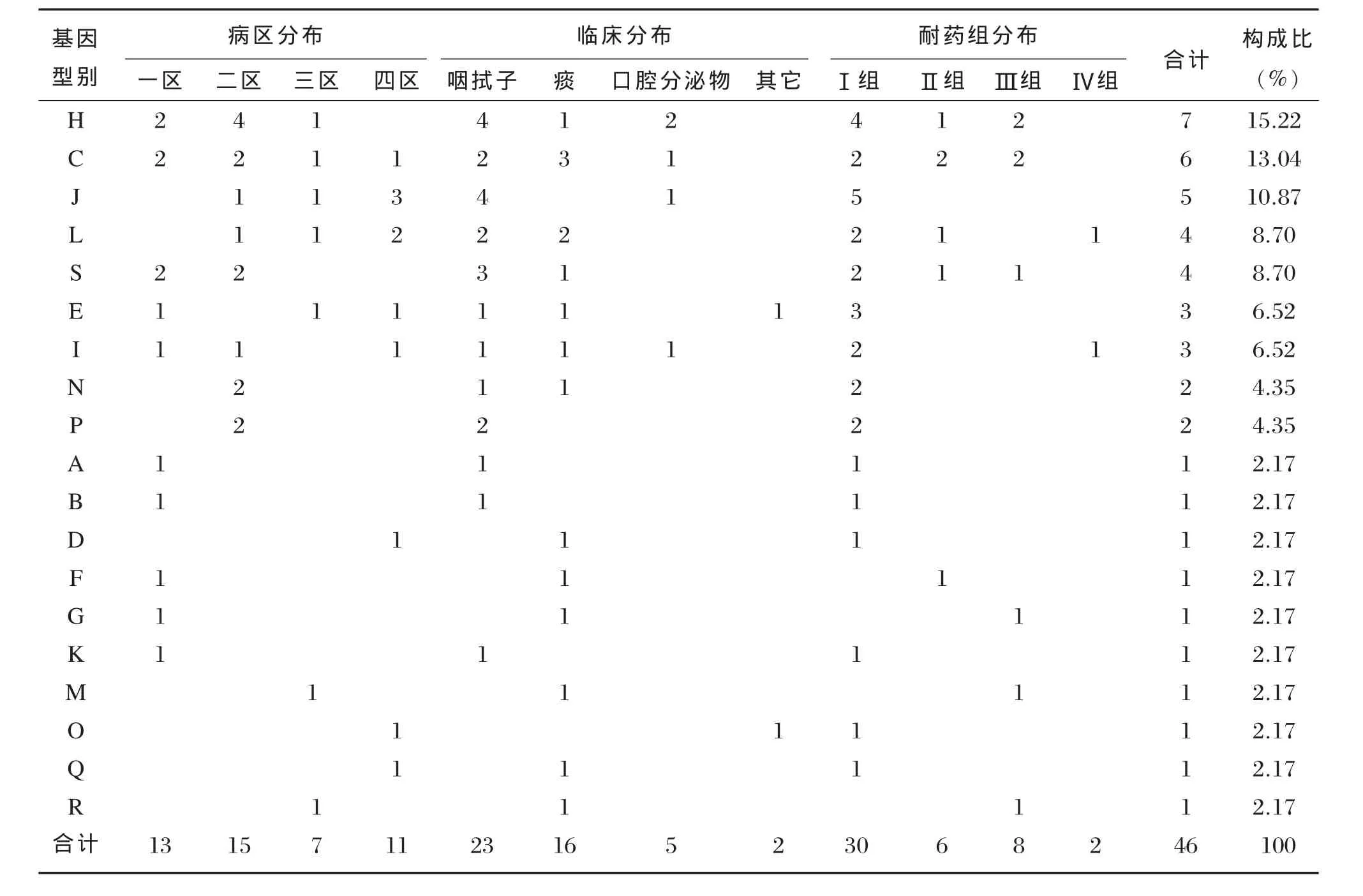
表246 株不同型别PA临床分布(株)Table 2The clinical distribution of 19 strain different gene type of PA(strain)
[1]彭建忠,詹燏.肿瘤患者医院感染的病原菌分布及危险因素分析[J].中华医院感染学杂志,2012,22(4): 715-716.
[2]罗晋卿,蔡永林,钟伟铭,等.鼻咽癌患者放射治疗中发生医院感染的危险因素研究[J].中国全科医学,2012, 15(16):1839-1843.
[3]蔡永林,王伟,周玲,等.鼻咽癌转移及预后分子标志物[J].分子诊断与治疗杂志,2012,4(2):137-141.
[4]Azfer A,Bashamboo A,Ahmed N,et al.Random amplificationofpolymorphicDNAwithconserved sequencesrevealsgenomespecificmonomorphic amplicons:Implications in cald Identifiction[J].J Biosci,1999,24(1):35-41.
[5]Cartelle M,del Mar T M,Pertega S,et al.Risk factors for colonization and infection in a hospital outbreak caused by a stain of Klebsiella pneumoniae with reduced susceptibility to expanded-spectrum cephalosporins[J].J Clin Microbiol,2004,42(9):4242-4294.[6]李传杰,罗晋卿.医院感染同源性基因分型研究进展[J].检验医学与临床,2013,10(20):2767-2769.
[7]张锦林,倪美鑫,季屹红,等.肿瘤专科医院恶性肿瘤患者医院感染的调查分析[J].中华医院感染学杂志, 2011,21(7):1334-1336.
[8]冯笑峰.肿瘤医院感染病原菌分布特点及耐药性分析[J].中华医院感染学杂志,2007,17(8):1018-1020.
[9]曹小利,郑波,王鹏远,等.外科重症监护病房中铜绿假单胞菌耐药性及同源性分析[J].中国临床药理学杂志, 2010,26(8):589-592.
[10]高巧营,管卫,孙兰菊,等.儿童医院住院患儿铜绿假单胞菌的同源性[J].中国感染控制杂志,2011,10(3): 161-165.
[11]Hunter S B,Vauterin P,Lambert-Fair M A,et al.Establishment of a universal size standard strain for use with the pulse net standardized pulsed-field gel electrophoresis protocols:converting the national databases to the new size standard[J].J Clin Microbiol,2005,43 (3):1045-1050.
[12]Mazurek G H,Reddy V,Marston B J,et al.DNA fingerprinting by infrequnet-restriction-site amplification [J].J Clin Microbiol,1996,34(10):2386-2390.
[13]Sonntag A K,Prager R,Bielaszewska M,et al.Phenotypic and genotypic analyses of enterohemorrhagic escherichia coli O139 strains from patients in Germany [J].J Clin Microbiol,2004,42(3):954-962.
[14]李喜莹,李珊珊.生物芯片技术及其在临床检验医学中的应用进展[J].分子诊断与治疗杂志,2011,3(1): 62-67.
[15]金中淦,葛平,徐蓉,等.16S rRNA、16S-23S rRNA基因测序分析检测主要血流感染病原菌比较[J].分子诊断与治疗杂志,2012,4(3):181-185.
Homologyanalysisofnasopharyngealcarcinomaradiotherapyinpatientswithgenotypesof Pseudomonas aeruginosa infection
LI Chuanjie1★,LI Jun2,TAO Jianping3,GAO Jianquan4,LIANG Jinhui4,CAI yonglin2
(1.The Infectious Department of the Wuzhou Red Cross Hospital,Wuzhou,Guangxi,China,543002; 2.The Key Laboratory of Nasopharyngeal Carcinoma Etiology and Molecular Mechanism of the Wuzhou Red Cross Hospital,Wuzhou,Guangxi,China,543002;3.The Clinical Microbiology Laboratory of the Wuzhou Red Cross Hospital,Wuzhou,Guangxi,China,543002;4.The Radiotherapy Ward of the Wuzhou Red Cross Hospital,Wuzhou,Guangxi,China,543002)
ObjectiveTo investigate the clinical distributions,drug-fast features and gene homology of pathogenic bacteria in pseudomonas aeruginosa(PA)infection of nasopharyngeal carcinoma (NPC)patients undergoing radiotherapy.MethodsThe drug resistant phenotypes of clinical isolated bacteria were identified by using BD Phoenix 100 automatic bacteria identification system and conducted under CLSI M100-S23 guidelines.The gene homology was analyzed with random amplified polymorphic DNA(RAPD)technique.Results49 strains of PA were observed from 43 NPC patients with nosocomial infection and the major infected sample types were consisted of throat swab(46.94%),phlegm(32.65%), and oral secretions(10.20%).32 strains of drug-fast phenotypes in groupⅠ,7 strains in groupⅡ,5 strains in groupⅢ,5 strains in groupⅣ,and 5 strains in groupⅤwere detected.46 electrophoresis diagrams and19 genotypes were identified from 49 PA samples.The highly homologous genotypes of type H strain and type J strain were observed in the Second Ward of Radiotherapy(57.14%)and the Fourth Ward of Radiotherapy(60.0%),respectively.And there were no significant genetic relations in drug-fast groupⅢand groupⅣ.The highly homologous of PA were localized epidemic in different wards,while the sporadic infections were observed in some highly resistant strains with different genotypes and the similarity drug-fast features were founded in the strains with close relationship.ConclusionIt is important to analyze the gene homology of pathogenic bacteria in monitoring and tracking nosocomial infections by using the genotyping technologies.
Nasopharyngeal carcinoma;Radiotherapy;Pseudomonas aeruginosa;Nosocomial infection;Homology
·论著·
广西壮族自治区梧州市科技计划(201302001)
1.梧州市红十字会医院感染科,广西,梧州543002 2.梧州市卫生系统鼻咽癌病因学及分子机理重点实验室,广西,梧州543002 3.梧州市红十字会医院微生物室,广西,梧州543002 4.梧州市红十字会医院放疗科,广西,梧州543002
★通讯作者:李传杰,E-mail:lcj007@139.com
