阿瑞吡坦中间体3,5-双(三氟甲基)苯乙醇的不对称合成
2014-03-03杜刚
杜 刚
阿瑞吡坦中间体3,5-双(三氟甲基)苯乙醇的不对称合成
杜 刚
(陕西国防工业职业技术学院化学工程学院,陕西西安710302)
手性醇是手性药物重要的砌块,手性3,5-双(三氟甲基)苯乙醇是手性药物阿瑞吡坦的砌块。本文综述了手性3,5-双(三氟甲基)苯乙醇催化合成方法,并对各种合成方法进行的比较分析。
中间体;3,5-双(三氟甲基)苯乙醇;不对称合成
手性醇是手性药物重要的砌块,手性化合物3, 5-双(三氟甲基)苯乙醇是合成阿瑞吡坦的关键中间体[1,2],阿瑞吡坦具有减少呕吐和延迟性呕吐的效果[3]。当前不对称合成手性3,5-双(三氟甲基)苯乙醇的方法主要有化学法[4]和生物法[5],本文重点对这两种合成方法进行比较分析。
1 化学催化法
化学催化法不对称合成手性醇通常具有较高的收率高,反应速度快,但是条件苛刻,催化剂昂贵,手性醇的对映体过剩量低的问题。化学催化合成的催化剂种类有很多,常用的有噁族硼烷类催化剂(CBS)[6],以及手性配体与钌(Ru)、铱(Ir)等过渡金属形成的络合物催化剂[7]等。Zero[8]利用脯氨酰胺配体钌催化剂以甲酸钠为氢供体,催化还原酮得到相应的(S)-3,5-双(三氟甲基)苯乙醇,产79%,e.e.值分别为89%。蒲国荣[9]以[RuCl2(C10H14)2]2为催化剂,(1S,2R)-(-)-1-氨基-2-茚醇为配体,催化1, 3-双(三氟甲基)苯乙酮在异丙醇中发生不对称氢化还原反应得到(R)-3,5-双(三氟甲基)苯乙醇。反应时间对于反应有着重要影响,随着反应时间的延长,1,3-双(三氟甲基)苯乙酮的转化率呈增加趋势,当反应时间达到6h,转化率达到99.3%,e.e.值可达91.2%。最佳反应温度为50℃,催化剂和配体摩尔比选择2.5为宜。底物浓度的提高,3,5-双(三氟甲基)苯乙酮的转化率和选择性先增加后减少,当底物浓度为0.0957mol·L-1时,转化率达到99.3%,选择性也较高。Li[10]以钌(II)的络合物为催化剂不对称还原3,5-双(三氟基)苯乙酮为还原底物,得到99.9%的转化率和99.6%的光学产率。
2 生物催化法
2.1 生物催化剂的选择
生物催化法作为催化合成手性醇的重要手段,生物催化的选取成为生物催化合成的关键,直接决定着产物的产率及高对映体过剩量的高低。为了找到合适的催化剂通常采取通过生物筛选的方法。目前可用于不对称催化合成手性醇化合物的微生物有很多种,如有曲霉、假丝酵母、蓝藻、植物细胞以及不同来源的醇脱氢酶[11]等。Cheng[12]用苯乙酮作为唯一的碳源从土壤中分离得到酵母Rhodotorula sp.AS2.2241可转化苯乙酮成(S)-苯乙醇。产率为34.7%,ee值为99.5%。欧志敏[13]从20株酵母菌中筛选出具有强选择性菌株SaccharomycesP2、Saccharomyces B5和Candida 104进行催化反应,得到高光学纯度3-氯-1-苯丙醇。Homann等[14]从大量种微生物中筛选得到热带假丝酵母(Candida tropicalis)46491菌株,催化合成(R)3,5-双三氟甲基苯乙醇时,产率为93%,ee值为92%。Gelo[15]利用开菲尔乳杆菌(Lactobacillus kefir)和黑曲霉(Aspergillus niger)制备(R)-3,5双(三氟甲基)苯乙醇时,得到e.e.值最高大于99%。
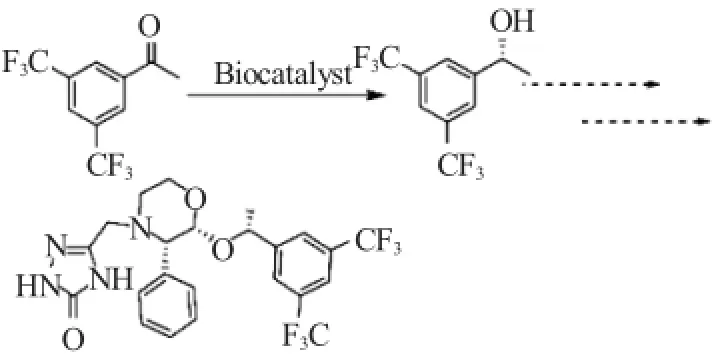
图1 生物催化合成(R)-3,5-双(三氟甲基)苯乙醇Fig.1Biocatalytic synthesis of(R)-3,5-bis(trifluoromethyl)-1-phenethanol
2.2 微生物催化法
微生物催化是利用微生物体内的酶进行转化,具有操作简单,催化剂廉价易得,反应条件温和,在反应过程中不需要破坏细胞,不需要生物酶的提纯,同时也无需添加辅酶,大大降低了成本。
微生物催化法通常的反应体系为水相体系,微生物在水相中能够正常维持生命活动,利于底物进入微生物体内完成催化过程,通常在合适的条件下转化率较高。盖萍[16]通过筛选得到一株氧化微杆菌C3(Microbacterium oxydans C3),其能不对称还原底物3,5-双(三氟甲基)苯乙酮为(R)-3,5-双(三氟甲基)苯乙醇.在底物浓度为5g·L-1时,生物转化反应40h,能达到>99%的e.e.值和95%的底物转化率.底物浓度提高到50g·L-1时,生物转化的e.e.值依然保持99%,并能达到56%的转化率。邢晔[17]发现在白酒酿造微生物菌株都具有羰基还原酶活力,绝大多数符合Prelog规则,从中筛选出拟威尔酵母属Williopsis sp.2.045在转化底物3,5-双三氟甲基苯乙酮时的转化率以及S构型产物光学纯度均高于99%;红酵母属Rhodotorula sp.2.154在转化底物N-甲基-3-羰基-3-(2-噻吩)丙酰胺时的转化率达到了95%,S构型产物光学纯度达到了99%。Li[18]以乙醇和甘油为双共底物,利用棘孢木霉Trichoderma asperellumZJPH0810不对称还原3,5-双三氟甲基苯乙酮,手性醇ee值大于98%,产率达到93.4%。总之,在水相体系中的反应由于细胞所处环境友好,细胞正常代谢功能较强,一般会得到较高转化产率。
在水相反应体系中离子溶液会影响微生物的正常代谢,进而影响不对称催化的产率和对映体过剩量。欧阳启[19]采用琼脂扩散法、糖代谢活力保留法和细胞生长抑制试验评价了6种离子液体对热带假丝酵母104细胞的影响,发现离子液体对于产率的影响较大,但是对于e.e.值几乎不影响。王普[20]在1-丁基-3-甲基咪唑六氟磷酸盐[BMIM]PF6/缓冲液两相体系中,利用热带假丝酵母104细胞催化3,5-双三氟甲基苯乙酮不对称还原制备(S)-3,5-双(三氟甲基)苯乙醇的反应过程。通过考查离子液体浓度、辅助底物种类和浓度、底物浓度、菌体浓度和转化时间等对生物还原反应的影响,发现这些因素基本不影响产物手性醇的光学纯度。在反应条件为[BMIM]PF6体积分数5%,辅助底物为60g·L-1异丙醇,底物3,5-双三氟甲基苯乙酮浓度70mmol· L-1,菌体浓度350g·L-1,转化时间24h,产率达82.5%,产物(S)3,5-双(三氟甲基)苯乙醇的对映体过量值大于99.9%。
除了水相反应体系外,有机/水两相反应体系也是研究的重点。有机相的加入使底物可以减少反应产物的水相的中浓度,减少产物对于微生物的影响,但是有机相的加入也可能对细胞的正常代谢造成影响,选取环境友好、无毒的有机相是两相反应体系的关键。薛颖[21]在有机/水两相体系中,利用固定化酵母细胞生物合成(S)-3,5-双(三氟甲基)苯乙醇。发现LogP值较大的非极性溶剂中转化率较高,e.e.值为95%,与单一的缓冲液体系相比,回收率和e.e.值均有较大提高。在辛烷一缓冲液两相体系中转化率和产物的e.e.值分别为93%和96.3%。张芳[22]利用非离子表面活性剂组成的反应介质对3, 5-双(三氟甲基)苯乙酮进行生物转化,生产3,5-双(三氟甲基)苯乙醇。发现在非离子表面活性剂组成的反应体系比辛烷/缓冲液两相体系,产物浓度提高91.3%,转化率提高78.1%,并且细胞经4次循环使用,活性仍保持80%以上。
3.3 酶催化法
酶催化的反应简单、容易控制、操作稳定性好,产物容易分离纯化,整个工艺易于放大、适合工业化应用。酶催化效率很高,而且底物具有高度专一性,产物的光学纯度高,反应条件温和,一般在室温条件下就能反应等特点。陈伊军[23]利用来自棒状杆菌corynebateriumST-10菌株的羰基还原酶CR为催化剂,在有机-缓冲溶液的体系中加入辅酶NADH或NAD+,利用异丙醇作为提供氢源实现辅酶再生循环,并且酶的催化酶的催化能力较强,每ml酶活力单位可催化底物浓度达到70g·L-1,(R)-3,5-双(三氟甲基)苯乙醇产率在70%以上,e.e.值大于99%。
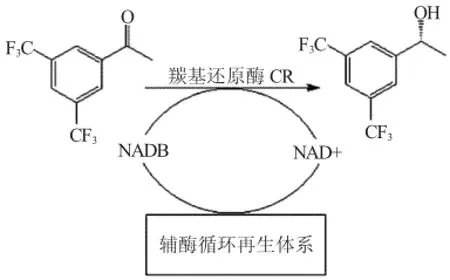
图2 酶催化合成(R)-3,5-双(三氟甲基)苯乙醇Fig.2 Enzymatic synthesis of(R)-3,5-bis(trifluoromethyl)-1-phenethanol
3 结语
光学纯3,5-双(三氟甲基)苯乙醇作为阿瑞吡坦重要的砌块,在其合成方法中,化学催化法通常具有较高的底物浓度,产率较好,但是对映体过剩量较低,催化剂的选择性也较差。微生物催化法合成手性3,5-双(三氟甲基)苯乙醇具有友好的反应条件、对映体过剩量高等特点,但是由于受到微生物耐受性的影响,底物浓度较低,如果浓度过高则产率下降严重。酶催化法虽然没有生物耐受性问题,但是酶的提取、保存等条件苛刻,并且产物与催化剂的分离提纯也需要解决,这为酶催化法生产3, 5-双(三氟甲基)苯乙醇带来了巨大的困难。总之,光学纯3,5-双(三氟甲基)苯乙醇的催化合成存在的问题还需要进一步研究。
[1]Karel M.J.Brands,Joseph F.Payack,Jonathan D.Rosen,et al. Efficient Synthesis of NK1 Receptor Antagonist Aprepitant Using a Crystallization-Induced Diastereoselective Transformation[J].J.Am. Chem.Soc.,2003,125(8):2129-2135.
[2]马礼宽,单晓燕,石惠麟.阿瑞吡坦合成路线图解[J].中国医药工业杂志,2009,40(12):951-953.
[3]聂映,毕小玲,尤启东.阿瑞吡坦[J].中国新药杂志,2006,15(3):238-239
[4]Naud F,Malan C,Spindler F,et al.Ru-(Phosphine Oxazoline)complexes as efective,Industirally viable catalysts for the enantioselective hydrogenation of aryl ketones,Advanced Synthesis Catalysis[J].2006,348:47-50.
[5]何军邀,唐俊,王普等.手性1-[3,5-双(三氟甲基)苯基]乙醇的合成与拆分[J].科技通报,2011,27(3):321-325.
[6]白灵,肖鸽,卓广澜.CBS催化硼烷胺配合物不对称还原法制备(s) 3-氯-1-苯基-1-丙醇[J].应用化学,2012,29(9):1087-1089.
[7]Jing Q,Zhang X,Sun J,et al.Bulky achiral triayrlphos-phines mimic BINAP in Ru(II)-catalyzed asymmetirc hydrogenation of ketones[J].Advanced Synthesis Catla-ysis,2005,347:1193-1197.
[8]Zeror S,Collin J,Fiaud J C,et al.Evlauation ofligands for ketone reduction by asymmetirc hydirde transfer in water by multi-substrate scerening[J].AdvancedSynthesisCatlaysis.2008,350:197-204.
[9]蒲国荣,周龙昌,向忠权,等.(R)-3,5-双(三氟甲基)苯乙醇不对称合成工艺[J].精细化工,2013,30(4):468-470.
[10]Li Wei,Sun Xianfeng,Zhou Le,et al.Highly eifcient and highly enantioselective Asymmetric hydrogenation of ketones with tunesphos/1,2-diamine-ruthenium(II)com-plexes[J].Journla of Organic Chemistry,2009,74:1397-1399.
[11]Petra H.,Thomas R.,Josef A.r and Uwe T.B.,Efficient resolution ofprostereogenic arylaliphatic ketones usinga recombinant alcohol dehydrogenase from pseudomonasfluorescens[J].Tetrah.:Asymm., 2001,(12):1207-210.
[12]ChengC.,MaJ.H.Enantioselectivesynthesis of S-(-)-1-Phenyt hanolin candidautilissemi-fed-bathtch cultures[J].Pro.Biochem., 1996,31:119-124.
[13]欧志敏,微生物法制备抗抑郁药R-托莫西汀中间体[J].无锡轻工大学学报,2003,23(1):43-48.
[14]Homann M J,Vail R B,Previte E,et al.Rapid identiif.cation of enantioselective ketone reductions using targeted microbial libraries[J].Tetrahedorn,2004,60:789-797.
[15]Gelo·Pujic M,Guyader F L,Schlama T.Microbial and homogenous asymmetric catlaysis in the reduction of 1-[3,5-bis(trifluoormethy1)-pheny1]ethanone[J].Tetrahedron Asymmetyr,2006,17:2000-2005.
[16]盖萍,汤传根,刘静媛,等.氧化微杆菌C3催化3,5-双(三氟甲基)苯乙酮的不对称反-Prelog还原[J].应用与环境生物学报,2013,19(1):37-42.
[17]邢晔,刘艳,张超,等.中国白酒酿造物料中分离的酵母菌株在不对称羰基还原中的应用[J].应用与环境生物学报,2013,19(6):1014-1019.
[18]Jun Li,Pu Wang,Jun-YaoHe,et al.Efficient biocatalytic synthesis of(R)-[3,5-bis(trifluoromethyl)phenyl]ethanol by a newly isolated Trichoderma asperellum ZJPH0810 using dual cosubstrate:ethanol and glycerol[J].Applied Microbiology and Biotechnology,2013,97(15):6685-6692.
[19]欧阳启,黄金,王普,等.离子液体对热带假丝酵母细胞生物相容性的研究[J].浙江工业大学学报,2013,41(3):254-259.
[20]王普,苏会贞,何军邀,等.离子液体/缓冲液两相体系中热带假丝酵母不对称还原制备(S)-1-[3,5-双(三氟甲基)苯基]乙醇[J].高校化学工程学报,2012,26(2):279-284.
[21]薛颖,张芳,王昊怫,等.两相体系中固定化细胞生物合成(S)-3,5-双(三氟甲基)苯乙醇[J].中国医药工业杂志,2009,40(8):573-577.
[22]张芳,王旻,李莉,等.浊点系统中红酵母静息细胞生物还原3,5-二(三氟甲基)苯乙酮[J].中国医药工业杂志,2012,43(12):978-981.
[23]陈伊军,张宝杰,吴旭日.一种制备(R)-1-[3,5-双(三氟甲基)苯基]乙醇的方法[P].CN:103233045A,2013-05-06.
Asymmetric synthesis of 3,5-bis(trifluoromethyl)-1-phenethanol
DU Gang
(Department of Chemical Engineering,Shaanxi Institute of Technology,Xi'an 710302,China)
Enantiomerically pure alcohols was particularly useful as building blocks for the synthesis of pharmaceuticals,3,5-Bis(trifluoromethyl)-1-phenethanol was building blocks of Aprepitant.Progress on the synthesis of chiral3,5-bis(trifluoromethyl)-1-phenethanol with the comparative analysis of synthetic methods was also summarized.
pharmaceutical intermediates;3,5-bis(trifluoromethyl)-1-phenethanol;asymmetric synthesis
O641.6
A
1002-1124(2014)08-0058-03
2014-04-09
杜刚(1975-),男,讲师,硕士,毕业于山西大学,应用化学专业,现从事生物化工研究。
