A型主动脉夹层患者术后呼吸功能不全死亡的相关危险因素分析
2014-03-03吴怡锦范瑞新曾嵘熊卫萍范小平
吴怡锦,范瑞新 ,曾嵘, 熊卫萍, 范小平
A型主动脉夹层患者术后呼吸功能不全死亡的相关危险因素分析
吴怡锦,范瑞新 ,曾嵘, 熊卫萍, 范小平
目的:分析Stanford A型主动脉夹层患者在主动脉瓣替换术后呼吸功能不全死亡的相关危险因素。
主动脉夹层;呼吸功能不全;死亡;危险因素
(Chinese Circulation Journal, 2014,29:710.)
急性呼吸功能不全(ARD)是心血管术后常见并发症之一。主动脉手术术程较复杂,时间长,尤其A型主动脉夹层常需要在深低温停循环下完成主动脉弓部替换,深低温停循环引起的肺组织低温和灌注减少,以及急性夹层引发的全身炎症反应都增加急性肺损伤的发生率,程度轻重不等,大部分患者经过合理的围术期肺保护治疗可以获得治愈,但仍有相当部分患者出现ARD后死亡[1,2]。我们探讨A型主动脉夹层术后ARD死亡的发生率,分析相关的危险因素,为改善主动脉夹层术后ARD的预后提供依据。
1 资料和方法
2010-01至2012-12在我院行主动脉瓣替换的Stanford A型主动脉夹层患者223例,术后出现ARD 80例,男61例,女19例;平均年龄(49.2±11.6)岁。根据术后是否出现死亡分为死亡组(n=18)和非死亡组(n=62)。
手术采用静吸复合麻醉全身深低温(鼻咽温18~20℃),下半身停循环加低流量选择性脑灌注。术中通过四分支人工血管的灌注支和右腋动脉插管对上、下半身分别灌注,保护大脑和脊髓。手术方式包括Bentall、Wheat、Cabrol+升主动脉及全弓替换+降主动脉支架象鼻手术,升主动脉及全弓替换+降主动脉支架象鼻手术,单纯主动脉根部替换及升主动脉替换术,升主动脉及部分主动脉弓替换,同期行冠状动脉旁路移植术及主动脉瓣成型术。
首先游离腋动脉,胸部正中切口游离头臂动脉,通过腋动脉和右心房插管建立体外循环,经右上肺静脉插左心引流管,开始体外循环全身降温。阻断升主动脉,切开升主动脉后,经左右冠状动脉开口灌注冷血心脏停跳液保护心肌。首先进行近心端操作及主动脉瓣成型或替换、主动脉窦重建和主动脉根部替换、主动脉窦重建和主动脉根部替换。鼻咽温降至18~20℃时,暂停体外循环,取头低位,分别阻断头臂动脉,进行低流量选择性脑灌注。于左锁骨下动脉开口远端横断主动脉,将直径28~32 mm带支架人工血管远端插入降主动脉真腔,吻合四分支人工血管远端与胸降主动脉,然后通过人工血管的灌注分支插入动脉供血管,排气后恢复胸降主动脉血流灌注,再依次完成左锁骨下动脉、左颈总动脉、无名动脉近端与人工血管的分支吻合。排气后开发头臂动脉的阻断钳,阻断近端人工血管,恢复体外循环并开始复温,将带分支人工血管近端与升主动脉做端端吻合。再将心脏排气后开放阻断钳,心脏复苏,手术完成。
记录人口学特征,性别、年龄、吸烟史、糖尿病史、高血压史、马凡综合征;术前急性夹层、二次手术、术前低氧、器官灌注不良、左心室舒张末径及射血分数;术中心肺转流时间、主动脉阻断时间、深低温停循环时间、右半弓或全弓替换、同期冠状动脉旁路移植手术、主动脉瓣替换或整形、出血(术中及术后24 h内输浓缩红细胞或二次开胸止血);术后重症监护室(ICU)停留时间、呼吸机使用时间、脑部并发症、截瘫、肺部感染、心脏不良事件(停跳或重度低心排)、肾功能衰竭、肝功能不全、败血症、伤口愈合不良等并发症。
术后早期并发症的诊断:ARD不全定义为术后72 h内发生的低氧血症(PaO2/FiO2<150),术前无肺间质和肺血管病变,并除外术后肺水肿、肺栓塞、肺部感染、血(气)胸等因素引起的低氧血症。ARD经X线胸片、B型超声心动图除外其他肺内外原因引起的低氧血症;经超声心动图和Swan-Ganz导管监测除外心源性肺水肿[3]。急性肾功能衰竭指尿少(< 400 ml),无尿,需要行肾脏替代治疗。肝功能不全指术后1周内出现谷丙转氨酶(GPT)>200 U/L、总胆红素(TBIL)>50 mmol/L及乳酸脱氢酶(LDH)>500 U/L[4]。脑部并发症轻度为一过性脑功能紊乱指术后清醒延迟,一过性的烦躁和谵妄;永久性为脑梗死包括一侧偏瘫和昏迷,由头颅计算机断层摄影术(CT)扫描证实[5]。脊髓损伤主要为双下肢或四肢瘫痪,根据临床症状和神经系统检查,由神经科医生协助诊断。
统计学分析:应用SPSS15 for Windows软件进行统计学分析。计量资料以表示,计数资料以例数或百分数表示。对ARD患者死亡的相关危险因素分别进行单因素分析(计量资料做独立样本的Studentt检验,计数资料做χ2检验或Fisher检验)及多因素Logistic回归分析。以P<0.05表示差异有统计学意义。
2 结果
223例患者中,术后72 h内发生ARD的80例(35.9%),全组平均体外循环时间(222±60)min,主动脉阻断时间(101±30)min,选择性脑灌注时间(深低温停循环) 时间(32±12)min ,其中死亡18例,死亡率22.5%。
死亡组女性比例,术中和术后24 h输红细胞,呼吸机使用时间,永久性意识障碍,心脏不良事件(严重低心排或恶性心律失常),急性肾功能衰竭连续性血液净化治疗,肝功能不全,肺部感染,败血症的发生率较非死亡组差异有统计学意义(P<0.05)。表1

表1 死亡组与非死亡组临床资料比较[例(%)]
对A型主动脉夹层术前、术中及术后可能的危险因素进行多元Logistic回归分析显示,女性、急性肾功能衰竭是术后呼吸功能不全死亡的独立相关危险因素。表2
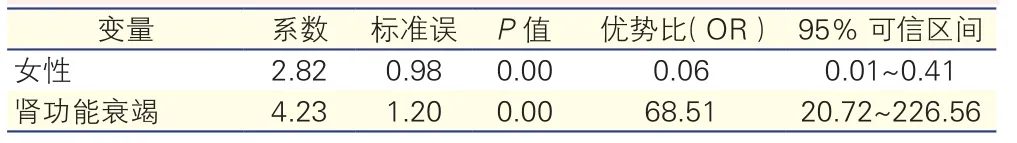
表2 A型主动脉夹层患者术后呼吸功能不全死亡影响因素的Logistic回归分析
3 讨论
A型主动脉夹层病变广泛,手术技术难度大,涉及的重要脏器多,手术并发症及病死率相对较高。近年随着外科技术的不断提高,术后病死率已明显降低,但术后早期的并发症仍然是主动脉夹层患者院内死亡的独立危险因素[5]。近年来,主动脉夹层术后早期急性肺损伤导致的低氧血症越来越受到关注,很多研究报道主动脉夹层术后ARD在围术期的发病率大于10%~40%,同时是主动脉夹层术后死亡的原因之一,与ARD相关的病死率可达20%[6]。本组ARD的发病率为31.7%,相关死亡率22.5%。死亡的原因可能与低氧导致的器官功能缺氧损伤,外科重症监护病房时间延长,机械通气时间长,继发感染,进一步加重了多器官功能障碍有关。
在国内的研究中,阜外心血管病医院曾报道766例Stanford A型主动脉夹层术后院内死亡的危险因素分析,提示女性、急性病程、肾功能不全、心功能不全、术后开胸止血、输血量为Stanford A型主动脉夹层术后院内死亡的独立危险因素[7]。安贞医院报道252例Stanford A型主动脉夹层,多元Logistic回归分析显示脊髓损伤、肾功能衰竭和肝功能不全是住院死亡的危险因素[8]。很多研究中发现ARD的发病率医院死亡组明显高于非死亡组,但并不是医院死亡的独立危险因素[9],结果也得到上述研究证实。本研究回顾性研究A型主动脉夹层术前、术中、术后的可能危险因素,进一步分析与ARD相关的死亡风险,我们的结果与上述单位的结果有交叉重合,包括女性、术中与术后的出血、心脏不良事件、肝功能不全、肾功能衰竭,其中肾功能衰竭是共同筛选出来的独立危险因素。
在这些相关危险因素中,有些是与ARD合并独立存在的,在术中及术后早期即出现的,有些不排除是继发ARD之后,包括呼吸机使用时间延长,肺部及全身感染,以及部分术后延迟出现的心肝肾功能不全,最终形成多器官功能不全的恶性循环,导致死亡。注意ARD发生后的器官功能保护,防治感染或者可以降低ARD后死亡的危险。值得加强注意的是术中及术后24 h输红细胞在两组中有显著差异,出血和输血所导致的输血相关性肺损伤即是心脏术后ARD发病的危险因素,也是导致术后死亡增加的原因之一,已在国内外研究中得到证实[10],尽可能减少手术中的出血与输血有利于提高手术的预后已经较有共识 。
本组研究中女性并发ARD19例(23.8%),死亡8/19例(42.1%),较男性死亡10/61例(16.4%)明显升高,是ARD院内死亡的独立危险因素。国际急性主动脉夹层注册研究发现,不同性别在A型主动脉夹层的临床特征、治疗和预后方面有很大不同[11]。与男性相比,女性患者临床症状多不典型,更少出现典型的疼痛,神经症状及意识改变也较少出现,因此临床上易出现漏诊、误诊、延迟诊断,就诊时反而病情加重,并发症及高危因素增多,包括夹层累及范围延展、冠状动脉受累、休克、心包填塞等,最终导致女性预后较男性患者差。在本组病例中有5/19例(26.3%)女性患者出现术前低氧,其中4例死亡;4/19例(21.1%)女性同期行冠状动脉旁路移植术,其中3例死亡;12/19例(63.2%)女性发生继发肺部感染,死亡5例,也提示了女性患者术后机体免疫力低下,易并发ARD后的肺部及全身感染,进一步致多器官功能恶化导致死亡。
在国内外的研究中,肾功能衰竭都是A型主动脉夹层术后早期的并发症,发病率死亡组明显高于非死亡组,即使床旁血滤治疗是急性肾功能衰竭有效的替代治疗,术后肾功能衰竭仍是A型主动脉夹层术后医院内死亡的独立危险因素[7,12-15]。肾脏是高血流灌注、高耗氧量的器官,对缺血缺氧非常敏感,夹层术中的出血、低血压、停循环所引起的肾低流量灌注可引起肾脏的缺血性损伤,若不及时纠正可使肾小管细胞坏死、脱落,阻塞肾小管,使腔内压力升高,肾小球滤过率降低,并诱发肾素—血管紧张素系统激活,使肾小球血管收缩,进一步降低肾小球滤过率,最终变成不可逆的损伤。术后肾功能衰竭造成手术和心肺转流产生的毒素和代谢产物不能及时清除,它们在体内堆积可进一步加重脑及其他终末脏器损伤,导致多脏器功能衰竭。在研究中有8例出现术前灌注不良,5例临床表现为不同程度的肌酐值升高,术后都发展为急性肾功能衰竭,需连续性血液净化治疗,其中3例死亡,这也提示如果有病例术前就出现不同程度的肾功能不全,预示夹层已累及肾动脉,加上急诊手术,深低温停循环,全身炎症反应,缺血再灌注损伤的打击,极易出现术后进一步的肾功能损害以及其他并发症,与国外某些研究是符合的[16]。
本研究为单中心回顾性研究,因为是单中心,病例数有限,且又是回顾性研究,存在诸多局限性,应用Logistic回归模型虽能分析出术后死亡的独立危险因素,但尚不能得出明确的因果关系。但通过对危险因素的分析,有利于提高临床医生对Stanford A型主动脉夹层手术治疗的认识水平,有意识地避免或纠正可控性的危险因素,提高手术治疗的效果,最终降低手术的病死率。
[1] 田力, 樊晓寒, 朱俊, 等. A型急性主动脉夹层患者血浆D二聚体浓度和住院死亡的关系. 中国循环杂志, 2013, 28: 450-454.
[2] 易定华, 段维勋. 中国主动脉夹层诊疗现状与展望. 中国循环杂志, 2013, 28: 1-2.
[3] Evaldas FD, Thomas TC, Micheal HS, et al. Acute respiratory dysfunction after surgery for acute type A aortic dissection. Eur J Cardiothorac Surg, 2010, 37: 691-696.
[4] Harward TR, Welborn MB, Martin TD, et al. Visceral ischemia and organ dysfunc-tion after thotacoabodominal aortic ane-urysm repair. Ann Surg, 1996, 223: 729-734.
[5] Etz CD, Di Luozzo G, Bello R, et al. Pulmonary complications after descending thoracic and thoracoabodomial aortic aneurysm repair: predictors, prevention, and treatment. Ann Thotac Surg, 2007, 83: S870-S876.
[6] Girdauskas E, Kuntze T, Borger MA. et al. Acute respiratory dysfunction after surgery for acute type A aortic dissection. Eur J Cardiothorac Surg, 2010, 37: 691-696.
[7] 王亮, 常谦, 于存涛, 等. Stanford A型主动脉夹层术后死亡危险因素分析. 中华外科杂志, 2012, 50: 422-425.
[8] 刘楠, 孙立忠, 常谦. 主动脉夹层手术后肝功能不全发生的相关危险因素分析. 中华外科杂志, 2010, 48: 1154-1157.
[9] Apaydin AZ, Buket S, Posacioglu H, et al. Perioperative risk factors for mortality in patients with acute type A aortic dissection. Ann Thorac Surg, 2002, 74: 2034-2049.
[10] Groenereld AB, Jansen EK, Verheij J. Mechanisms of pulmonary dysfunction after on-pump and off pump cardiac surgery: a prospective cohort study. J Cardiothoracic Surg, 2007, 2: 11.
[11] Nienaber CA, Fattori R, Mehta RH, et al. Gender-related differences in acute aortic dissection. Circulation, 2004, 109: 3014-3021.
[12] Martin CE, Forteza A, Perez E, et al. Predictors of mortality and reoperation in acute type-a aortic dissection surgery: 18 years of experience. Rev Esp Cardiol, 2008, 61: 1050-1060.
[13] Rampoldi V, Trimarchi S, Eagle KA, et al. Simple risk models to predict surgical mortality in acute type A aortic dissection: the international Registy of Acute Aortic Dissection score. Ann Thorac Serg, 2007, 83: 55-61.
[14] 尚蔚, 刘楠, 闫晓蕾, 等, A型主动脉夹层手术后早期并发症分析.心肺血管病杂志, 2011, 30: 183-186.
[15] 尚蔚, 刘楠, 闫晓蕾. A型主动脉夹层术后发生呼吸功能不全的危险因素分析. 中华胸心血管外科杂志, 2011, 27: 349-352.
[16] Godon P, Bonnefoy E, Desjeux G, et al. Early risk factors in acute type A aortic dissection: is there a predictor of preoperative mortality? J Cardiovasc Surg(Torino), 2001, 42: 647-650.
Risk Factors Analysis on Acute Respiratory Dysfunction Caused Death in Patients After Type A Aortic Dissection Surgery
WU Yi-jin, FAN Rui-xin, ZENG Rong, XIONG Wei-ping, FAN Xiao-ping.
ICU of Cardiac Surgery, Guangdong Provincial Hospital, Guangzhou (510080), Guangdong, China
FAN Rui-xin, Email: fangruixin@163.com
Objective: To analyze the risk factors on acute respiratory dysfunction caused death in patients after type A aortic dissection surgery.Methods: A total of 223 patients who received aorta replacement surgery in our hospital from 2010-01 to 2012-12 were retrospectively studied. 80 patients suffered from post-operative acute respiratory dysfunction including 61 male and 19 female with the mean age of (49.2 ± 11.6) years. Those patients were divided into 2 groups as Death group, n=18 and Survival group, n=62. We analyzed the most relevant risk factors for death, such as gender, age, histories of smoking, diabetes, hypertension, Marfan syndrome; pre-operative acute or chronic dissection, hypoxemia, mal-perfusion, LVEDD and LVEF; CPB time, aorticclamping time; post-operative ICU retention time, mechanical ventilation time, permanent neurologic dysfunction, pulmonary infection, MACE, renal failure, hypohepatia, septicemia and wound mal-healing, et al.Results: The early post-operative (< 3 days) respiratory dysfunction rate was 35.8% and the mortality was 22.5% (18/80). The relevant risk factors of death included female gender (P=0.019), haemorrhage (P<0.01), mechanical ventilation time (P=0.011), permanent neurologic dysfunction (P =0.013), pulmonary infection (P=0.001), MACE (P=0.022), renal failure (P<0.01), hypohepatia (P<0.01) and septicemia (P=0.001). Female gender and renal failure werethe independent risk factors for respiratory dysfunction caused death in patients after type A aortic dissection surgery.Conclusion: The occurrence and mortality were high in patients after type A aortic dissection surgery especially in those with female gender and post-operative renal failure.
Aotic dissection; Respiratory dysfunction; Death; Risk factor
2014-03-10)
(编辑:漆利萍)
510080 广州市,广东省人民医院 广东省医学科学院 广东省心血管病研究所 心外科
吴怡锦 主治医师 硕士 主要从事心血管外科术后重症监护 Email: wuyijin197876@sina.cn 通讯作者: 范瑞新 Email: fangruixin@163.com
R544.1
A
1000-3614(2014)09-0710-04
10.3969/j.issn.1000-3614.2014.09.014
方法:2010-01至2012-12在开胸手术下行主动脉瓣替换术的A型主动脉夹层患者223例,术后出现呼吸功能不全80例,男61例,女19例;年龄(49.2±11.6)岁。根据术后是否出现死亡分为死亡组(n=18)和非死亡组(n=62)。记录人口学特征,性别、年龄、吸烟史、糖尿病史、高血压史、马凡综合征;术前急性或慢性夹层、二次手术、术前低氧、器官灌注不良、左心室舒张末径及射血分数;术中心肺转流时间、主动脉阻断时间、深低温停循环时间、右半弓或全弓替换、同期冠状动脉旁路移植手术、主动脉瓣替换或成形术出血(术中及术后24 h内输浓缩红细胞或二次开胸止血);术后重症监护室(ICU)停留时间、呼吸机使用时间、气管切开、永久性脑部并发症(昏迷或一侧偏瘫)、截瘫、肺部感染、心脏不良事件(停跳或重度低心排)、肾功能衰竭、肝功能不全、败血症、伤口愈合不良,进行术后呼吸功能不全死亡的相关危险因素分析。
结果:术后早期(<3天)呼吸功能不全发生率为35.8%,其中18例死亡,占22.5%。呼吸功能不全死亡的相关危险因素包括:女性(P=0.019);出血(P<0.01);呼吸机使用时间(P=0.011);永久性脑部并发症(P=0.013);肺部感染(P=0.001);心脏不良事件(P=0.022);肾功能衰竭(P<0.01);肝功能不全(P<0.01);败血症(P=0.001);其中女性(P=0.019)和肾功能衰竭(P=0.001)是术后呼吸功能不全死亡的独立危险因素。
结论:A型主动脉夹层术后呼吸功能不全的发生率及病死率较高,其中女性患者及合并肾功能衰竭患者术后死亡风险显著增加。
