间歇低氧合并肺气肿大鼠系统与内皮炎症状态及外周血内皮祖细胞水平研究*
2014-02-28杨庆婵陈宝元
王 彦 曹 洁 杨庆婵 冯 靖△ 陈宝元
阻塞性睡眠呼吸暂停(OSA)和慢性阻塞性肺疾病(COPD)是最常见的两种慢性呼吸系统性疾病。COPD和OSA共存称为呼吸重叠综合征(OS)[1]。COPD和OSA都与许多炎性细胞因子激活增加和动脉粥样硬化的发病机制相关,因此COPD和OSA都是心血管疾病的独立危险因子[2]。系统和内皮炎症导致的内皮功能障碍的发展初期涉及肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6),这个过程促进了白细胞向内皮细胞滚动和黏附,并在RhoA的协助下,单核细胞和T细胞穿透血管壁,在这里单核细胞转化为巨噬细胞,摄取氧化脂质并形成泡沫细胞。这些细胞聚集形成脂类池,这就是动脉粥样硬化斑块及随后发生心血管疾病的核心成分[2]。COPD和OSA的关系仅仅是两种常见临床症状的简单相加?还是对系统性炎症、动脉粥样硬化甚至心血管疾病有协同作用?目前仍然存在一些争论[3]。本研究通过建立间歇低氧(IH)合并肺气肿大鼠模型,观察OS大鼠系统和内皮炎症状态以及内皮修复能力的损伤程度,探讨IH合并肺气肿对心血管疾病的协同作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性4周龄Wistar大鼠60只,体质量120~150 g,购自中国医学科学院放射医学研究所实验动物中心(许可证号:SCXK津2010-0002),饲养于清洁无菌的二级动物房。该实验通过我院伦理审查委员会批准。
1.1.2 试剂和仪器 (1)大前门烤烟型香烟(天津卷烟厂);混合气体(天津六方气体公司);HE染色液,ELISA试剂盒(南京建成生物科技公司)。(2)熏烟箱(容积约72 L)和密封箱均为储物箱和大号密封盒改制;氧浓度检测仪(瑞士夏美顿公司);低流量流速表(余姚工业自动化仪表厂);氧气减压器(天津减压器厂);血气分析仪(瑞士罗氏AVL995);日本Olympus光学显微镜及图像采集系统;北京航空航天大学多功能彩色病理图像分析系统;FACScalibur流式细胞计数仪、Cell-Quest和Paint-a-Gate软件(Becton Dickinson,San Jose, CA,USA)。
1.2 方法
1.2.1 OS大鼠模型的建立及分组 通过对大鼠进行16周的熏烟暴露造成大鼠肺气肿,在此基础上进行IH暴露。根据暴露条件将其分为4组,每组15只。对照组(A组):假熏烟暴露和间歇正常氧暴露;IH组(B组):假熏烟暴露和IH暴露;肺气肿组(C组):熏烟暴露和间歇正常氧暴露;OS组(D组):熏烟暴露和IH暴露。
1.2.2 动物熏烟暴露 动物饲养在标准鼠笼内(每笼5只),自由摄食和饮水。熏烟暴露装置和以往研究中的相似[4-5]。大鼠每天早晚(9:00前和17:00后)两次于自制熏箱内熏吸香烟共约1 h(每次约30 min),共暴露16周。每只烟含有18 mg焦油,通过同时燃烧5只香烟使饲养舱内的烟雾体积分数约为15%(V/V)。假熏烟暴露组大鼠暴露环境除了香烟燃烧外其他条件相同。
1.2.3 IH暴露 自13~16周,在熏烟暴露同时,每天9:00— 17:00(睡眠时段)将大鼠置于自制IH舱内,向舱内循环充入N2和空气的混合气,每一循环为120 s,30 s充入N2,使舱内最低氧浓度在30 s内达到5%,随后90 s充入压缩空气,使氧浓度逐渐恢复至21%,气流通过时间控制的电磁阀和氧流量表来调控。假IH暴露组的暴露条件除了把N2换成清洁空气外,其他条件相同。
1.2.4 大鼠睡眠结构分析 实验暴露前1周,随机抽取5只大鼠监测大鼠脑电图证明大部分大鼠在9:00~17:00处于睡眠状态,符合Wistar大鼠的基本生理状态。
1.2.5 血气分析 于暴露结束前2 d(第110天),每组随机取5只大鼠以10%水合氯醛(0.1 mL/100 g腹腔注射)轻度麻醉后暴露右股动脉,分别于以下几个时间点取动脉血0.7 mL检测各组大鼠动脉血氧分压p(O2),动脉血二氧化碳分压p(CO2),动脉血氧饱和度(SaO2)和pH值。时间点:(1)对照组大鼠慢波睡眠时。(2)肺气肿组大鼠慢波睡眠时。(3)IH组大鼠慢波睡眠时IH暴露低氧阶段p(O2)最低点。(4)IH组大鼠慢波睡眠时IH暴露复氧阶段p(O2)最高点。(5)OS组大鼠慢波睡眠时IH暴露低氧阶段p(O2)最低点。(6)OS组大鼠慢波睡眠时IH暴露复氧阶段p(O2)最高点。
1.2.6 标本的留取与处理 将各组剩余的10只大鼠麻醉后以仰卧位固定在操作台,每只大鼠用含有200 μL10% EDTA的注射器收集静脉血8~10 mL,在室温下摇晃注射器待下一步处理(<1 h)[4]。收集完血清后暴露颈部与肺脏,取颈动脉及肺组织各1块,置4%甲醛溶液中固定,24 h内石蜡包埋、切片、HE染色,光镜观察。随后纵向剖开颈总动脉并刮取内皮细胞层,以RPMI-1640培养基重悬,调整细胞浓度为3×106/mL,1 mL/孔接种于6孔板,然后放入标准培养箱2 h待测。
1.2.7 TNF-α、IL-6、RhoA水平检测 用ELISA试剂盒测量血浆及颈动脉内皮细胞培养基中TNF-α和IL-6的蛋白水平,然后用PBS冲洗并重悬内皮细胞培养基,从贴壁细胞中提取总RNA,采用Real-time PCR法测定RhoA mRNA表达水平。RhoA引物:上游5′-ATGTGCCCACAGTGTTTGAGAAC-3′,下游5′-TCAGTTCGTAAAGACAGGGTTGC-3′;产物345 bp。GAPDH引物:上游5′-TATTGGGCGCCTGGTCACCA-3′,下游5′-CCACCTTCTTGATGTCATCA-3′;产物726 bp。
1.2.8 颈总动脉炎症评分方法 使用病理图像分析系统测量每只大鼠颈总动脉内中膜厚度(IMT)占全层厚度的比值,以C-IMT%表示。
1.2.9 流式细胞术测定内皮祖细胞(EPC)水平 取大鼠颈静脉血4 mL与Histopaque 1083进行密度梯度离心,取单核细胞(PBMC)富集层。PBMC涂片经吉姆萨染色并进行形态学鉴定,以台盼蓝不相容实验确定其生存率至少为98%方可进行下一步实验,并计算PBMC的总数。然后将PBMC重悬,细胞数调整到1×104/μL,取100 μL PBMC悬浮液,加入PerCP标记的7-氨基放线菌素D(7-AAD)、FITC标记的鼠抗兔CD 34和PE标记的鼠抗兔CD 133共5 μL,混匀后4℃避光孵育20 min,完成后加入2 mL的1∶10稀释的FACS液,将剩余的红细胞溶解,再重新孵育10 min,用2%PBS/BSA(pH=7.4)2 mL洗涤剩余的PBMC,500×g离心5 min,最后用500 μL PBS重悬,再用FACScalibur流式细胞计数仪、Cell-Quest和Painta-Gate软件计数分析。以血细胞计数器计算血细胞总数。最初通过分析同型对照组抗体来确定背景水平,细胞碎片和凋亡细胞通过7-AAD/FSC可以排除,计算CD34+VEGFR2+双阳性细胞的比例,以此表示EPC数量[6]。结果以每μL全血中PBMC数量×EPC百分比表示。
1.3 统计学方法 采用SPSS 17.0软件包进行统计学分析,计量资料以均数±标准差(±s)来表示,多组间比较采用单因素方差分析,组间多重比较采用Bonferroni法,P<0.05为差异有统计学意义。
2 结果
2.1 预试验血气分析结果 预实验各组大鼠的血气值见表1。A组大鼠数据基本符合正常生理状态下的血气值;C组p(O2)略有下降,基本符合大鼠肺气肿的状态;B组和D组大鼠低氧阶段p(O2)<60 mmHg(1 mmHg=0.133 kPa),基本符合大鼠IH的状态。
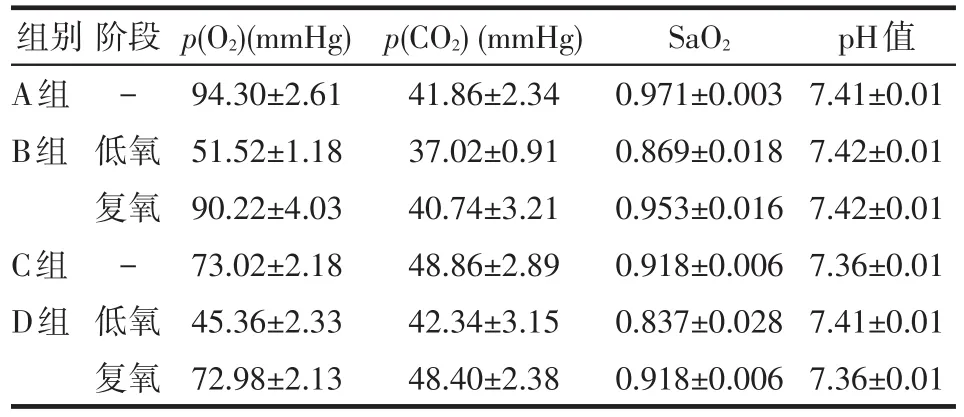
Table 1 The blood gas analysis of preliminary experiment表1 预试验血气分析结果
2.2 肺组织学评价 C组和D组大鼠的病理学特征更明显,表现为炎细胞浸润、肺泡平均截距增加和每个视野平均肺泡数量的减少,符合肺气肿形成标准。各组肺组织的病理图片见图1。
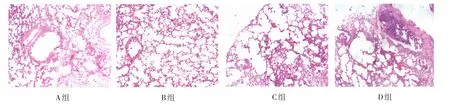
Figure 1 The pathological images of lung tissues between different groups(HE,×40)图1 各组大鼠肺组织病理图片(HE,×40)
2.3 各组血浆中TNF-α和IL-6水平比较 血浆中TNF-α和IL-6的浓度均是D组>C组>B组>A组(均P<0.05),见图2。
2.4 各组右颈总动脉内皮细胞培养基中TNF-α和IL-6水平比较 右颈总动脉内皮细胞培养基中TNF-α和IL-6的相对浓度均是D组>C组>B组>A组(均P<0.05),见图3。
2.5 各组右颈总动脉内皮细胞RhoA mRNA表达水平比较 右颈总动脉内皮细胞RhoA mRNA表达水平也是D组>C组>B组>A组(均P<0.05),见图4。
2.6 右颈总动脉C-IMT% 右颈总动脉C-IMT%是D组最高,A组最低(均P<0.05)。C组与B组差异无统计学意义(P=0.061),见图5。光镜下右颈总动脉内皮细胞病理图片,见图6。
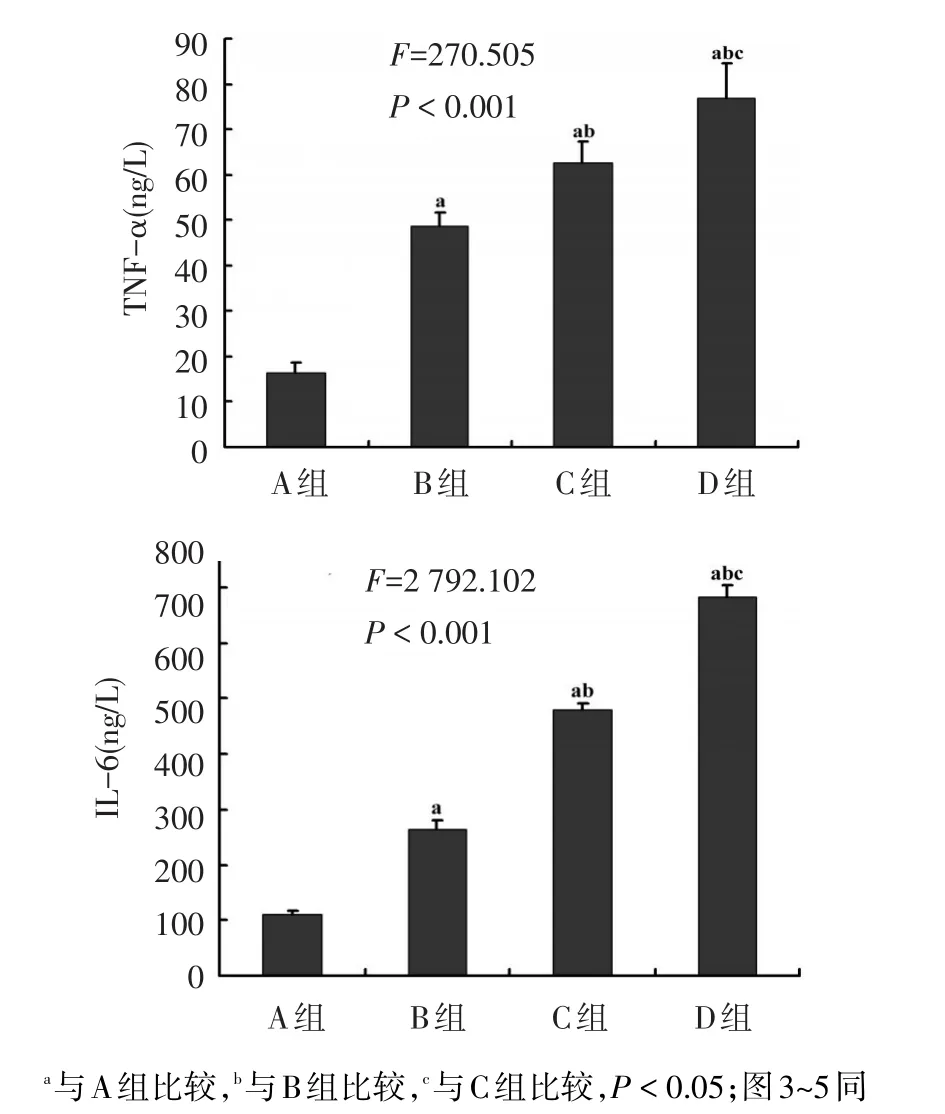
Figure 2 Comparison of plasma levels of TNF-α and IL-6 between four groups图2 各组大鼠血浆中TNF-α和IL-6水平比较
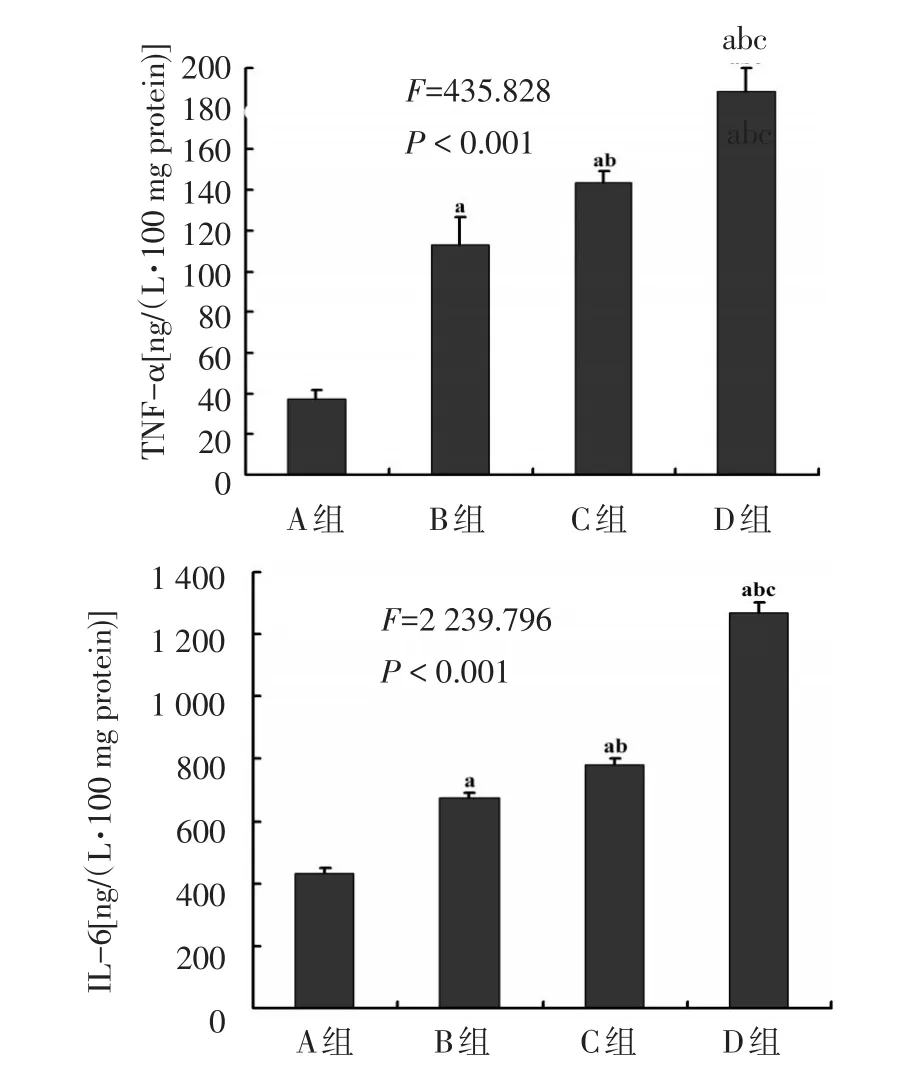
Figure 3 The TNF-α and IL-6 levels in the endothelium of right common carotid artery图3 右颈总动脉内皮细胞培养基中TNF-α和IL-6水平
2.7 外周血EPC相对浓度 D组EPC相对浓度最低,A组最高,B组低于C组(均P<0.05),见图7。各组EPC流式细胞测定结果见图8。
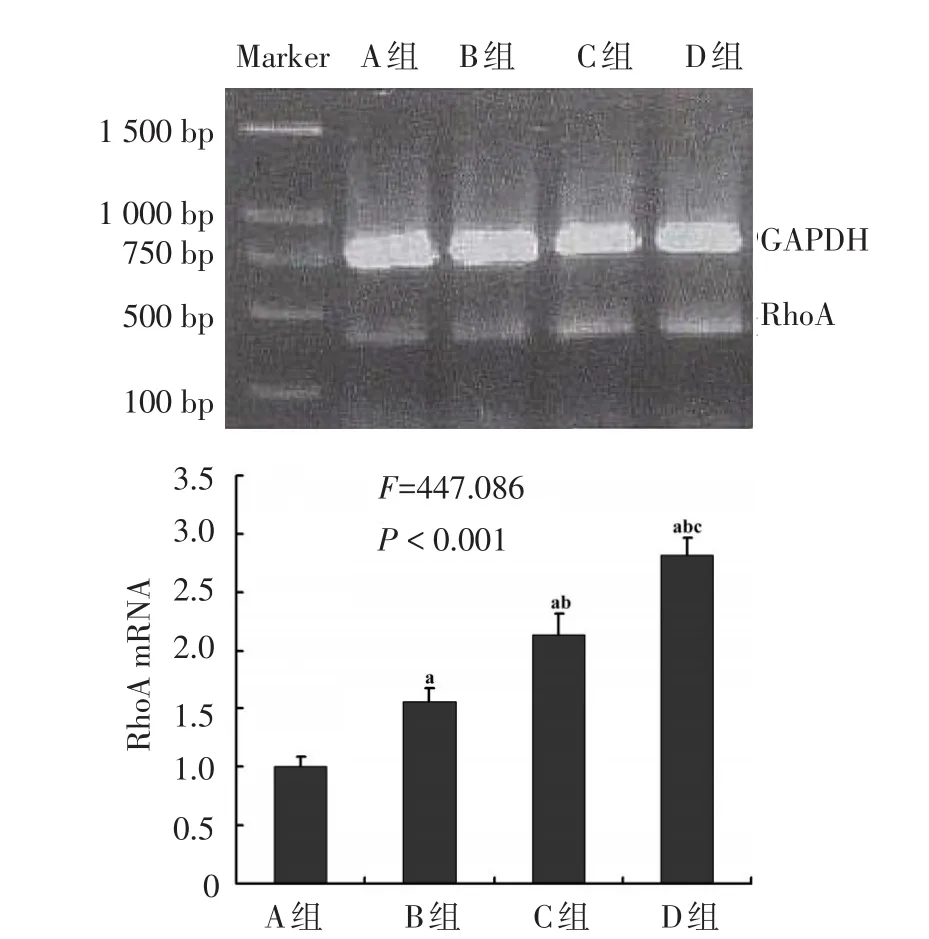
Figure 4 The expression level of RhoA mRNA expression in the endothelium of right common carotid artery图4 右颈总动脉内皮细胞RhoA mRNA表达水平
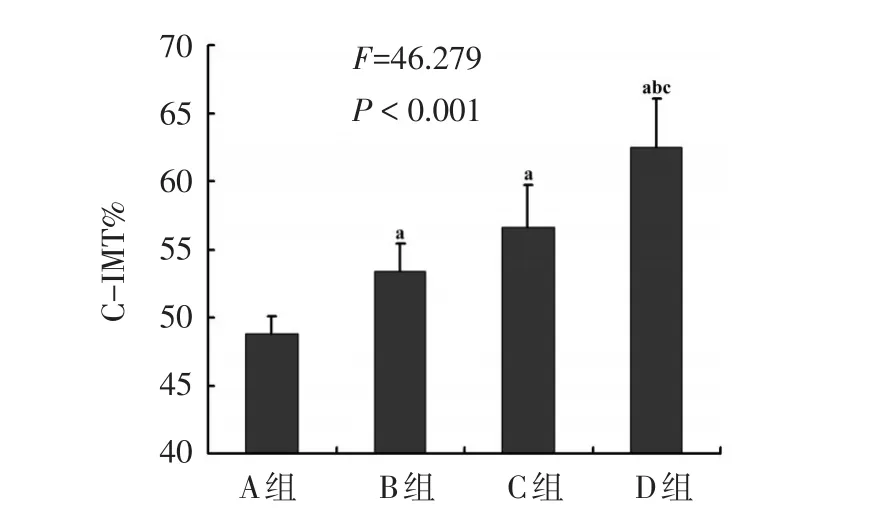
Figure 5 Comparison of C-IMT%in the endothelium of right common carotid artery图5 各组右颈总动脉C-IMT%比较

Figure 6 The pathological images of right common carotid artery in different groups of rats(HE,×40)图6 各组大鼠右颈总动脉病理图片(HE,×40)
3 讨论
COPD和OSA在临床实践中是非常常见的疾病,而OS这一名词常用于这两种疾病的并存状态[1]。本研究通过较长时间的熏烟暴露并经病理确认建立肺气肿模型,然后根据国际睡眠障碍诊断标准(第二版)[7]在大鼠睡眠期间进行低氧暴露,成功地在肺气肿大鼠上模拟了IH,因此建立了OS大鼠模型。该模型是肺气肿和睡眠低氧的合并,并不是真正的OS。本研究的暴露模式形成统一的低氧严重程度和时间,在方法上是合理可行的,且代表了IH的某些病理特征[4]。
动脉粥样硬化和心血管疾病是COPD和OSA的主要合并症[2]。在动脉粥样硬化斑块形成过程中,从脂肪纹理启动到后期的斑块破裂,炎症发挥了关键作用。OSA与COPD都与系统性炎症有关,涉及到C-反应蛋白(CRP)、IL-6和核因子-κB(NF-κB)依赖通道(该通道涉及TNF-α和IL-8)。这种系统炎症有可能是这两种疾病之间相互作用的基础。而且,这两种疾病均有氧化应激,可激活循环白细胞或者使循环白细胞功能障碍。这些发现与临床密切相关,因为系统炎症可能参与了心血管疾病的发生[2]。但是OSA和COPD之间的相关性仅仅是两种相对常见临床疾病的简单相加,还是彼此加重了另一种疾病的发病风险,目前还存在一些争议。
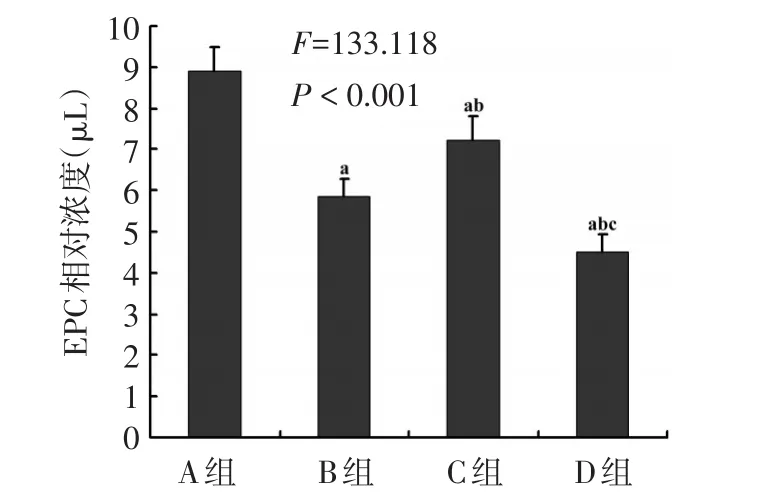
Figure 7 Comparison of EPC level in peripheral blood between four groups图7 各组大鼠外周血EPC比较
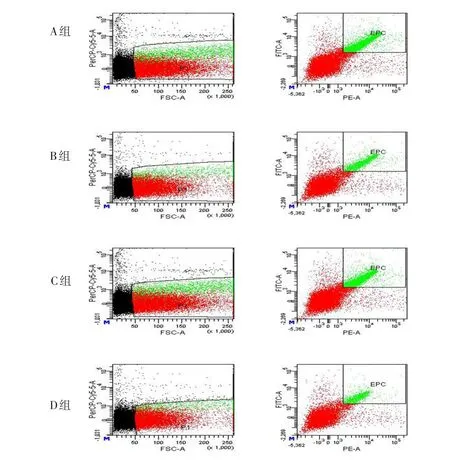
Figure 8 Results of EPC detected by flow cytometry in four groups图8 各组EPC流式细胞测定结果
TNF-α和IL-6是两种最主要的与动脉粥样硬化和其他炎症疾病相关的炎性细胞因子,而高水平的TNF-α和IL-6与冠脉不良事件增加相关,它们可以诱导单核细胞迁移到内皮细胞及内皮细胞下,之后单核细胞成为泡沫细胞,导致动脉粥样硬化的进展。本研究证明OS组比IH或肺气肿组的血浆及内皮细胞TNF-α和IL-6水平均有显著升高,提示IH与肺气肿可以协同加重系统性炎症反应,导致内皮细胞损伤加重。研究报道OSA和COPD患者TNF-α、IL-6均升高[8],与本研究结果一致。系统低氧血症参与COPD患者TNF-α的增加,这一效应与OS密切相关,因为OS低氧血症更加严重。整体上讲,低氧对COPD和OSA患者TNF-α的激活起关键作用。这样,TNF-α和相关细胞因子水平在OS患者中应特别高,因此在OS患者中与片段性IH相关的夜间SaO2下降可能对TNF-α水平的增加产生额外效应。研究OS患者的这一通道对研究心血管疾病中NF-κB依赖通道的作用意义重大[2]。目前关于OS患者炎症标志物的研究很少。
TNF-α诱导NF-κB激活也涉及到RhoA。激活的RhoA使内皮细胞收缩并增加其通透性,当它与IH产生的高黏附力结合后,可使白细胞等炎症细胞更容易通过内皮屏障。RhoA/RhoA激酶(ROCK)的作用是复杂的,缺血再灌注损伤后ROCK活性增加,并且促进白细胞浸润,参与早期炎症反应。笔者以前的研究表明IH激活RhoA转录,然后通过转录产生IL-6等炎症蛋白,其临床意义在于OSA模式IH可以通过激活炎症引起内皮细胞损伤[4]。此外,有研究报道RhoA蛋白表达在COPD组中也明显高于对照组[9]。本研究比较4组大鼠颈动脉内皮细胞RhoA mRNA水平发现OS组是最高的。低氧在COPD RhoA/ROCK途径上调中发挥潜在性的作用,ROCK抑制剂法舒地尔可减轻内皮损伤,并促进肺血管重建,阻止慢性低氧介导的肺动脉高压[10]。活性氧自由基可能参与了包括RhoA/Rho激酶途径在内的多种细胞内信号途径的激活,但是确切的机制还需要进一步调查[9]。
IMT是动脉粥样硬化的一种替代测量方法,与心血管危险因素及转归有关。研究发现OSA患者的颈动脉IMT高于正常对照组[11],这可能与IH促进白细胞滚动、炎性细胞增殖、NF-κB激活、细胞间黏附因子-1及不同趋化因子表达增加有关。COPD患者的颈动脉IMT也高于正常对照组,气道炎症可诱发系统炎症,尤其是CRP产物与动脉粥样硬化进展有关[12]。本研究发现OS组C-IMT%水平最高,提示与仅仅患一种疾病相比,两者并发时预后更差。
EPC是循环细胞的储备池,可以归巢至损伤部位并修复内皮完整性及正常功能[6],评估其炎症损伤后的修复能力。循环EPC为抵抗内皮细胞损伤、替换功能障碍的内皮细胞和增强缺血血管损伤后的组织修复提供了一个内源性的修复机制。在本研究中OS、IH和肺气肿大鼠EPC水平均减少,且OS大鼠水平最低,提示IH合并肺气肿加重了内皮修复能力的损害,两者协同作用可增加心血管疾病的发生风险。组织缺血和低氧反应可以内源性地调度EPC,主要通过血管内皮生长因子和低氧诱导因子1α来介导,而这些因子通过IH也可以被激活[13]。IH可以通过动员EPC进入血液循环和损伤心肌组织发挥心肌保护作用并帮助冠脉血管的形成[14]。了解OSA和COPD重叠患者EPC的生物学特点,将有助于了解血管方面的发病机制并采取治疗干预措施[15]。总之,无论这两种疾病病因是否相关,OS患者夜间低氧血症、高碳酸血症和肺动脉高压都比OSA患者更重,这可能产生重要的临床后果。例如,最近报道OS患者与仅患OSA和COPD的患者相比有更高的病死率[16]。这些临床发现也许就是本基础研究的意义所在。
[1]Ganga HV,Nair SU,Puppala VK,et al.Risk of new-onset atrial fi⁃brillation in elderly patients with the overlap syndrome:a retrospec⁃tive cohort study[J].J Geriatr Cardiol,2013,10(2):129-134.
[2]McNicholas WT.Chronic obstructive pulmonary disease and ob⁃structive sleep apnea:overlaps in pathophysiology,systemic inflam⁃mation,and cardiovascular disease[J].Am J Respir Crit Care Med, 2009,180(8):692-700.
[3]Ioachimescu OC,Teodorescu M.Integrating the overlap of obstruc⁃tive lung disease and obstructive sleep apnoea:OLDOSA syndrome [J].Respirology,2013,18(3):421-431.
[4]Feng J,Chiang AA,Wu Q,et al.Sleep-related hypoxemia aggra⁃vates systematic inflammation in emphysematous rats[J].Chin Med J(Engl),2010,123(17):2392-2399.
[5]刘亚萌,高梦丽,曹洁,等.肺气肿合并间歇低氧大鼠模型肝脏的氧化应激及炎症损伤[J].天津医药,2014,42(2):147-150.
[6]王彦,王清,冯靖,等.阻塞性睡眠呼吸暂停与内皮祖细胞[J].天津医药,2013,41(12):1228-1232.
[7]Casey KR,Cantillo KO,Brown LK.Sleep-related hypoventilation/ hypoxemic syndromes[J].Chest,2007,131(6):1936-1948.
[8]Yang D,Liu Z,Luo Q.Plasma ghrelin and pro-inflammatory mark⁃ers in patients with obstructive sleep apnea and stable coronary heart disease[J].Med Sci Monit,2013,19:251-256.
[9]Bei Y,Duong-Quy S,Hua-Huy T,et al.Activation of RhoA/Rhokinase pathway accounts for pulmonary endothelial dysfunction in patients with chronic obstructive pulmonary disease[J].Physiol Rep,2013,1(5):e00105.
[10]Mouchaers KT,Schalij I,de Boer MA,et al.Fasudil reduces mono⁃crotaline-induced pulmonary arterial hypertension:comparison with bosentan and sildenafil[J].Eur Respir J,2010,36(4):800-807. [11]Nadeem R,Harvey M,Singh M,et al.Patients with Obstructive Sleep Apnea Display Increased Carotid Intima Media:A Meta-Analysis[J].Int J Vasc Med,2013,2013:839582.
[12]Ozgen Alpaydin A,Konyar Arslan I,Serter S,et al.Metabolic syn⁃drome and carotid intima-media thickness in chronic obstructive pulmonary disease[J].Multidiscip Respir Med,2013,8(1):61.
[13]Berger S,Aronson D,Lavie P,et al.Endothelial Progenitor Cells in Acute Myocardial Infarction and Sleep-disordered Breathing[J]. Am J Respir Crit Care Med,2013,187(1):90-98.
[14]Berger S,Lavie L.Endothelial progenitor cells in cardiovascular dis⁃ease and hypoxia-potential implications to obstructive sleep apnea [J].Transl Res,2011,158(1):1-13.
[15]Lui MM,Tse HF,Mak JC,et al.Altered profile of circulating endo⁃thelial progenitor cells in obstructive sleep apnea[J].Sleep Breath, 2013,17(3):937-942.
[16]Sharma B,Feinsilver S,Owens RL,et al.Obstructive airway disease and obstructive sleep apnea:effect of pulmonary function[J].Lung, 2011,189(1):37-41.
