肝癌微环境中影响转移相关通路的基因富集分析
2014-02-27高丹涂振霄张贯启吴俣倪亚安张志伟
高丹 涂振霄 张贯启 吴俣 倪亚安 张志伟
肝细胞癌是我国常见的恶性肿瘤之一,起病隐匿,生存期短,其中大部分肝癌患者发现时已属于不可切除,常有远处器官转移,尤其是对于合并门静脉癌栓(portal vein tumor thrombus,PVTT)患者,治疗更为棘手,预后极差,对于PVTT的机制研究和治疗已成为肝癌治疗的重点之一[1]。目前已经有肝癌合并PVTT形成的相关分子机制研究,但对于基因簇和信号通路中所涉及的众多基因和蛋白质的研究仍然不多。随着基因组芯片技术的产生和互联网大数据时代的到来,世界各地的实验室积累了海量的基因表达谱数据,这些数据在基因水平上极大地丰富了我们对肝癌发生和转移基因水平上的了解。对于大量的基因芯片的RNA数据进行生物学信息数据挖掘是基因芯片研究的一个重要方向。而基因组富集(GSEA)分析的方法能在各种病例对照类型数据中,在基因RNA分子系统水平上来挖掘影响疾病的综合基因通路,本研究中我们对综合性的基因表达与杂交排序数据库(GEO数据库)中的基因组芯片数据进行初步分析,找出在肝癌癌旁微环境中影响PVTT形成有作用的基因[2]。
材料与方法
一、研究材料
GEO肝癌合并PVTT有关的基因组表达芯片数据来自http://www.ncbi.nlm.nih.gov/gds/,GSEA软件,相应的基因表达谱数据编码为GSE5093。
二、数据处理
芯片数据预处理对来源于GSE5093中的芯片样本数据进行初步筛查,该数据为发生肝癌合并PVTT的癌旁组织9例,未发生PVTT的癌旁组织11例,另有8例正常肝组织作为阴性对照。参照之前基因集富集分析的文献方法,首先对基因表达谱数据文件(gct格式) 、表型数据文件(cls格式)和微阵列芯片注释的格式(chip格式)进行适当编辑整理,使之符合GSEA软件运行要求(参考http://www.broadinstitute.org/cancer/software/gsea/wiki/index.php/Data_formats),使用GSEA(2.0.13版)导入上述3个数据文件,检测无误后运行,通过t检验对每一个通路中的基因进行检验,通过1 000次循环的排列组合产生每个显著通路的P值,找到的差异性基因簇根据富集分数(enrichment score,ES)选取核心富集基因进行分析。
结 果
在癌旁组织中找到15个mRNA表达有差异性的信号通路,这些激活的通路对于肝癌发生PVTT转移可能起重要作用。GSEA信号通路富集分析结果见图1和表1。主要有KEGG_ANTIGEN_PROCESSING_AND_PRESENTATION、INFLAMMATORY_RESPONSE_LPS_UP 、HBV_INFECTION、IMMUNE_RESPONSE、INTERFERON_SIGNATURE_IN_CANCER和INTERFERON_GAMMA_SIGNALING,涉及细胞炎症因子、淋巴细胞功能、细胞凋亡、细胞因子合成和分泌、抗原处理和提呈信号、细胞黏附、免疫系统和移植免疫等信号通路。
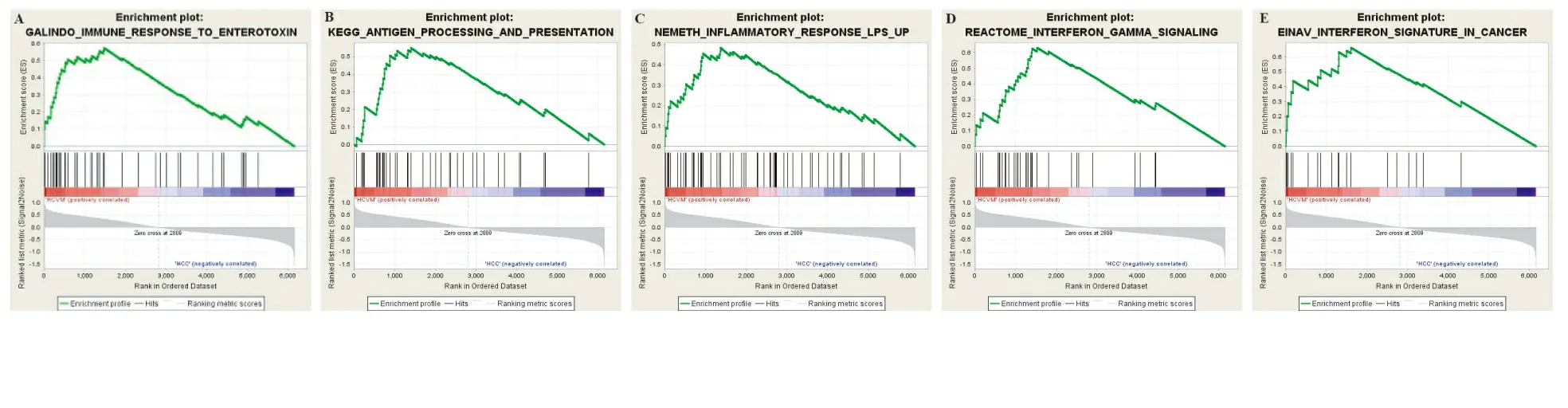
图1 肝癌转移富集基因的部分结果 A.免疫反应信号通路富集分析;B.抗原处理和提呈信号通路富集分析;C.炎症反应信号通路富集分析;D.干扰素γ信号通路富集分析;E.癌症中干扰素信号通路富集分析
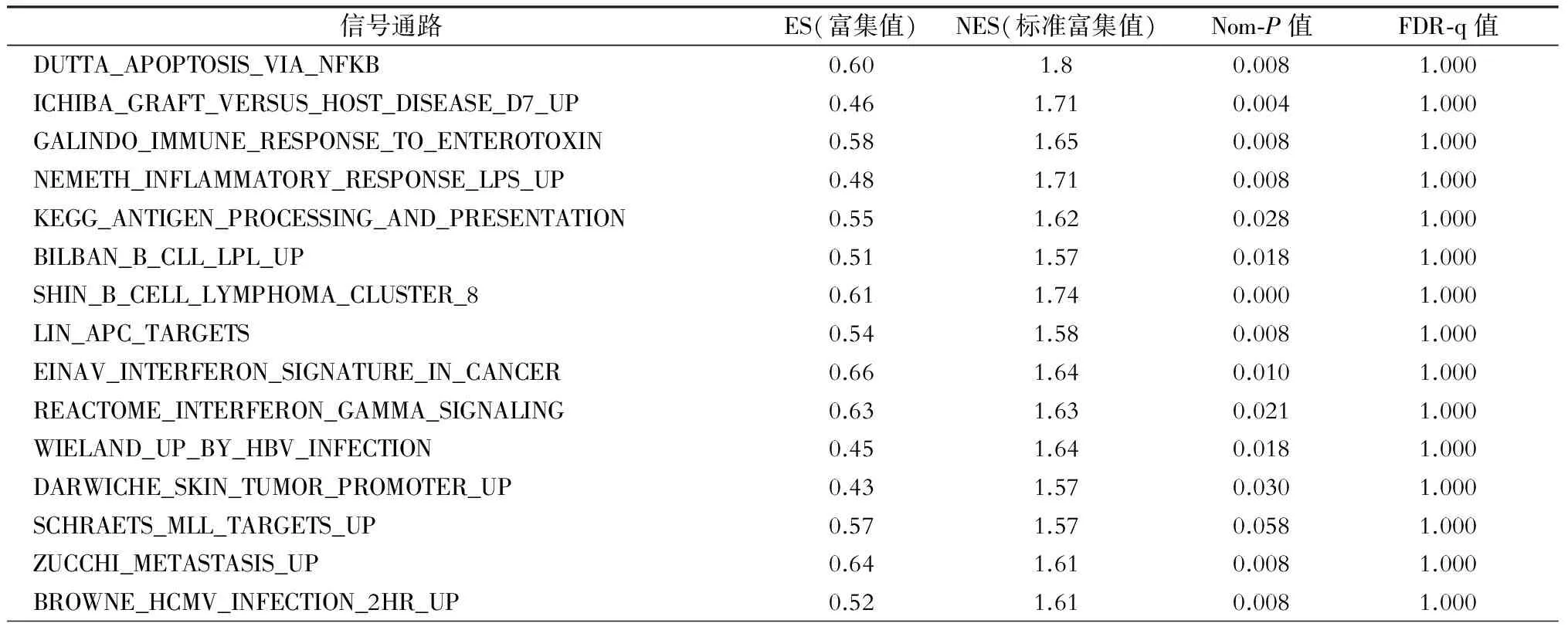
表1 肝癌门静脉转移相关基因通路的富集分析
讨 论
肝癌发生远处转移,不仅与肝癌细胞本身恶性程度有关,还与有无包膜、肿瘤直径和患者年龄等因素有关,但肝癌的周围环境是否对肝癌的转移存在重要影响目前还不明确。本研究通过软件分析,鉴定出与肝细胞癌发生门静脉转移有关的富集基因通路15条,这些通路主要包括细胞免疫、移植免疫相关、炎症因子、干扰素和肝炎病毒感染等。其中富集最明显的信号通路有INFLAMMATORY_ RESPONSE_LPS_UP、IMMUNE_RESPONSE_ TO_ ENTEROTOXIN、INTERFERON_ SIGNATURE_IN_ CANCER、INTERFERON_GAMMA_SIGNALING和KEGG_ANTIGEN_PROCESSING_AND_PRESENTATION、WIELAND_UP_BY_HBV_INFECTION这6条通路。
综合来说,在这些被发现的信号通路中,免疫反应和炎症作用是主要的两个因素。在INFLAMMATORY_RESPONSE_LPS_UP通路中有由细菌脂多糖引起的抗炎反应通路被明显激活,而抗炎反应在肝癌的癌旁组织中对于肿瘤的侵袭转移有重要作用[3]。本研究表明,癌旁的抗炎反应对于肝细胞癌的静脉转移起到重要作用,巨噬细胞作为抗炎反应细胞和抗原提呈细胞,受到肿瘤微环境的改变,可以通过分泌的细胞因子调控各种免疫细胞的功能,从而可能促进了肝癌细胞的转移[4]。KEGG_ANTIGEN_PROCESSING_AND_PRESENTATION在癌栓组的表达高于无癌栓组,在此通路中,较为重要的基因有legumain、HSP90AB1和HLA-DRA。Legumain蛋白也叫天冬酰胺内肽酶(Asparaginyl endopeptidase,AEP),是半胱氨酸蛋白酶C13家族一个新成员,其结构保守,主要在肿瘤新生血管的内皮细胞和肿瘤基质内的肿瘤相关巨噬细胞中高表达,而在正常组织中没有或低水平的表达,它作为卵巢癌预后的一项标志物[5]和结肠癌发生的重要基因[6],在本研究中的癌旁组织中也呈现差异性表达,提示其在肝癌发生和转移中也可能起到重要作用。HLA-DRA是抗原提呈细胞的标志物,此基因在癌栓组中表达升高,进一步说明了抗炎反应和免疫抑制的转换对肝癌的癌栓形成有促进作用[7],巨噬细胞可以针对微环境中的变化做出功能完全不同的改变,再通过分泌细胞因子和细胞趋化因子来调节包括T淋巴细胞在内的其他免疫细胞[8-10]。肿瘤相关性巨噬细胞本身可以发生分化,转变为以组织塑形和修复为主的类型,本研究认为这个过程与肝癌转移有关[11]。另外,在此通路中,HSP90AB1基因也呈高表达,根据文献报道,其在肺癌的转移中起重要作用,我们认为该基因有可能在肝癌的转移中也起到一定的作用[12]。
WIELAND_UP_BY_HBV_INFECTION这条通路在癌旁的表达也有差异性,这涉及到细胞免疫和免疫分子调节反应,属于免疫功能范畴,我们认为患者体内病毒感染以及HBV引起的强烈免疫作用与肝细胞癌发生门静脉转移有关[13-15]。因为INTERFERON_SIGNATURE_IN_CANCER信号通路在PVTT组中表达明显上调,其中的IFIT3(interferon-induced protein with tetratricopeptide repeats 3)、IFI30(interferon γ-inducible protein 30)、STAT1、IFI44、IFIT1、IFI6等基因均显著表达,这个通路早先被发现于肿瘤患者的免疫炎症反应通路中,同时也存在于病毒感染之后的机体免疫反应,由于肝癌的发生与病毒的感染有很大关系[16-17],我们认为病毒的感染和机体免疫机制的抑制可能促进肝癌的转移。在另一通路中INTERFERON_ GAMMA_SIGNALING的表达上调也提示干扰素γ可能与肝癌的转移有关。因为干扰素是由病毒感染后的炎症细胞产生的,干扰素基因的诱导可以反映出肿瘤炎症的程度,比如肿瘤浸润淋巴细胞在乳腺癌和卵巢癌中可以经常见到,因此干扰素诱导基因(interferon-induced genes,IIGs)在一些肿瘤中可以反映肿瘤细胞对于宿主免疫细胞产生的干扰素的反应状态。
本研究中,我们找出了发生和未发生癌栓的肝癌癌旁组织表达有差异的15条基因簇或者信号通路,通过进一步的文献资料统计分析和研究,我们发现肝细胞癌的侵袭和门静脉转移与癌旁微环境中的免疫功能和炎症反应有密切联系,同时这些改变与肝癌患者本身的基因表达特征有关。在今后的肝癌治疗中,我们可以利用已发现的差异性基因对患者进行筛查分类,然后针对有静脉癌栓转移易感基因的患者采取促炎性细胞因子治疗以及相应的免疫治疗。
1 Chen XP,Qiu FZ,Wu ZD,et al.Effects of location and extension of portal vein tumor thrombus on long-term outcomes of surgical treatment for hepatocellular carcinoma.Ann Surg Oncol,2006, 13:940-946.
2 Irizarry RA,Wang C,Zhou Y,et al.Gene set enrichment analysis made simple. Stat Methods Med Res,2009,18:565-575.
3 Budhu A,Forgues M,Ye QH,et al.Prediction of venous metastases, recurrence, and prognosis in hepatocellular carcinoma based on a unique immune response signature of the liver microenvironment. Cancer Cell, 2006,10:99-111.
4 Lee HS,Chung HJ,Lee HW,Jeong LS,et al.Suppression of inflammation response by a novel A(3) adenosine receptor agonist thio-Cl-IB-MECA through inhibition of Akt and NF-kappaB signaling.Immunobiology,2011,216:997-1003.
5 Wang L,Chen S,Zhang M,et al.Legumain: a biomarker for diagnosis and prognosis of human ovarian cancer.J Cell Biochem,2012,113:2679-2686.
6 Haugen MH,Johansen HT,Pettersen SJ,et al.Nuclear legumain activity in colorectal cancer. PLoS One,2013,8:e52980.
7 Pan YF,Tan YX,Wang M,et al.Signal regulatory protein alpha is associated with tumor-polarized macrophages phenotype switch and plays a pivotal role in tumor progression.Hepatology,2013,58: 680-691.
8 Waidmann O,Koberle V,Bettinger D,et al.Diagnostic and prognostic significance of cell death and macrophage activation markers in patients with hepatocellular carcinoma.J Hepatol,2013,59:769-779.
9 Capece D,Fischietti M,Verzella D,et al.The inflammatory microenvironment in hepatocellular carcinoma:a pivotal role for tumor-associated macrophages.Biomed Res Int,2013,2013:187204.
10Zhuang PY,Shen J,Zhu XD,et al.Direct transformation of lung microenvironment by interferon-alpha treatment counteracts growth of lung metastasis of hepatocellular carcinoma.PLoS One,2013,8: e58913.
11Siveen KS,Kuttan G.Role of macrophages in tumour progression. Immunol Lett,2009,123:97-102.
12Biaoxue R,Xiling J,Shuanying Y,et al.Upregulation of Hsp90-beta and annexin A1 correlates with poor survival and lymphatic metastasis in lung cancer patients.J Exp Clin Cancer Res,2012, 31:70.
13Yang P,Li QJ,Feng Y,et al.TGF-beta-miR-34a-CCL22 signaling- induced Treg cell recruitment promotes venous metastases of HBV-positive hepatocellular carcinoma.Cancer Cell,2012,22:291-303.
14Han YF,Zhao J,Ma LY,et al.Factors predicting occurrence and prognosis of hepatitis-B-virus-related hepatocellular carcinoma. World J Gastroenterol,2011,17:4258-4270.
15Zhang HH,Mei MH,Fei R,et al.Regulatory T cells in chronic hepatitis B patients affect the immunopathogenesis of hepatocellular carcinoma by suppressing the anti-tumour immune responses.J Viral Hepat,2010,17 Suppl 1:34-43.
16Einav U,Tabach Y,Getz G,et al.Gene expression analysis reveals a strong signature of an interferon-induced pathway in childhood lymphoblastic leukemia as well as in breast and ovarian cancer. Oncogene, 2005,24:6367-6375.
17Saxena R,Chawla YK,Verma I,et al.IFN-gamma (+874) and not TNF-alpha (-308) is associated with HBV-HCC risk in India.Mol Cell Biochem,2014,385:297-307.
