快速康复在腹腔镜胃癌根治围手术期的临床应用
2014-02-27钱昌林刘骅张捷沈志勇季福
钱昌林 刘骅 张捷 沈志勇 季福
快速康复外科(fast track surgery,FTS)最早见于Kehlet等在1999年美国外科年会上的报告,此后欧美国家开展了大量FTS在外科领域的研究,目前几乎应用到所有外科手术中[1]。FTS是将围手术期有循证医学证据的措施整合在一起,将麻醉、护理和外科等学科的最新研究证据结合的概念[2]。本文将FTS应用于腹腔镜胃癌根治围手术期处理,观察病人术后临床指标及炎性因子指标的差异,验证其有效性及安全性。
资料与方法
一、临床资料
收集2012年12月至2013年6月我科80例择期腹腔镜胃癌根治术病人,采用随机数字表的方法随机分组,分为快速康复组和传统治疗组。快速康复组男性22例,女性18例;年龄45~79岁,中位年龄62岁。传统治疗组男性19例,女性21例;年龄35~81岁,中位年龄58岁。所有病例均经胃镜活检病理检查证实,无明显手术禁忌证,由同一主刀医师完成腹腔镜胃癌D2根治手术,排除腹腔镜中转、肿瘤转移、资料不全病人。该研究经仁济医院伦理委员会批准,所有病人均签署知情同意书,两组病人的一般资料差异无统计学意义(P>0.05)。两组病人术前营养状况、pTNM分期及手术方式见表1,差异也无统计学意义(P>0.05)。

表1 两组病人营养状况、pTNM分期及手术方式
二、围手术期处理
1.FTS组 术前不常规行肠道准备,加强术前宣教,减少病人对手术恐惧感;术前12 h口服肠内营养制剂500 ml,术前2 h经周围静脉给予10%葡萄糖500 ml加生理盐水500 ml;控制术中液体输注量<2 000 ml;不常规留置胃管;术中注意保温;术后控制静脉液体输入量,补液量<40 ml·kg-1·d-1;术后1 d拔出尿管;术后1 d即协助病人下床活动;术后早期进食水,逐渐改流质;术后镇痛常规使用非甾体类镇痛药。
2.传统处理组 传统治疗组按传统围手术期方法处理,包括术前常规行机械及抗生素肠道准备,术后通气后停止胃肠减压,传统方法进行术中、术后补液量计算等。
3.观察指标 术后疼痛程度、术后排气时间、术后住院天数、术后并发症、住院费用及炎性因子[包括白细胞介素(IL)6、IL-8、C反应蛋白(CRP)、肿瘤坏死因子(TNF-α)]。术后疼痛采用视觉模拟评分(VAS)(0为无痛,10分为剧痛,<3分为优,3~4分为良,≥5分为差)。术后并发症指标包括胃潴留、尿潴留、恶心呕吐。两组病人分别手术结束、术后12 h、术后24 h抽取静脉血监测炎性因子指标(IL-6、IL-8、CRP、TNF-α)。
三、统计学方法
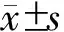
结 果
一、临床指标
FTS组病人术后疼痛评分下降、排气时间明显缩短(P<0.01),FTS组术后住院时间、住院总费用较对照组均降低(P<0.05)。两组术后并发症发生率差异无统计学意义(P>0.05),见表2。
二、实验室指标
FTS组术后炎性因子反应指标较对照组上升幅度降低,其中IL-6、IL-8、TNF-α两组比较P<0.05,CRP两组比较P<0.01,见表3。

表2 两组病人术后临床指标比较

表3 两组病人术后实验室指标比较±s)
注:同一时间点与对照组比较aP<0.05,bP<0.01
讨 论
FTS是指在术前、术中、术后应用各种已证实的有效方法减少手术应激及并发症,加快病人术后恢复,包括多种组合的协同结果。自2001年丹麦外科医生Wilmore等[1-2]率先提出此概念,并积极探索其可行性及优越性,已取得很大的成功。目前在欧美国家广泛实施并极力推广。首先包括手术方式的微创,目前主要由腹腔镜手术体现其微创理念,其次包括围手术期营养支持、胃管的不常规留置、早期进食等措施,另外术后镇痛也是重要的一环。通过一系列的围手术期优化措施[3],减轻或阻断机体的应激反应,目的是加速病人术后康复,缩短住院时间,降低医疗费用。
腹腔镜手术切口小、痛苦小、恢复快、术后瘢痕小、符合美学要求,是外科发展的总趋势和追求目标[4]。随着腹腔镜技术的日益完善和腹腔镜医生操作水平的提高,大部分普通外科手术腹腔镜下均能完成。Tanimura等[5]在对胃癌实施手助腹腔镜根治术后体会到,手助腹腔镜手术更有利于胃癌区域淋巴结的清扫,对进展期胃癌开展腹腔镜下胃手术,不仅淋巴结清扫数目和短期生存率与传统手术有显著差别,而且手术时间、住院时间、术中出血均优于开腹手术组。Li等[6]对239例进展期胃癌病人随机分组,结果提示腹腔镜胃癌D2根治术在安全性及可行性方面更有优势,且术后恢复快、并发症少。目前对腹腔镜胃癌根治术的临床研究多属小样本、非随机、短期的研究,我们期待着前瞻性、多中心、随机化的腹腔镜下胃癌手术的临床试验结果。既往大量研究已经证实利用FTS理念分别应用于腹腔镜胃癌手术与传统开腹手术,腹腔镜手术组住院时间缩短、肠道功能恢复快、创伤轻,较传统开腹组有明显优势(P<0.05)[7-8]。腹腔镜技术应用于消化道肿瘤手术减少了病人术中创伤应激,符合FTS减轻病人围手术期应激的核心理念[9]。
FTS目的是采用一系列优化措施减少应激反应,促进病人快速康复。本研究对我院腹腔镜胃癌术后两组病人进行比较,快速康复组病人术后疼痛评分下降、排气时间较对照组明显缩短(P<0.01),术后住院时间、住院总费用较对照组均降低(P<0.05),但术后并发症发生率差异无统计学意义(P>0.05)。FTS与传统理念不同,强调术前充分宣教,让病人了解每个过程,以减轻紧张和恐惧感。术前12 h口服肠内营养制剂,术前2 h经周围静脉给予葡萄糖及生理盐水可减轻术前饥饿,减轻术中及术后应激及胰岛素抵抗[10]。机械肠道准备不但给病人带来身体不适,而且可能导致肠道细菌易位、电解质和酸碱平衡紊乱,可能会增加术后腹腔感染和吻合口瘘的发生率[11-12]。传统手术常规留置胃管目的是为了观察引流液、减轻胃肠道压力及减少吻合口瘘的发生,但研究表明各类导管并不能防止吻合口瘘,反而会增加并发症发生率并影响术后早期活动[13]。术后控制液体摄入量可减少术后并发症且缩短术后住院时间[14-15]。术后早期活动可增加肌肉强度、加快肺功能恢复、减少静脉血栓形成。术后早期恢复饮食并不增加吻合口瘘的发生率,反而可改善病人氮平衡、促进肠蠕动、保护肠黏膜屏障、缩短住院时间。本文术后镇痛常规使用非甾体类镇痛药镇痛,而不是术后疼痛无法耐受时临时给予阿片类止痛剂。通过上述一系列优化措施并应用于腹腔镜胃癌手术围手术期处理,结果显示确可为病人带来益处。
应激影响了中枢神经系统的许多功能,如呼吸、新陈代谢、心血管状况等,同时会改变正常的胃肠道活动性并且降低免疫/炎症反应。而影响手术病人快速康复的应激反应因素是多方面的。FTS的核心是减少或切断应激反应,我们采用炎性因子指标作为应激反应的衡量标准。本文通过静脉血检测IL-6、IL-8、CRP、TNF-α的改变,两组病人分别抽取手术结束、术后12 h、术后24 h静脉血,结果提示FTS组较传统对照组炎性因子指标上升速度明显减慢,IL-6、IL-8、TNF-α(P<0.05),CRP上升速度显著减慢(P<0.01),表明采用FTS理念对围手术期的综合处理是切实有效的。
疼痛是手术后最大的应激因素,术后镇痛的优化在快速康复外科中是重要的一环,充分镇痛十分必要[16]。传统术后病人疼痛多临时给予阿片类镇痛剂,而阿片类镇痛剂易引起胃肠功能紊乱,致恶心、呕吐等并发症的增加。本文FTS组术后常规连续3 d静注非甾体类镇痛药,具有作用持久、效果显著,对胃肠道及血小板影响较小等优点。
综上所述,FTS应用于腹腔镜胃癌根治术切实可行。病人术后疼痛减轻、炎症应激反应减少、胃肠道功能恢复加快、住院时间缩短、住院总费用降低、术后康复加速,值得临床推广应用。我们在探索更合理的程序中,需要多学科的相互协作。在考虑流程可行性的同时需兼顾手术安全性,不可本末倒置,而致病人再入院率增高、远期生存率降低。
1 Wilmore DW,Kehlet H.Management of patients in fast track surgery.BMJ,2001,322:473-476.
2 Kehlet H.Future perspectives and research initiatives in fast-track surgery.Langenbecks Arch Surg,2006,391:495-498.
3 郜永顺,张云飞,段小伟,等.胃癌围手术期快速康复应用研究.腹部外科,2012,3:152-155.
4 Matsuhashi N,Osada S,Yamaguchi K,et al.Long-term outcomes of treatment of gastric gastrointestinal stromal tumor by laparoscopic surgery.Hepatogastroenterology,2013,60:2011-2015.
5 Tanimura S,Higashino M,Fukunaga Y,et al.Laparoscopic distal gastrectomy with regional lymph node dissection for gastric cancer.Surgl Endosc,2005,19:1177-1181.
6 Li ZX,Xu YC,Lin WL,et al.Therapeutic effect of laparoscopy-assisted D2 radical gastrectomy in 106 patients with advanced gastric cancer.J BUON,2013,18:689-694.
7 King PM,Blazeby JM,Ewings P,et al.Randomized clinical trial comparing laparoscopic and open surgery for colorectal cancer within an enhanced recovery programme.Br J Surg,2006,93:300-308.
8 Vlug MS,Wind J,van der Zaag E,et al.Systematic review of laparoscopic vs open colonic surgery within an enhanced recovery programme.Colorectal Dis,2009,11:335-343.
9 Nishiguchi K,Okuda J,Toyoda M,et al.Comparative evaluation of surgical stress of laparoscopic and open surgeries for colorectal carcinoma.Dis Colon Rectum,2001,44:223-230.
10Nygren J,Soop M,Thorell A,et al.Preoperative oral carbohydrates and postoperative insulin resistance.Clin Nutr,1999,18:117-120.
11Bucher P,Gervaz P,Soravia C,et al.Randomized clinical trial of mechanical bowel preparation versus no preparation before elective left-sided colorectal surgery.Br J Surg,2005,92:409-414.
12Wille-Jorgensen P,Guenaga KF,Matos D,et al.Pre-operative mechanical bowel cleansing or not? an updated meta-analysis.Colorectal Dis,2005,7:304-310.
13Nisanevich V,Felsenstein I,Almogy G,et al.Effect of intraoperative fluid management on outcome after intraabdominal surgery.Anesthesiology,2005,103:25-32.
14Brandstrup B.Fluid therapy for the surgical patient.Best Pract Res Clin Anaesthesiol,2006,20:265-283.
15Weinberg L,Wong D,Karalapillai D,et al.The impact of fluid intervention on complications and length of hospital stay after pancreaticoduodenectomy (Whipple's procedure).BMC Anesthesiol,2014,14:35.
16江志伟,黎介寿.快速康复外科——优化的临床路径.中华胃肠外科杂志,2012,15:12-13.
