胰腺癌组织SOX9的表达水平与肿瘤进展及预后的关系
2014-02-27孟凡斌郭克建
孟凡斌 郭克建
胰腺癌发病率呈逐年上升趋势,预后极差。其占美国恶性肿瘤死亡原因的第四位[1]。近年对其病因以及进展机制的研究虽然取得了一些进展,仍不足以提高其不佳的治疗效果[2-3]。SOX9 ,SRY (sex determining region Y)-box 9,是SOX基因家族中的一员,胚胎期,胃、肠、肝脏、胆管及胰腺等多种器官的定向分化过程中SOX9都是必不可少的参与因子,而在成体,SOX9阳性细胞可分化为肝、胆管、小肠、胰腺上皮细胞,并向上述器官提供细胞来源[4-7]。而多项研究表明,SOX9在多种肿瘤的发生、发展中起到了关键的作用[8-12]。本研究通过免疫组织化学染色结合临床病理及预后资料对比分析,结合细胞体外实验,探究胰腺癌中SOX9的表达水平及临床病理学意义。
材料与方法
一、材料
1.临床病理材料 2007年1月至2011年12月中国医科大学附属第一医院具有完整临床资料的胰腺癌手术切除标本62例,其中男性46例,女性16例;年龄35~75岁,中位年龄59岁,术后病理证实均为原发性胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)。62例中,胰腺头、颈部癌54例,体、尾部癌8例。所有病例均经随访,随访时间4~63个月。此外,因胰腺良性肿瘤或胰腺外伤而切除的正常胰腺组织标本5例,胰腺导管内乳头状黏液瘤(IPMN) 标本15例及胰腺癌组织中散在分布有胰腺上皮内瘤样病变(pancreatic intraepithelial neoplasia,PanIN)标本18例也包含在本研究中。上述正常胰腺、胰腺癌、IPMN及PanIN标本均施行SOX9免疫组织化学染色观察SOX9在组织中的表达情况。
本研究所涉及的人体标本、相关临床数据及相关实验已获得中国医科大学附属第一医院伦理委员会批准,并于取材前签署知情同意书。
2.细胞及培养条件 人胰腺癌细胞系CAPAN-2、BxPC3及PANC-1均购自 American Type Culture Collection (ATCC)。细胞培养于含有10%胎牛血清 (FBS)、100 U/ml青霉素、100 μg/ml链霉素的RPMI-1640培养基中,孵育于37 ℃、含有5% CO2的细胞培养箱中。
二、实验方法
1.免疫组织化学染色 采用免疫组织化学SP法,应用SP法免疫组织化学超敏试剂盒(兔,KIT-9706/9707/9708)。抗原修复采用pH 6.0的柠檬酸缓冲液121 ℃高压热修复3 min,动物非免疫血清(羊)室温封闭30 min后滴加一抗(SOX9多克隆抗体,Millipore,1∶1000;鼠抗Ki67,1∶50,Abcam;鼠抗p53 ,1∶200, Abcam; 鼠抗CEA,1∶400,Abcam;鼠抗CA19-9,1∶100,Abcam;鼠抗CD34,1∶100,Abcam)4 ℃孵育过夜。次日依次滴加二抗(生物素标记的抗兔或鼠IgG,1∶200,Vector Laboratories) 30 min及链霉菌抗生物素蛋白-过氧化物酶37 ℃ 15 min。免疫组织化学结果判定:参考Sung[13]文献评分方法:每张切片400倍显微镜下随机选取 5个视野:①阳性细胞数:计算5个视野的阳性细胞的平均百分数分为4级:阳性细胞数1~24% 为1分;25%~49%为2分;50%~74%为3分;大于75%为4分。②染色强度:无着色0分;浅黄色1分;黄或深黄色2分;褐或棕褐色3分,上述两项相乘为分级标准:≥4分定义为高表达,<4分定义为低表达。
2.细胞免疫荧光染色 细胞爬片至汇合度达到70%左右开始进行染色步骤。一抗为SOX9多克隆抗体(Millipore,1∶1 000),4 ℃孵育过夜后加入二抗(驴抗兔594红色荧光二抗,Life Technologies,A21207,1∶200),室温避光孵育1 h。加入0.5 μg/ml DAPI避光染色10 min后封片镜检、拍照。
3.QRT-PCR 采用RNA分离试剂盒Trizol 提取并纯化细胞株总RNA,所有RNA样本浓度均稀释至1 μg/μl,根据TaKaRa逆转录和扩增试剂盒说明书进行逆转录和扩增。荧光实时PCR 反应体系25 μl(TaKaRa 2×SYBRR Pre-ix ExTaqTM 12.5 μl,100 nmol/L上、下游引物各1 μl,Cdna 2 μl,H2O 8.5 μl),反应条件:95 ℃ 5 min变性;95 ℃ 5 s,60 ℃30 s,40个循环,所有反应均设立复孔,并以DEPC水代替模板cDNA作为阴性对照。引物均由Invitrogen公司设计、合成。SOX9上游引物:5′-GTACCCGCACTTGCACAAC-3′;下游引物:5′-TCGCTCTCGTTCAGAAGTCTC-3′;GAPDH 上游引物5′-TGCACCACCAACTGCTTAGC-3′;下游引物5′-GGCATGGACTGTGGTCATGAG-3′。QRT-PCR结果分析采用2-ΔΔCt法:即目标细胞株标本中SOX9的阈值循环数(CT)值与其相对应的GAPDH 的CT 值相减,得到校正CT 值。以BxPC-3细胞株为对照,其余两种细胞株与其进行比较,比较公式:2-ΔΔCt=2-[(ΔCt目标细胞株目的基因-ΔCt内参基因)-(ΔCt对照细胞株目的基因-ΔCt内参基因)]。
三、统计学处理
采用SPSS(19.0版)统计软件。SOX9蛋白表达水平与病人临床病理学参数的关系采用卡方检验。Kaplan-Meier法单因素分析计算累积生存率。P<0.05差异有统计学意义。
结 果
一、SOX9在正常胰腺组织、IPMN、PanIN及胰腺癌中的表达情况
为了探讨SOX9蛋白在正常胰腺及各种胰腺肿瘤性病变中的表达情况,我们以免疫组织化学染色方法分别对上述四种组织进行染色分析。结果表明,在上述四种组织中,SOX9均有阳性表达,且均表达在细胞核中。在正常胰腺组织,SOX9 100%(5/5)表达,主要表达于腺泡中心细胞及胰腺导管上皮细胞(图1A)。在IPMN及PanIN,SOX9呈100%(IPMN:15/15;PanIN:18/18)的阳性表达,阳性细胞为肿瘤上皮细胞(图1B, C)。而在胰腺癌,83.87%(52/62)在肿瘤上皮细胞呈阳性表达(图1D),其中高表达62.90%(39/62)(图2A),低/无表达37.10%(23/62) (图2B)。上述结果表明,无论是正常胰腺、癌前病变的IPMN及PanIN,还是恶性肿瘤PDAC,SOX9均呈阳性表达。
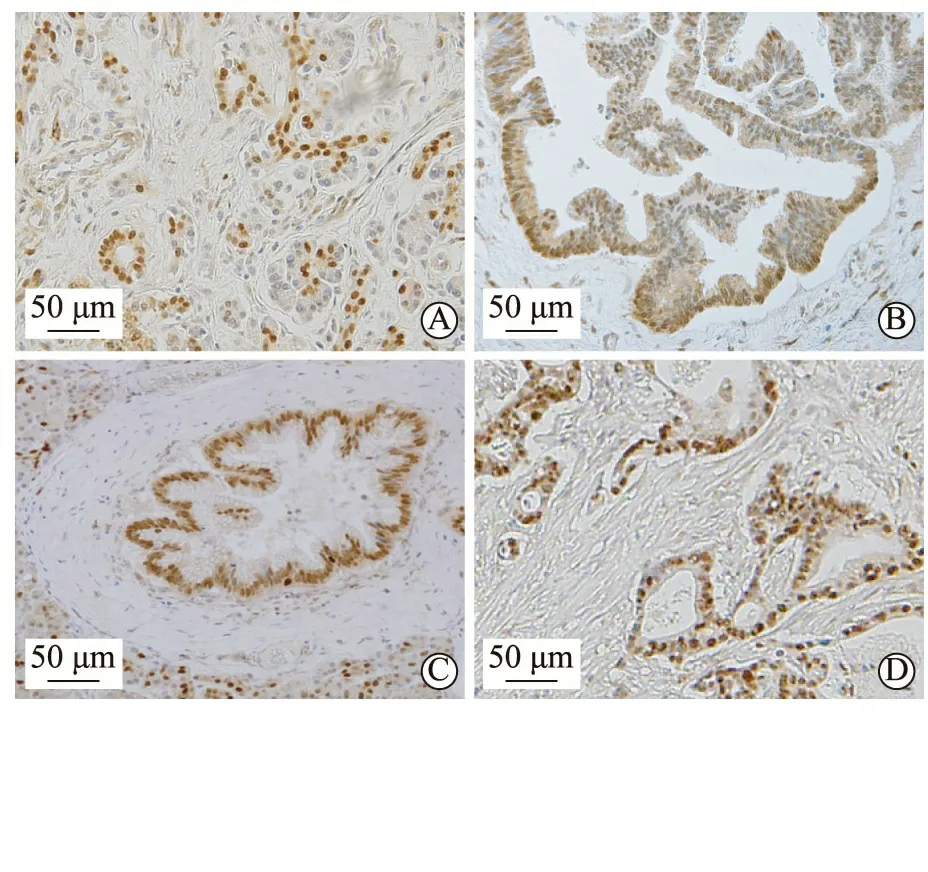
A.正常胰腺;B.IPMN;C.PanIN;D.PDAC图1 SOX9在正常胰腺组织、IPMN、PanIN及PDAC中的表达(免疫组织化学染色)
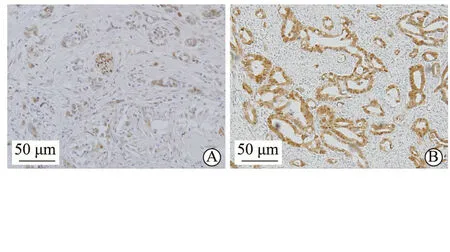
A.低表达;B.高表达图2 SOX9在PDAC中的高表达及低表达(免疫组织化学染色)
二、SOX9蛋白表达水平与PDAC病人临床病理学参数的关系
为了探讨SOX9的表达水平与胰腺癌生物学行为的关系,我们对62例胰腺癌组织进行免疫组织化学染色,将SOX9在胰腺癌组织中的表达水平与肿瘤的临床病理数据及预后资料做了统计分析,结果发现,SOX9蛋白表达水平与PDAC肿瘤浸润深度(χ2=4.449,P=0.034)、淋巴结转移(χ2=4.433,P=0.032)呈正相关,有统计学意义。而SOX9蛋白表达水平与年龄(P=0.196)、性别(P=0.196)、肿瘤大小(P=0.173)、肿瘤分化程度(P=0.522)、TNM分期(P=0.057)、术前血清CA19-9水平(P=0.082)、血管浸润(P=0.381)、神经浸润(P=0.449)、组织CA19-9表达(P=0.553)、组织Ki67表达(P=0.550)、组织CEA表达(P=0.101)、组织CD34血管表达(P=0.582)及组织P53表达(P=0.475)等均无明显相关性。(表1)
三、SOX9蛋白表达水平与胰腺癌病人术后生存的关系
我们用Kaplan-Meier法对62例病人进行单因素分析发现:SOX9蛋白高表达PDAC病人(术后中位生存时间为12个月)较低表达者(术后中位生存时间为26个月)预后差(χ2=6.446,P=0.011),两者差异具有统计学意义。(图3)
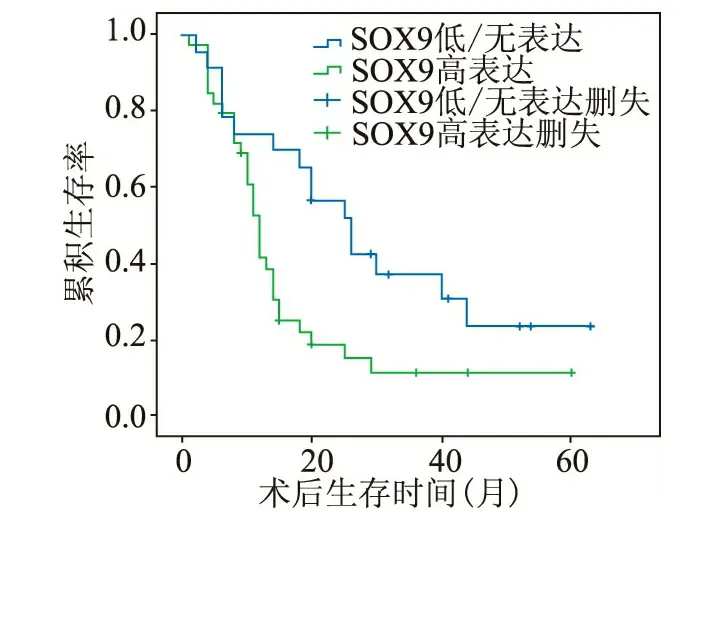
图3 Kaplan⁃Meier生存曲线:SOX9蛋白表达与62例PDAC病人预后的关系
四、各种胰腺癌细胞系SOX9表达情况
为了观察SOX9在不同分化程度及恶性程度胰腺癌细胞中的表达情况,我们选取了三种不同的胰腺癌细胞系:高分化的CAPAN-2、中分化的BxPC-3及低分化的PANC-1[14],分别作了免疫荧光染色分析其SOX9表达比例及qRT-PCR检测这几种细胞系SOX9 mRNA表达水平。我们的免疫荧光染色结果显示,这三种细胞系SOX9阳性细胞比率分别为:BxPC-3:62% ; CAPAN-2:68% ; PANC-1:92%(图4)。而qRT-PCR结果显示,在这三种细胞系中,低分化的PANC-1 SOX9 mRNA表达水平(23.68±3.06)明显高于中、高分化的BXPC-3(1.00±0.02)和CAPAN-2(1.09±0.18)。
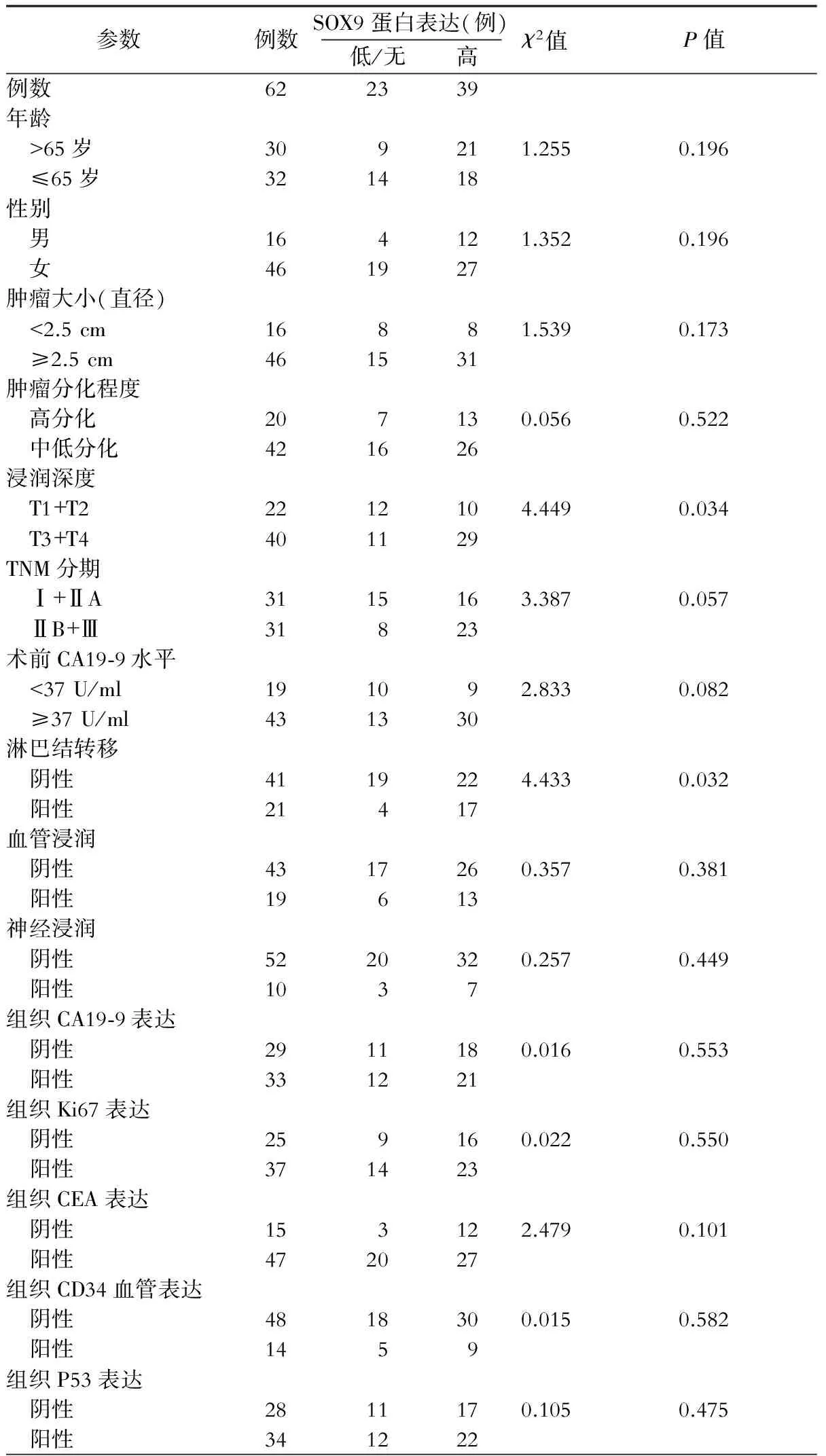
表1 SOX9蛋白表达与PDAC病人临床病理学参数的关系
讨 论
既往有研究表明,在肝、胆道及胰腺的胚胎发育过程中,SOX9阳性细胞位于这三种器官组织的生发中心,SOX9阳性始祖细胞不仅可分化为肝内外胆管上皮细胞、胰管上皮细胞,且可向上述组织提供充足的细胞来源[6]。这使得我们对SOX9在胰腺肿瘤的发生发展中是否也能起到类似作用产生了兴趣。我们在以往的工作中对IPMN组织标本做的免疫组织化学染色结果[15]显示,SOX9主要表达于呈乳头绒毛状增生的上皮结构的基底部,这一特点在胃型及肠型IPMN中尤其突出。由于胃型及肠型IPMN的组织构造分别与胃黏膜腺体及结肠腺瘤相似,而干细胞理论认为,消化管绒毛状上皮结构的始祖细胞-干细胞恰恰位于其绒毛状结构的基底部。SOX9主要表达于绒毛乳头状结构基底部这一特点在IPMN进展至恶性后,就逐渐消失了,SOX9阳性细胞像在胰腺癌组织中一样,杂乱无章地散布于癌组织中,无任何规律性。SOX9在IPMN中这种特殊的表达方式,干细胞标志物CD44同样具有,且免疫荧光染色提示SOX9与CD44可在同一细胞表达。上述研究结果提示我们,SOX9不仅在胰腺的发生及脏器正常功能的维持中发挥了至关重要的作用,同时在胰腺癌及其癌前病变的发生发展中也可能扮演了重要角色。我们的假设也在其他团队的研究中得到了证实,Kopp 等[16]的研究发现,SOX9在胰腺腺泡细胞向导管细胞再到癌前病变PanIN的发展过程中是必不可少的,即SOX9阳性细胞极有可能是PansIN甚至是癌的前体细胞。新近发表的文献证实,NF-κB介导的 SOX9的去甲基化导致胰腺癌干细胞侵袭能力的增加[17]。而另一项研究证明SOX9可介导缺氧依赖的相关基因表达并提高胰腺癌细胞的恶性度[18]。
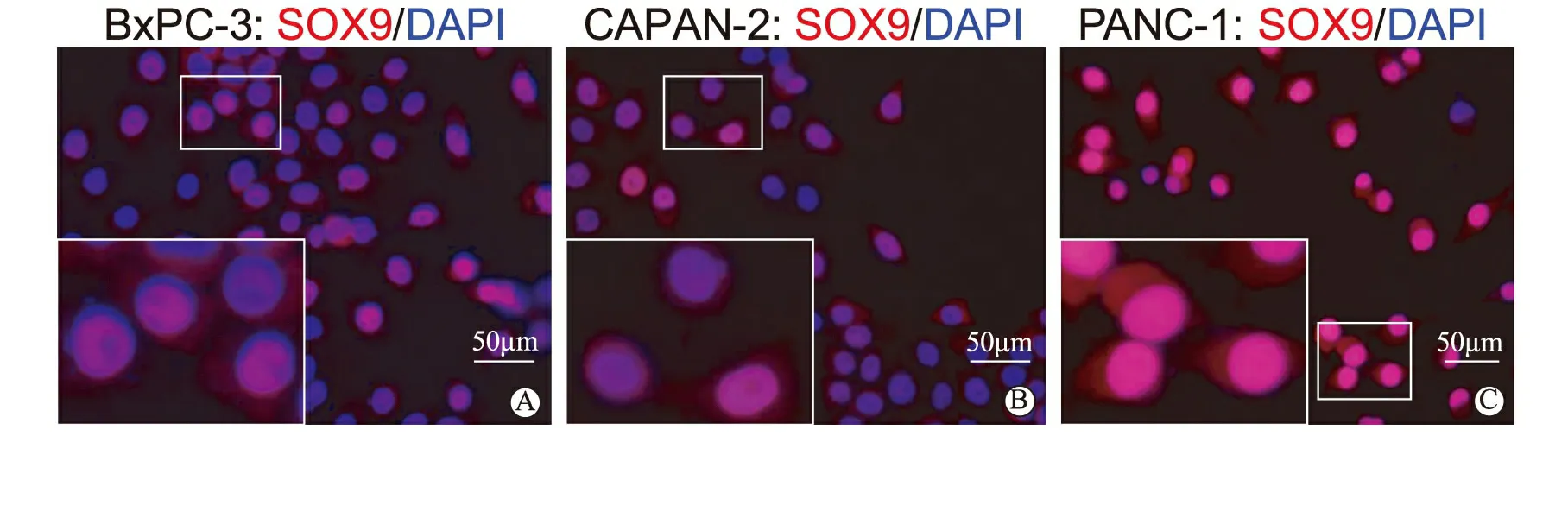
A:BxPC⁃3;B:CAPAN⁃2;C:PANC⁃1。图中红色荧光为SOX9,蓝色荧光为DAPI。各图中左下角图片为白色方框部分的放大像图4 各种胰腺癌细胞系SOX9免疫荧光染色图像
我们及其他团队的研究结果均高度提示SOX9在胰腺癌的发生、发展过程中是一个关键因子,SOX9表达水平的高低对肿瘤的生物学行为有重要的影响。当前,多种基因的表达水平已经被用于临床监测胰腺癌的发生、评估预后及监测复发,如CA19-9及CEA等[19-20]。因此我们希望SOX9能作为一个独立指标应用于临床,用来判断胰腺癌的存在及预测其生物学行为。我们将免疫组织化学染色得到的SOX9蛋白表达水平与胰腺癌临床病理资料进行的统计分析结果虽然提示SOX9高表达与肿瘤浸润深度、淋巴结转移及预后相关(图3),但在肿瘤大小、TNM分期等其他指标中差异未有统计学意义,这可能和我们的样本量小有关,这有待我们今后扩充样本量后做进一步的分析。但我们的结果至少说明,SOX9的表达水平可能对胰腺癌的进展及预后有提示作用。
胰腺癌对化疗药物的广泛耐药是对其进行复发的防治及复发后非手术治疗不理想的主要原因之一。作为目前唯一被FDA批准的应用于胰腺癌的化疗药,吉西他滨的问世为胰腺癌的治疗带来了福音。但是仍有大量的病人对吉西他滨耐药,使得胰腺癌的内科治疗效果极差,故找到控制胰腺癌对吉西他滨耐药的作用机制,找到控制其发生发展的关键靶点,对解决困扰胰腺癌治疗的耐药问题至关重要。我们对三种不同分化水平的胰腺癌细胞系的体外实验结果显示低分化的PANC-1细胞的SOX9阳性细胞比率及SOX9 mRNA表达水平均显著高于高、中分化的CAPAN-2及BxPC-3细胞。而有研究报道PANC-1细胞的吉西他滨耐药能力也高于另外两组细胞[21]。综合这些研究结果,我们对后续研究提出了如下假设:SOX9表达水平高的胰腺癌细胞,其恶性程度高,对吉西他滨的耐药能力也强,即SOX9很可能是控制胰腺癌细胞分化及吉西他滨耐药的关键因子。这一点有待我们今后更加深入、系统的研究来做进一步的验证。
1 Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009.CA Cancer J Clin,2009,59:225-249.
2 Moore MJ.The treatment of advanced pancreatic cancer:current evidence and future challenges.Ann Oncol,2008,19 Suppl 7:vii304-308.
3 Stathis A,Moore MJ.Advanced pancreatic carcinoma:current reatment and future challenges.Nat Rev Clin Oncol,2010,7:163-172.
4 Seymour PA,Freude KK,Tran MN,et al.SOX9 is required for maintenance of the pancreatic progenitor cell pool.Proc Natl Acad Sci USA,2007,104:1865-1870.
5 Blache P,van de Wetering M,Duluc I,et al.SOX9 is an intestine crypt transcription factor,is regulated by the Wnt pathway,and represses the CDX2 and MUC2 genes.J Cell Biol,2004,166:37-47.
6 Furuyama K,Kawaguchi Y,Akiyama H,et al.Continuous cell supply from a Sox9-expressing progenitor zone in adult liver,exocrine pancreas and intestine.Nat Genet,2011,43:34-41.
7 Moniot B,Biau S,Faure S,et al.SOX9 specifies the pyloric sphincter epithelium through mesenchymal-epithelial signals.Development,2004,131:3795Y3804.
8 Ling S,Chang X,Schultz L,et al.An EGFR-ERK-SOX9 signaling cascade links urothelial development and regeneration to cancer.Cancer Res,2011,71:3812-3821.
9 Jay P,Berta P,Blache P.Expression of the carcinoembryonic antigen gene is inhibited by SOX9 in human colon carcinoma cells.Cancer Res,2005,65:2193-2198.
10Sashikawa Kimura M,Mutoh H,Sugano K.SOX9 is expressed in normal stomach,intestinal metaplasia,and gastric carcinoma in humans.J Gastroenterol,2011,46:1292-1299.
11Mazur PK,Riener MO,Jochum W,et al.Expression and clinicopathological significance of notch signaling and cell-fate genes in biliary.Am J Gastroenterol,2012,107:126-135.
12Jiang SS,Fang WT,Hou YH,et al.Upregulation of SOX9 in lung adenocarcinoma and its involvement in the regulation of cell growth and tumorigenicity.Clin Cancer Res,2010,16:4363-4373.
13Sung CO,Han SY,Kim SH.Low expression of claudin-4 is associated with poor prognosis in esophageal squamous cell carcinoma.Ann Surg Oncol,2011,18:273-281.
14Sipos B,Möser S,Kalthoff H,et al.A comprehensive characterization of pancreatic ductal carcinoma cell lines:towards the establishment of an in vitro research platform.Virchows Arch,2003,442:444-452.
15Meng F,Takaori K,Ito T,et al.Expression of SOX9 in intraductal papillary mucinous neoplasms of the pancreas.Pancreas,2014,43:7-14.
16Kopp JL,von Figura G,Mayes E,et al.Identification of Sox9-dependent acinar-to-ductal reprogramming as the principal mechanism for initiation of pancreatic ductal adenocarcinoma.Cancer Cell,2012,22:737-750.
17Sun L,Mathews LA,Cabarcas SM,et al.Epigenetic regulation of SOX9 by the NF-κB signaling pathway in pancreatic cancer stem cells.Stem?Cells,2013,31:1454-1466.
18Camaj P,Jäckel C,Krebs S,et al.Hypoxia-independent gene expression mediated by SOX9 promotes aggressive pancreatic tumor biology.Mol Cancer Res,2014,12:421-432.
19Ni XG,Bai XF,Mao YL,et al.The clinical value of serum CEA,CA19-9,and CA242 in the diagnosis and prognosis of pancreatic cancer.Eur J Surg Oncol,2005,31:164-169.
20Yasue M,Sakamoto J,Teramukai S,et al.Prognostic values of preoperative and postoperative CEA and CA19.9 levels in pancreatic cancer.Pancreas,1994,9:735-740.
21Celli JP,Solban N,Liang A,et al.Verteporfin-based photodynamic therapy overcomes gemcitabine insensitivity in a panel of pancreatic cancer celllines.Lasers Surg Med,2011,43:565-574.
