不同晶型CL-20热分解反应机理计算分析*
2014-02-26伍俊英
张 力,陈 朗,王 晨,伍俊英
(北京理工大学爆炸科学与技术国家重点实验室,北京100081)
CL-20在不同温度下发生晶型转变[1],导致其反应特征发生变化,因此,需要研究CL-20在不同晶型下的反应机理。D.G.Patil等[2]通过热重法研究ε-CL-20的分解过程,采用红外光谱对热分解产物进行确定,得到分解温度低于1 000K 时热分解产物包括NO2、NO、HCN、CO、N2O 和CO2等。但由于受实验方法的限制,不能通过实验得到γ-和β-CL-20等的反应路径和热分解产物。S.Okovytyy等[3]通过密度泛函理论和过渡态搜索的方法计算了ε-CL-20的分解路径,得知单分子ε-CL-20的反应路径为NNO2均裂形成·NO2自由基、HONO 的减少、C-N 和N-N 键的断裂导致的开环过程和H 原子的转移过程。O.Isayev等[4]采用第一性原理分子动力学计算方法对单分子和超晶胞结构的ε-CL-20在高温下的分解过程进行模拟;张力等[5]采用Reaxff力场[6]分子动力学方法也对1 200~3 200K 时不同密度的ε-CL-20的分解过程进行计算;计算结果均表明ε-CL-20的反应路径为N-NO2键的断裂。本文中,采用Reaxff力场分子动力学方法,通过计算γ-、β-和ε-CL-20晶体的超晶胞结构在1 000~3 000K 时的热分解过程,对这3种超晶胞结构生成的热分解碎片进行分析,得到不同温度下3种晶型生成的产物和中间体随时间的变化过程,确定高温下不同晶型CL-20超晶胞结构的反应路径。
1 计算方法和模型
由于硝基相对于五元环和六元环的位置不同,CL-20分子有6种晶型[7-8],其中ε 相和γ 相结构属于P21/n 空间群,β 相结构属于Pb21/a 空间群,γ、β 和ε 相的单胞结构中均包括4个CL-20分子,即144个原子。图1为ε、β 和γ 相晶体中CL-20分子的空间结构。图1中灰色、蓝色、红色和白色原子分别为碳、氮、氧和氢原子。
对γ、β 和ε 相的CL-20单胞结构,分别搭建4×3×3、4×3×3和3×5×3的超晶胞结构,此时3种超晶胞结构分别包括144、144和180个CL-20分子。图2为ε-CL-20超晶胞结构的模型建立过程,图2(a)为ε-CL-20晶体的单胞结构,从图2(a)可以看出,CL-20晶体的单胞结构中包括4个CL-20分子,图2(b)为搭建的3×5×3结构中晶格结构,图2(c)为ε-CL-20超晶胞结构。图2中灰色、蓝色、红色和白色原子分别为碳、氮、氧和氢原子。采用相同的方法可以得到γ、β 相CL-20的超晶胞结构。
首先,对3种超晶胞中的原子位置进行优化,得到能量最小结构。然后,采用NPT-MD 方法对超晶胞的压力进行弛豫,得到压力为0Pa、温度为300K 的初始构型。经过步长为0.2s-1、10ps的NPTMD 的模拟,此时γ、β 和ε 相CL-20的密度分别为1.85、1.87和1.92g/cm3,与实验得到的1.926、1.985和2.03g/cm3的密度比较符合[7-8]。对平衡后的3种晶型CL-20在1 000、1 500、2 000、2 500、3 000K下采用NVT-MD 进行步长为0.1s-1、共50ps的计算。在上述计算中,采用Reaxff力场[6]、Verlet Velocity方法进行积分,采用Berendsen控温和控压法进行温度和压力的控制。
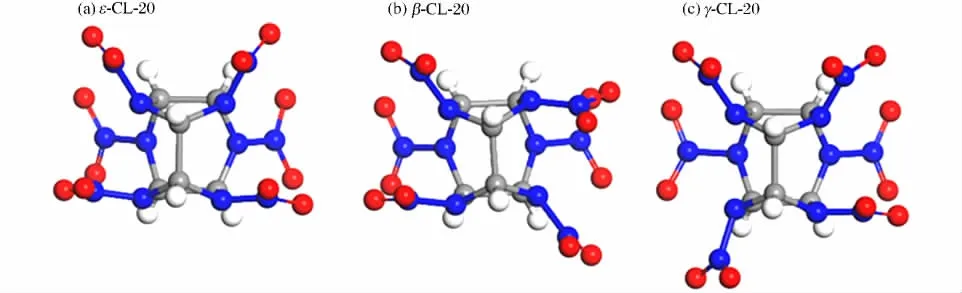
图1 3种CL-20晶型Fig.1 Three polymorphs of CL-20
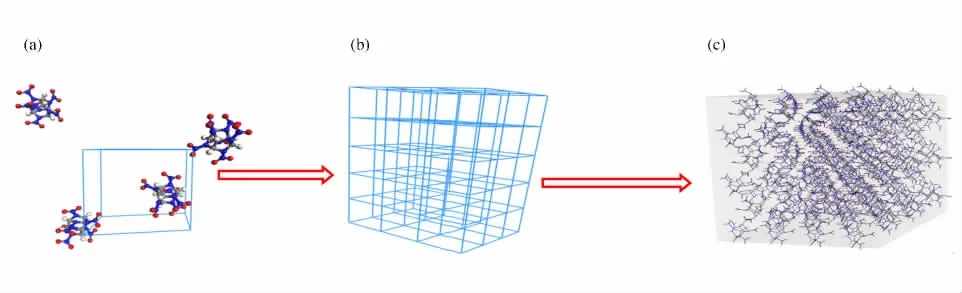
图2 ε-CL-20超晶胞结构Fig.2 The supercell structures ofε-CL-20
2 计算结果和讨论
图3中给出了γ-CL-20超晶胞的温度和平均势能随时间的变化曲线。从图3(a)可以看出,约经过0.3ps,体系的温度从300K 迅速上升到设定的温度,最后在设置的温度范围内波动,表明γ-CL-20超晶胞已经达到平衡状态。从图3(b)可以看出,不同温度下体系的平均势能先是经过快速的上升过程,随后呈指数形式衰减,表明γ-CL-20发生反应时,首先经过是快速吸热过程,随后在不同时间发生点火,最后发生分解反应释放能量。计算结果显示β-和ε-CL-20超晶胞的温度和平均势能随时间的变化曲线与γ 相超晶胞的温度和平均势能随时间的变化曲线相同。
图4中给出了γ-CL-20超晶胞体系中平均每摩尔CL-20分子发生热分解反应生成的碎片数量N随时间的变化。从图4中可以看出,γ-CL-20超晶胞体系生成的热分解产物和中间体的数量随温度的升高也呈现指数增加,表明γ-CL-20的化学反应速率随着温度的升高而增大。
图5中给出了不同温度下3种晶型CL-20超晶胞体系发生分解生成的产物碎片分布。从图5中可以看出,1 000K 时,碎 片数 量 的 大小 顺 序 为N(ε 相)>N(β 相)>N(γ 相);1 500K 时,N(ε 相)≈N(β 相)>N(γ 相);2 000和2 500K 时,N(ε 相)>N(γ 相)>N(β 相);3 000K 时,N(γ 相)>N(β相)>N(ε 相)。这种变化表明,不能仅通过碎片数量对反应过程进行分析,需要分析不同晶型发生反应生成的产物的变化。因此,将产物分为主产物和次级产物,主产物的数量大于0.2mol,次级产物的数量小于0.2mol,通过主产物随时间的变化过程分析不同晶型的CL-20的反应路径。

图3 γ-CL-20中目标温度和平均势能随时间的变化Fig.3 Time evolution of temperature and potential energy in the thermal decomposition ofγ-CL-20
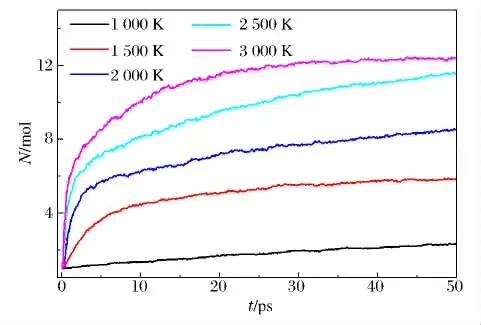
图4 γ-CL-20超晶胞生成的平均碎片数量随时间的变化Fig.4 Number of fragments per molecular in the thermal decomposition ofγ-CL-20

图5 不同温度下γ-、β-和ε-CL-20热分解碎片数量Fig.5 Fragment number per molecular in the different polymorphys of CL-20
2.1 不同温度下CL-20超晶胞的产物和热分解反应路径
图6 中给出了1 500和2 000K 时,γ-CL-20超晶胞结构中平均每摩尔γ-CL-20分子生成的主产物和中间体数量随时间的变化曲线。

图6 不同温度时γ-CL-20发生分解反应生成的主产物和中间体数量随时间的变化Fig.6 Time evolution of fragment number in the thermal decomposition ofγ-CL-20supercell at different temperatures
从图6可以看出,1 500K 时,γ-CL-20分子经过13.3ps才能完全分解;2 000K 时,γ-CL-20分子完全反应仅需3ps;γ-CL-20分子发生热解反应生成·NO2自由基的数量峰值从1 500K 时的1.24mol增加到2 000K 时的2mol,并且·NO2自由基数量峰值的生成时间从3.5ps缩短到1.4ps,表明γ-CL-20初始分解路径为N-NO2键断裂形成·NO2自由基,这与张力等[5]采用反应力场分子动力学方法和O.Isayev等[4]通过第一性原理分子动力学方法得到的ε-CL-20初始热分解反应路径相同。
1 500 K 时,γ-CL-20超晶胞发生分解反应,其主产物为N2、HNO3、NO2、NO3、H2O 和N2O5;2 000K时,γ-CL-20超晶胞发生分解反应,其主产物为N2、H2O、CO2、NO2、HNO3、N2O2和NO。主产物数量随时间的变化趋势分为3种:(1)N2、H2O、CO2、N2O2、NO 等主产物和中间体的数量随温度升高而增加;(2)HNO3等主产物和中间体的数量随着温度的升高而保持不变;(3)NO3和N2O5等主产物和中间体的数量随着温度的升高而减少。
1 500K 时,3种晶型生成的主产物相同。2 000K 时,β-和ε-CL-20中平均每摩尔CL-20分子生成的主产物和中间体数量随时间的变化如图7所示。从图6(b)和图7可以看出,2 000K 时,γ-和ε-CL-20生成的主产物为HNO2,而β-CL-20生成主产物为HNO3。
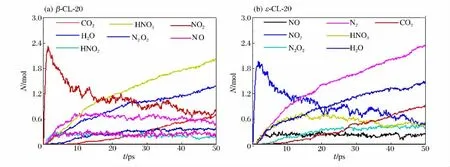
图7 2 000K 时β-和ε-CL-20发生热解反应生成的主产物和中间体数量随时间的变化Fig.7 Time evolution of fragment number in the thermal decomposition ofβ-andε-CL-20supercells at 2 000K
图8 中给出了2 500和3 000K 时,γ-CL-20生成的主产物数量随时间的变化。从图8中可以看出,2 500和3 000K 时,γ-CL-20分子分别在第1.3ps和第0.7ps完全被消耗,生成·NO2自由基,并且在3 000K 时,·NO2自由基完全反应,生成N2等产物。

图8 不同温度时γ-CL-20发生热解反应生成的主产物和中间体数量随时间的变化Fig.8 Time evolution of fragment number in the thermal decomposition ofγ-CL-20supercell at different temperatures
3 000K 时,3种晶型的CL-20生成的主产物相同。图9中给出了2 500K 时β-和ε-CL-20中平均每摩尔CL-20分子生成的主产物数量随时间的变化。从图8(b)和图9可以看出,2 500K 时γ-和β-CL-20没有生成主产物NO,但ε-CL-20却生成了主产物NO。

图9 2 500K 时β-和ε-CL-20发生热解反应生成的主产物和中间体数量随时间的变化Fig.9 Time evolution of fragment number in the thermal decomposition ofβ-andε-CL-20supercells at 2 500K
1 500K 时,3种晶型的CL-20超晶胞结构均生成的次级热分解产物包括HNO2和N2O4,γ-和ε-CL-20的次级热分解产物还包括C4H4N2,β-CL-20 的次级热分解产物还包括N2O2;当温度升高到2 000K时,3种晶型的CL-20结构均生成的次级热解产物包括NO3、N2O4和N2O5,γ-CL-20生成的C4H4N2碎片会继续发生分解形成CHN,但β-CL-20的次级热分解产物C4H4N2没有分解,此外γ-和ε-CL-20还生成HNO2等次级热分解产物;当温度升高到2 500和3 000K 时,3种晶型CL-20生成的次级产物的种类和数量的变化趋势基本相同。这表明随着温度的升高,次级反应产物及其数量对不同晶型的CL-20的分解反应没有明显影响。
图10中给出了单分子和超晶胞结构的ε-CL-20发生分解反应生成的产物,其中灰色、蓝色、红色和白色原子分别为碳、氮、氧和氢原子。从图10中可以看出,CL-20发生分解反应生成的产物包括N2、H2O、CO2和CO 等。

图10 单分子和超晶胞ε 相CL-20生成的产物Fig.10 The final products in the thermal decomposition ofε-CL-20molecule and supercell
不同温度下CL-20超晶胞中主产物随时间的变化表明,CL-20的分子结构和晶体的堆积方式没有对3种晶型在高温下的分解机理产生明显的影响,3种晶型的CL-20超晶胞结构的初始分解路径均是五元环和六元环中的硝基官能团生成·NO2自由基;2 000K 时,β-CL-20生成HNO2,2 500K 时ε-CL-20生成NO;·NO2自由基数量和位置的差异使得不同晶型的次级产物的种类和数量不同。
2.2 主产物反应速率常数
从图6~9可以看出,不同晶型的CL-20发生热解反应生成的产物种类基本相同,但主产物数量随时间的变化却不同。为了对主产物的变化过程进行计算,假定CL-20的热分解反应为一级反应,采用一级化学反应速率方程计算N2和H2O 的化学反应速率常数k,式中ct为任意时刻的浓度,c∞为平衡时的浓度,k 是一级反应速率常数。
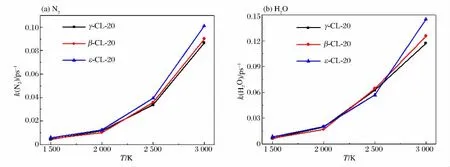
图11 不同目标温度下N2 和H2O 的反应速率常数Fig.11 Reaction rate constants of N2and H2O at different temperatures
图11 给出了不同温度下N2和H2O 的反应速率常数。从图中可以看出,主产物的反应速率常数随着温度的升高而增大,但不同晶型CL-20的产物的反应速率常数大小顺序不同。1 500~3 000K 时,N2反应速率常数的大小顺序为k(ε相)>k(β 相)>k(γ 相);但在2 500K 时,H2O 的反应速率常数出现反常,大小顺序变为k(β 相)>k(γ 相)>k(ε 相),这是由于β-CL-20在2 000K 时生成的HNO2在2 500K时发生分解所致。
3 结 论
(1)通过计算1 000~3 000K 时γ-、β-和ε-CL-20超晶胞的分解反应中主产物随时间的变化得知:CL-20的分子结构和晶体堆积方式没有对3种晶型在高温下的分解机理产生明显的影响,3种晶型的CL-20超晶胞结构的初始分解路径均为五元环和六元环中的硝基官能团生成·NO2自由基;3种晶型生成的主产物包括N2、H2O、CO、CO2、NO2、NO3、HNO3、N2O2、N2O5和NO 等,但2 000K 时β-CL-20生成HNO2,2 500K 时ε-CL-20生成NO;·NO2自由基数量和位置的差异使得不同晶型的次级产物的种类和数量不同。
(2)通过计算不同温度下N2和H2O 的反应速率常数得知:随着温度的升高,相同晶型CL-20的主产物的反应速率常数逐渐增大。1 500、2 000和3 000K 时,N2和H2O 的反应速率常数的大小顺序相同;2 500K 时,N2和H2O 的反应速率常数的大小顺序不同,这是由于β-CL-20在2 000K 时生成的HNO2在2 500K 时发生分解,使得H2O 的反应速率常数出现反常。
[1] Simpson R L,Urtiev P A,Ornellas D L,et al.CL-20performance exceeds that of HMX and its sensitivity is moderate[J].Propellant,Explosives,Pyrotechnics,1997,22(5):249-255.
[2] Patil D G,Brill T B.Thermal decomposition of energetic materials 59:Characterization of residue of hexanitrohexaazaisowurtzitane[J].Combustion and Flame,1993,92(4):456-458.
[3] Okovytyy S,Kholod Y,Qasim M,et al.The mechanism of unimolecular decomposition of 2,4,6,8,10,12-hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane:A computational DFT study[J].The Journal of Physical Chemistry A,2005,109(12):2964-2970.
[4] Isayev O,Gorb L,Qasim M,et al.Ab initio molecular dynamics study on the initial chemical events in nitramines:Thermal decomposition of CL-20[J].The Journal of Physical Chemistry B,2008,112(35):11005-11013.
[5] 张力,陈朗,王晨,等.CL-20初始热解反应机理的分子动力学计算研究[J].火炸药学报,2012,35(4):5-9.Zhang Li,Chen Lang,Wang Chen,et al.The mechanism of the initial thermal decomposition of CL-20via molecular dynamics simulation[J].Chinese Journal of Explosives &Propellants,2012,35(4):5-9.
[6] Van Duin A C T,Dasgupta S,Lorant F,et al.ReaxFF:A reactive force field for hydrocarbons[J].The Journal of Physical Chemistry A,2001,105(41):9396-9409.
[7] Bolotina N B,Hardie M J,Speer R L,et al.Energetic materials:Variable-temperature crystal structures ofγ-and ε-HNIW polymorphs[J].Journal of Applied Crystallography,2004,37(5):808-814.
[8] Foltz M F,Coon C L,Garcia F,et al.The thermal stability of the polymorphs of hexanitrohexaazaisowurtzitane[J].Propellants,Explosive,Pyrotechnics,1994,19(1):19-25
[9] 傅献彩,沈文霞,姚天扬,等.物理化学[M].5版.北京:高等教育出版社,2006:163-165.
