嗜酸乳杆菌对感染大肠杆菌O157∶H7小鼠肠道微生物区系的影响
2014-02-25王婷婷李丹凤林海君霍贵成
王婷婷,李丹凤,刘 宾,林海君,霍贵成
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨150030)
嗜酸乳杆菌对感染大肠杆菌O157∶H7小鼠肠道微生物区系的影响
王婷婷,李丹凤,刘 宾,林海君,霍贵成*
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨150030)
分析了小鼠在感染大肠杆菌O157∶H7期间肠道微生物区系的变化及嗜酸乳杆菌KLDS AD1对其肠道微生物的调节作用。结合小鼠表象特征,探讨了嗜酸乳杆菌KLDS AD1对小鼠腹泻的治疗效果。研究将小鼠分成3组,分别是PBS对照组、大肠杆菌-PBS对照组和大肠杆菌-KLDS AD1组,对实验组小鼠连续7d灌胃大肠杆菌致病后,再连续7d灌胃嗜酸乳杆菌KLDS AD1,期间采集小鼠粪便利用选择性培养基对菌群作平板计数。结果表明:嗜酸乳杆菌KLDS AD1可以极显著地提高感染大肠杆菌O157∶H7小鼠的体重(p<0.01);小鼠在感染大肠杆菌O157∶H7后粪便中致病性大肠杆菌、肠杆菌和肠球菌等条件致病菌数量显著增加(p<0.05),乳酸菌和双歧杆菌等益生菌显著减少(p<0.05)。灌胃嗜酸乳杆菌KLDS AD1后,小鼠粪便中致病性大肠杆菌、肠杆菌和肠球菌均显著降低(p<0.05),而乳酸菌和双歧杆菌增加极显著(p<0.01)。证实嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠肠道微生物平衡具有一定的调节作用,对其引起的腹泻有一定的治疗效果。
嗜酸乳杆菌,大肠杆菌,肠道微生物,微生态平衡,疾病
出血性大肠杆菌O157(Enterohemorrhagic E.coli,EHEC)是一种食源性致病菌,能引起以急性出血性腹泻为典型特征的疾病,典型菌株为EHEC O157∶H7,主要引起婴幼儿腹泻、出血性结肠炎和溶血性尿毒症等[1]。由于抗生素具有耐药性、抗药性、残留性及毒副作用,在临床上用于治疗疾病时不仅影响动物和人类的健康,而且还导致“超级病毒”的出现,威胁人类的生存。研究表明,一些益生菌能有效地预防和治疗大肠杆菌引起的腹泻[2-3],作为一种抗生素替代品,受到越来越多的关注。
嗜酸乳杆菌广泛存在于人和一些动物的肠道中,是益生菌中最具代表性的菌种。嗜酸乳杆菌通过竞争定殖位点、产生有机酸如乳酸和醋酸降低肠道pH、产生细菌素、产过氧化氢等[4]抑制病原菌如致病性大肠杆菌、金黄色葡萄球菌和沙门氏菌的定殖生长[5];通过调节肠道微生物区系[6-7],预防腹泻等肠道疾病的发生[8-9],维护人类健康。
本研究以嗜酸乳杆菌KLDS AD1为目标益生菌,通过建立肠道菌群失调动物模型和灌喂益生菌方法,采用体外微生物培养技术,研究BALB/c小鼠在感染O157∶H7期间及感染后补充嗜酸乳杆菌KLDS AD1期间肠道微生态变化,分析小鼠在患病和补充KLDS AD1期间肠道微生物变化的差异,旨在从肠道微生物区系的动态变化来探讨嗜酸乳杆菌KLDS AD1对腹泻小鼠疾病的治疗效果。
1 材料与方法
1.1 材料与仪器
大肠杆菌O157∶H7(Escherichia coli O157∶H7 ATCC 43889) 由黑龙江省出入境检验检疫局提供;嗜酸乳杆菌KLDS AD1(Lactobacillus acidophilus KLDS AD1) 购自东北农业大学教育部乳品科学重点实验室菌种库;BALB/c小鼠,雌性,清洁级,6~8周 购自北京维通利华实验动物技术有限公司,保持饲养环境温度(23±2)℃,每天人工灯光照明12h,标准小鼠饲料喂养,自由饮水;乳酸菌选择性培养基(M 17)、双歧杆菌选择性培养基(TPY)、肠杆菌选择性培养基(VRBDA)、大肠杆菌选择性培养基(麦康凯培养基)、肠球菌选择性培养基(叠氮钠-结晶紫-七叶苷培养基) 购自青岛海博生物有限公司。
DHP-9272电热恒温培养箱 上海-恒科技有限公司;HVE-50HIRAYAMA全自动高压灭菌锅、DK-98-11A电热恒温水浴锅 天津市泰斯特仪器有限公司;DH-101-3BS电热恒温鼓风干燥箱 天津市中环实验电炉有限公司;XK96-A快速混匀器 姜堰市新康医疗器械有限公司;Model 680酶标仪 美国Beckman公司;VD-1320洁净工作台 北京东联哈尔仪器制造有限公司;LD4-2低速离心机 北京医用离心机。
1.2 实验方法
1.2.1 灌胃液的制备 将培养至稳定期(18h)的嗜酸乳杆菌KLDS AD1和大肠杆菌菌液5000×g,4℃,10min离心收集菌体,无菌PBS清洗三次,悬浮于一定体积的无菌PBS,调整菌浓度108CFU/mL,4℃储存备灌胃[10-11]。
1.2.2 实验动物设计 实验将小鼠分成三组(Ⅰ组:PBS,Ⅱ组:大肠杆菌-PBS,Ⅲ组:大肠杆菌-嗜酸乳杆菌)。每天中午12:00灌胃,灌喂体积按10mL/kg(菌悬液/小鼠体重)进行[12]。实验设计方案如表1所示。

表1 小鼠分组及灌胃设计表Table.1 Grouping of mice and corresponding intragastric administration
1.2.3 小鼠的表象观测 在实验小鼠灌胃期间,每天观察并记录各组小鼠生长状态,包括进食情况、外观毛发、粪便形态和体重。
1.2.4 小鼠肠道菌群的检测 每天早上9∶00用逼迫法无菌采取小鼠粪便,将其溶于相应体积的无菌生理盐水中[13],在漩涡振荡器上将粪便充分溶解,进行10倍梯度稀释,分别取10-4、10-5、10-6三个稀释度进行平板计数,每个稀释做3个平行。VRBDA和麦康凯培养基在37℃微好氧条件下培养24h,肠球菌和TPY培养基在37℃厌氧条件下培养72h,M17培养基在35℃厌氧条件下培养72h,取特征性菌落进行形态鉴定,计数平板中菌落数[14],计算出每g粪便中的菌含量(cfu/g),结果以活菌数对数值lg cfu/g表示[15]。
1.2.5 数据处理 实验数据采用x±SD表示,EXCEL软件做t-检验。受试样品是否具有调节肠道菌群作用的判断参考赵胜娟等的实验方法[16]。
2 结果与分析
2.1 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠表象及体重的影响
在实验小鼠灌喂期间,每天观察各组小鼠生长状态,包括进食情况、外观毛发、粪便形态和体重。当小鼠出现水样稀便,进食量减少或毛发无光泽时,可以判断小鼠已经患病。本实验通过对小鼠的表象观察发现,实验第4d,Ⅱ组和Ⅲ组小鼠开始精神萎靡,并伴有不同程度的腹泻现象,小鼠毛发无光泽,进食量减少,表现出明显的病症,说明病变模型建立成功。从第8d开始,Ⅲ组小鼠在灌喂L.acidophilus KLDS AD1后进食量逐渐增加,病症有所缓解。
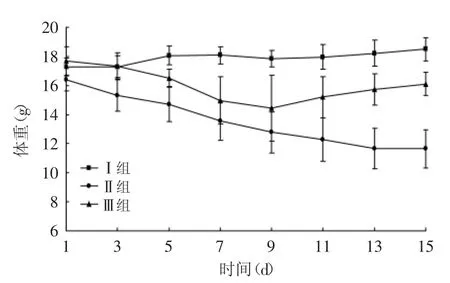
图1 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠体重的影响Fig.1 Effect of L.acidophilus KLDS AD1 on weight of mice infected with E.coli O157∶H7
体重变化见图1。由图1可知,Ⅱ组和Ⅲ组小鼠体重在开始灌喂大肠杆菌起就开始明显减少。从第9d开始,Ⅲ组小鼠体重有所上升,虽仍低于空白组,但与Ⅱ组未补充L.acidophilus KLDS AD1的小鼠相比较,体重差异极显著(p<0.01),说明L.acidophilus KLDS AD1可以缓解小鼠由于感染大肠杆菌O157∶H7造成的体重减轻、腹泻等症状。
2.2 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠肠道微生物区系的影响
2.2.1 L.acidophilus KLDS AD1对感染大肠杆菌O157∶H7小鼠肠道致病性大肠杆菌的影响 大肠杆菌作为肠道条件致病菌在菌群失衡的情况下使机体免疫力下降,引起相应的肠道疾病。
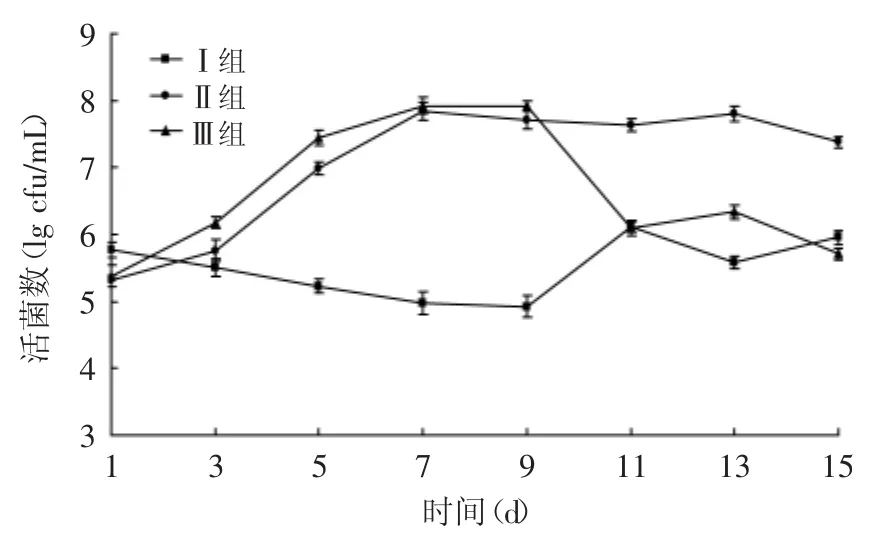
图2 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠肠道致病性大肠杆菌的影响Fig.2 Effect of L.acidophilus KLDS AD1 on Escherichia coli of mice infected with E.coli O157∶H7
由图2可知,在小鼠灌喂大肠杆菌期间,其肠道内致病性大肠杆菌的数量明显增加,且在第7d达到最大值,这与小鼠患病表象特征是相对应的,说明肠道致病菌的增加已经引起疾病的发生。Ⅱ组在第8d停止灌喂大肠杆菌后致病性大肠杆菌的数量仍处于较高水平。对Ⅲ组小鼠灌喂L.acidophilus KLDS AD1后,肠道内的致病性大肠杆菌数量明显减少,活菌数量级从8减少到6,在第11d达到空白组的水平,并且与Ⅱ组未补充L.acidophilus KLDS AD1的小鼠肠道内致病性大肠杆菌有显著性差异(p<0.05),说明L.acidophilus KLDS AD1对肠道内的大肠杆菌具有明显的抑制或排斥作用。
2.2.2 L.acidophilus KLDS AD1对感染大肠杆菌O157∶H7小鼠肠杆菌类的影响 肠杆菌为条件致病菌,既包括有益菌也包括有害菌,当机体处于健康状态时,有益菌占优势,机体维持正常,当受到外界干扰或自身机体失调时,有害菌数量增加,从而引起机体发生病变。
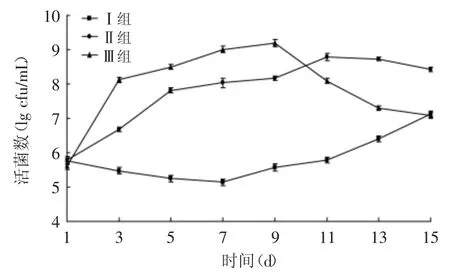
图3 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠肠杆菌的影响Fig.3 Effect of L.acidophilus KLDS AD1 on Enterobacteria of mice infected with E.coli O157∶H7
由图3可知,Ⅰ组小鼠肠道内肠杆菌数量相对较低且保持稳定,只是从7d开始有上升的趋势,在15d时增加了一个数量级,可能是由于小鼠个体机能的差异所致,相对于其他两组的变化,空白组仍在可控制之内[15]。Ⅱ组和Ⅲ组在灌喂大肠杆菌后肠杆菌数量明显上升,活菌数量级分别由6增加到8和9,且Ⅱ组在第9d停止灌喂大肠杆菌后仍有上升的趋势。在灌喂L.acidophilus KLDS AD1后,Ⅲ组小鼠肠道内肠杆菌数量开始下降,在第15d,与Ⅱ组未补充L.acidophilus KLDS AD1的小鼠有显著性差异(p<0.05),与Ⅰ组差异不显著(p>0.05),说明L.acidophilus KLDS AD1可以有效地抑制肠道内的条件致病菌。
2.2.3 L.acidophilus KLDS AD1对感染大肠杆菌O157∶H7小鼠肠球菌的影响 由图4可知,三组小鼠肠道内肠球菌数量都有所上升,且灌喂大肠杆菌的Ⅱ组和Ⅲ组与Ⅰ组没有显著性差异(p>0.05),说明大肠杆菌在前期对肠道内肠球菌影响较小,可能是由于小鼠肠道微生物对其有一定的调节作用,或者是小鼠自身对致病菌有一定的防御能力。Ⅱ组肠球菌在第9d仍保持较高水平,结合小鼠的表象特征发现,虽然停止灌喂大肠杆菌,但体内较多的大肠杆菌已经导致肠道内微生物菌群失衡,使得条件致病菌数量增加,从而引起腹泻的发生,而Ⅲ组在补充了L.acidophilus KLDS AD1后,肠球菌数量明显下降,从第11d开始与Ⅱ组相比具有显著性差异(p<0.05),说明L.acidophilus KLDS AD1可以通过抑制肠道内条件致病菌而调节肠道微生物菌群平衡,从而抑制腹泻的发生。
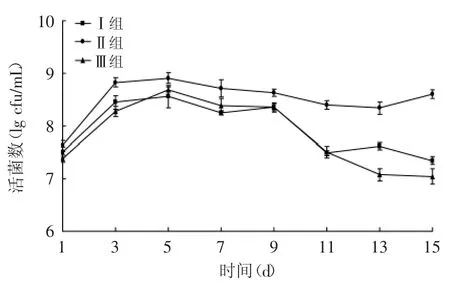
图4 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠肠球菌的影响Fig.4 Effect of L.acidophilus KLDS AD1 on Enterococcus of mice infected with E.coli O157∶H7
2.2.4 L.acidophilus KLDS AD1对感染大肠杆菌O157∶H7小鼠肠道乳酸菌的影响 乳酸菌作为益生菌和肠道微生物的主要成员,具有调节肠道微生态平衡和增强机体免疫系统的功能,乳酸菌等有益菌的变化与机体健康有密切的关系。
由图5可知,Ⅰ组乳酸菌数量维持在较高水平,Ⅱ组和Ⅲ组在灌喂大肠杆菌后乳酸菌类数量下降,第5d时与Ⅰ组具有显著性差异(p<0.05),其中Ⅱ组在停止灌喂大肠杆菌后仍有下降的趋势;Ⅲ组补充L.acidophilus KLDS AD1后,于第9d后乳酸菌类数量明显增加,甚至超过Ⅰ组,与Ⅱ组相比,差异极显著(p<0.01)。说明L.acidophilus KLDS AD1在抑制有害菌的同时,也增加了有益菌的生长,并改善了患病小鼠肠道内微生物菌群。
2.2.5 L.acidophilus KLDS AD1对感染大肠杆菌O157∶H7小鼠肠道双歧杆菌的影响 由图6可知,Ⅰ组双歧杆菌数量相对稳定,与Ⅰ组相比,Ⅱ组和Ⅲ组小鼠在灌喂大肠杆菌后第3d数量下降显著(p<0.05),其中Ⅱ组小鼠在停止灌喂大肠杆菌后仍有下降的趋势;Ⅲ组小鼠补充L.acidophilus KLDS AD1后,双歧杆菌数量明显增加,到15d几乎增加三个活菌数量级,并与未补充L.acidophilus KLDS AD1的Ⅱ组相比,差异性极显著(p<0.01)。说明L.acidophilus KLDS AD1对肠道双歧杆菌的增殖具有明显的促进作用,对感染大肠杆菌后肠道微生物菌群失调具有明显的改善作用。
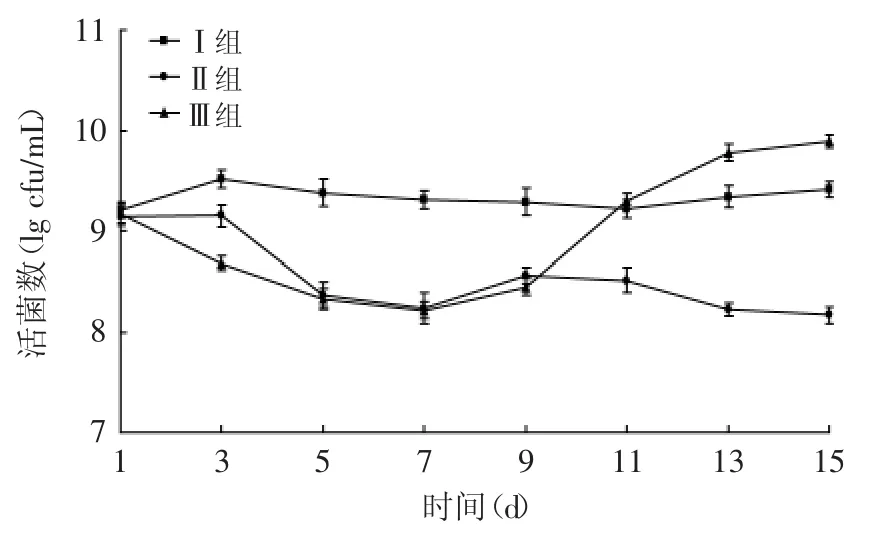
图5 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠乳酸菌的影响Fig.5 Effect of L.acidophilus KLDS AD1 on Lactobacillus of mice infected with E.coli O157∶H7
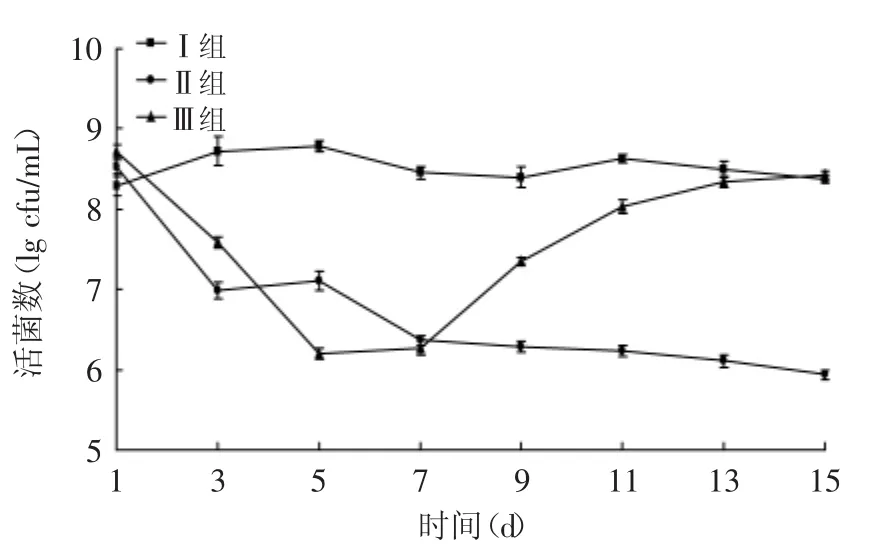
图6 嗜酸乳杆菌KLDS AD1对感染大肠杆菌O157∶H7小鼠双歧杆菌的影响Fig.6 Effect of L.acidophilus KLDS AD1 on Bifidobacterium of mice infected with E.coli O157∶H7
2.3 讨论
实验初期,小鼠肠道中乳酸菌和双歧杆菌初始浓度较高,可以在短时间内通过与病原菌竞争黏附位点、释放抑菌物质等作用抑制病原菌的繁殖,然而持续增加的大肠杆菌O157∶H7利用肠道内蛋白质和氨基酸产胺,刺激黏膜导致内毒素、外毒素的吸收,致使肠道内渗透压升高,使小鼠在第3d开始出现腹泻现象。肠道内营养物质被致病菌过多利用致使乳酸菌和双歧杆菌数量减少,条件致病菌大量繁殖,扰乱了肠道微生物平衡,进而会引起消化不良、肠炎、腹泻等一系列肠道疾病,及时补充益生菌对治疗肠道疾病具有显著的作用[17]。嗜酸乳杆菌KLDS AD1的补充不仅增加了乳酸菌本身的活菌数,而且促进了双歧杆菌的繁殖,并减少了大肠杆菌、肠杆菌和肠球菌的数量。结合体外实验分析,一方面是由于嗜酸乳杆菌KLDS AD1对大肠杆菌等致病菌具有抑制作用[5],另一方面,益生菌可以增强肠道黏膜免疫屏障作用,调节免疫系统,预防和治疗肠道感染[18]。双歧杆菌的增加可能是由于嗜酸乳杆菌KLDS AD1产酸能力强[19],在代谢过程中产生乳酸等有机酸,降低了肠道内pH,并产生一些短链脂肪酸[20],促进了双歧杆菌的生长繁殖。Yamano等[21]也认为双歧杆菌的增加可能是由于约氏乳杆菌La1发酵乳中乳酸等其他代谢物降低了肠道内pH。Spanhaak等[22]研究发现干酪乳杆菌发酵乳使得双歧杆菌和乳杆菌数量增加,而肠杆菌和梭状芽孢杆菌数量减少。
益生菌得以在肠道中发挥益生作用,不仅是因为可以调节肠道微生态失衡,还可以通过刺激肠道黏膜免疫系统分泌抗体、细胞因子等免疫分子,增强机体免疫力,抵御病原菌的入侵。副干酪乳杆菌可以有效地增强抗原呈递细胞的活性,从而抵抗大肠杆菌O157∶H7的感染,并使感染后的小鼠体重迅速恢复正常[23]。嗜酸乳杆菌作为益生菌的重要成员,也具有免疫增强的作用[24]。因此,对于嗜酸乳杆菌KLDS AD1是否是通过免疫增强的作用预防和治疗腹泻等疾病还有待进一步研究。
3 结论
嗜酸乳杆菌用于治疗不同腹泻,如抗生素腹泻、急性胃肠炎、旅行者腹泻,难辨梭菌导致的反复腹泻[25]。本研究使用嗜酸乳杆菌KLDS AD1对小鼠腹泻模型灌胃后,与对照组相比,致病性大肠杆菌、肠杆菌和肠球菌数量降低,而乳酸菌和双歧杆菌数量增加,且小鼠体重有一定的恢复。嗜酸乳杆菌不仅对大肠杆菌等致病菌具有抑制作用,而且通过代谢作用为双歧杆菌的生长创造有利条件,同时嗜酸乳杆菌和肠道内双歧杆菌等有益菌结合,具有良好的益生作用[26]。因此,嗜酸乳杆菌KLDS AD1可以通过调节肠道内致病菌和有益菌而调节肠道微生物区系的平衡,对小鼠感染大肠杆菌O157∶H7引起的腹泻有一定的治疗作用。
[1]杜崇涛.大肠杆菌O157噬菌体的分离鉴定及其初步应用[D].长春:吉林大学,2008.
[2]KONSTANTINOV S R,SMIDT H,AKKERMANS A D L,et al.Feeding of Lactobacillus sobrius reduces Escherichia coli F4 levels in the gut and promotes growth of infected piglets[J]. FEMS Microbiology Ecology,2008,66(3):599-607.
[3]TARAS D,VAHJEN W,MACHA M,et al.Performance,diarrhea incidence,and occurrence of Escherichia coli virulence genes during long-term administration of a probiotic Enterococcus faecium strain to sows and piglets[J].Journal of Animal Science,2006,84(3):608-617.
[4]KAILASAPATHY K,CHIN J.Survival and therapeutic potential of probiotic organisms with reference to Lactobacillus acidophilus and Bifidobacterium spp.[J].Immunology and Cell Biology,2000,78(1):80-88.
[5]田芬,陈俊亮,粘靖祺,等.嗜酸乳杆菌和双歧杆菌益生特性的研究[J].食品工业科技,2012,33(7):139-142.
[6]OELSCHLAEGER T A.Mechanisms of probiotic actions-a review[J].International Journal of Medical Microbiology,2010,300(1):57-62.
[7]WOHLGEMUTH S,LOH G,BLAUT M.Recent developments and perspectives in the investigation of probiotic effects[J]. International Journal of Medical Microbiology,2010,300(1):3-10.
[8]DELCENSERIE V,MARTEL D,LAMOUREUX M,et al. Immunomodulatory effects of probiotics in the intestinal tract[J]. Current Issues in Molecular Biology,2008,10(1/2):37-54.
[9]TSAI Y T,CHENG P C,PAN T M.The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J].Applied Microbiology and Biotechnology,2012,96(4):853-862.
[10]DOGI C A,GALDEANO C M,PERDIGO’N,et al.Gut immune stimulation by non pathogenic Gram(+)and Gram(-)bacteria. Comparison with a probiotic strain[J].Cytokine,2008,41(3):223-231.
[11]GALDEANO C M,PERDIGON G.The probiotic bacterium Lactobacilluscaseiinducesactivation ofthe gutmucosal immune system through innate immunity[J].Clinical and Vaccine Immunology,2006,13(2):219-226.
[12]YANG H,LIU S,IBRAHIM S A,et al.Oral administration of live Bifidobacterium substrains isolated from healthy centenarians enhanced immune function in BALB/c mice[J]. Nutrition Research,2009,29(4):281-289.
[13]STROMPFOVA V,MARCINˇÁKOVÁ M,SIMONOVETÁ M,et al.Enterococcus faecium EK13-an enterocin A-producing strain with probiotic character and its effect in piglets[J].Anaerobe,2006,12(5):242-248.
[14]王友湘,陈庆森.瑞士乳杆菌对小鼠肠道微生物区系的影响[J].食品科学,2008,29(9):542-546.
[15]ZHANG L,XU Y Q,LIU H Y,et al.Evaluation of Lactobacillus rhamnosus GG using an Escherichia coli K88 model of piglet diarrhoea:Effects on diarrhoea incidence,faecal microflora and immune responses[J].Veterinary Microbiology,2010,141(1):142-148.
[16]赵胜娟,罗红霞,杨海莺,等.双歧杆菌BBMN01对小鼠肠道菌群的影响[J].食品科学,2008,29(2):394-397.
[17]李伟,陈庆森.肠道黏膜免疫屏障及其菌群与机体健康关系的研究进展[J].食品科学,2008,29(10):649-655.
[18]GALDEANO C M,DE LEBLANC A M,DOGI C,et al. Lactic acid bacteria as immunomodulators of the gut-associated immune system[J].Biotechnology of Lactic Acid Bacteria,2010:125-140.
[19]田芬,粘靖祺,霍贵成.嗜酸乳杆菌和双歧杆菌发酵乳的流变特性研究[J].食品科学,2012,33(5):155-159.
[20]SANDERS M E,KLAENHAMMER T R.Invited Review:The Scientific Basis of Lactobacillus acidophilus NCFM Functionality as a Probiotic[J].Journal of Dairy Science,2001,84(2):319-331.
[21]YAMANO T,IINO H,TAKADA M,et al.Improvement of the human intestinal flora by ingestion of the probiotic strain Lactobacillus johnsonii La1[J].British Journal of Nutrition,2006,95(2):303-312.
[22]SPANHAAK S,HAVENAAR R,SCHAAFSMA G.The effect of consumption of milk fermented by Lactobacillus casei strain Shirota on the intestinal microflora and immune parameters in humans[J].European Journal of Clinical Nutrition,1998,52(12):899-907.
[23]TSAI Y T,CHENG P C,PAN T M.Immunomodulating activity of Lactobacillus paracasei subsp.paracasei NTU 101 in Enterohemorrhagic Escherichia coli O157∶H7-infected mice[J]. Journal of Agricultural and Food Chemistry,2010,58(21):11265-11272.
[24]VAN BAARLEN P,WELLS J M,KLEEREBEZEM M. Regulation of intestinal homeostasis and immunity with probiotic lactobacilli[J/OL].Trends in Immunology,2013,In press.http:// dx.doi.org/10.1016/j.it.2013.01.005.
[25]BEAUSOLEIL M,FORTIER N,GUENETTE S.Effect of a fermented milk combining Lactobacillus acidophilus CL1285 and Lactobacillus casei in the prevention of antibiotic-associated diarrhea:a randomized,double-blind,placebo-ontrolled trial[J]. Can J Gastroenterol,2007,21(11):732-736.
[26]KAILASAPATHY K,CHIN J.Survival and therapeutic potential of probiotic organisms with reference to Lactobacillus acidophilus and Bifidobacterium spp.[J].Immunology and Cell Biology,2000,78(1):80-88.
Effects of Lactobacillus acidophilus KLDS AD1 on intestinal microbiota of Escherichia coli O157∶H7 infected mice
WANG Ting-ting,LI Dan-feng,LIU Bin,LIN Hai-jun,HUO Gui-cheng*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Gut microbiota changes were investigated in the present study after infection with Escherichia coli O157∶H7 and treated with Lactobacillus acidophilus KLDS AD1.Appearance characteristics were employed to identify the preventive roles of L.acidophilus KLDS AD1 in the mice infected with E.coli O157∶H7.Mice were randomly allocated to nonchallenged control(Ⅰ),E.coli-PBS treatment(Ⅱ)and E.coli-L.acidophilus treatment(Ⅲ)groups.After oral administration of E.coli O157∶H7 for 7 days,the infected mice were fed with L.acidophilus KLDS AD1 for another 7 days,and the numbers of bacteria in the faeces of mice were counted. Results indicated that L.acidophilus KLDS AD1 could result in the weight gain significantly of E.coli O157∶H7 infected mice(p<0.01).Faecal Lactobacillus,Bifidobacterium counts were significantly decreased(p<0.05),while Enterococcus,Enterobacteria and E.coli counts were obviously increased(p<0.05),in groupsⅡandⅢafter E.coli O157∶H7 challenge compared with groupⅠ.After oral administration of L.acidophilus KLDS AD1,the number of Enterococcus,Enterobacteria and E.coli were significantly lower(p<0.05),while Lactobacillus,Bifidobacterium counts were obviously higher(p<0.01)in groupsⅢthan groupsⅡ.These results demonstrated that L.acidophilus KLDS AD1 was effective in regulating the intestinal microbiota and ameliorating diarrhea in E.coli O157∶H7 infected mice.
Lactobacillus acidophilus;Escherichia coli;intestinal microflora;eubiosis of microflora;disease
Q939.11+7
A
1002-0306(2014)04-0341-05
2013-07-30 *通讯联系人
王婷婷(1988-),女,硕士研究生,研究方向:乳品科学与微生物。
国家“863”项目(2011AA100902);国家“863”计划(2012AA022108);食品安全与营养协同创新中心。
