采用膜分离法从玉米皮中制备阿魏酸的研究
2014-02-25赵升强姚胜文欧仕益邹悦瑜彭喜春
赵升强,姚胜文,欧仕益,邹悦瑜,林 菁,彭喜春,吴 宵
(1.暨南大学食品与科学工程系,广东广州510632;2.广东省汇香源生物科技股份有限公司,广东广州511400)
采用膜分离法从玉米皮中制备阿魏酸的研究
赵升强1,姚胜文1,欧仕益1,邹悦瑜1,林 菁1,彭喜春1,吴 宵2
(1.暨南大学食品与科学工程系,广东广州510632;2.广东省汇香源生物科技股份有限公司,广东广州511400)
采用乙醇/水/NaOH溶液从玉米麸皮中提取阿魏酸,解决了提取液粘度高而难于实现膜分离的问题。最优提取工艺为:NaOH 0.25mol/L,醇水比1∶1(v/v),料液比1∶10(w/v),提取时间2.0h,提取温度75℃,搅拌速度120r/min。膜分离工艺为:利用截留分子量为5000u的超滤膜,在室温、0.10MPa下超滤,阿魏酸透过率达86.4%;透过液用截留分子量150u的纳滤膜在0.45MPa、30℃下浓缩120min,此时料液浓缩4.3倍,阿魏酸截留率为94.3%。将纳滤浓缩液经酸化、结晶,低温干燥后获得阿魏酸含量为55.8%粗制品;粗制品得率为16.5g/kg玉米皮。
玉米皮,阿魏酸,碱醇,超滤,纳滤
阿魏酸是当归、川穹等中药中的有效成分之一,因其具有抗衰老、抗氧化、抗菌消炎、降压防癌等功效而被广泛应用于医药、食品和化妆品等行业[1-3]。阿魏酸在植物细胞壁中通过酯键与多糖或木质素交联,或自身形成二阿魏酸[4-5]。目前工业上普遍采用碱法皂化米糠油中谷维素制备阿魏酸,但该法成本高[5]。一些粮油糖加工副产物如玉米皮、麦麸、甜菜渣等阿魏酸含量较高,其中玉米皮含量超过其干重的3%[6-7],因此玉米皮是提取天然阿魏酸的理想原料。麸皮中的结合态阿魏酸可采用阿魏酸酯酶和碱处理游离[8-10],但因阿魏酸酯酶目前没有商品酶制剂且酶解效率低而不能应用于工业化生产,而碱法的效率显著高于酶法。但碱法也有其明显的不足,如溶解出的杂质多,碱解液粘度高而给阿魏酸的分离纯化带来困难,过去主要采用萃取、离子交换、大孔树脂和活性炭吸附[6]等方法分离纯化阿魏酸。但这些方法存在有机溶剂消耗多、分离效率低和成本高等缺点。膜分离法作为一种新型的分离技术,在酶与多糖等活性物质分离纯化领域已有应用[11-12],但直接采用膜分离技术从碱解麸皮液中纯化小分子生物活性物质阿魏酸还未见报道。
本研究采用醇碱溶液从玉米皮中提取阿魏酸,解决固液分离和多糖对膜的堵塞问题,而后采用超滤和纳滤联用浓缩阿魏酸,通过结晶获得阿魏酸,从而为玉米皮深加工和阿魏酸工业化生产提供借鉴。
1 材料与方法
1.1 材料与仪器
玉米皮 由保龄宝生物股份有限公司赠送;阿魏酸标准品(色谱纯) 阿拉丁试剂(中国)有限公司;NaOH、无水乙醇 均为分析纯。
DF-Ⅱ型集热式磁力加热搅拌器 金坛市医疗仪器厂;F20H2型恒温反应器 上海申生科技有限公司;三足离心机 张家港市远华机械制造厂;中空纤维超滤组件 切割分子量5ku,有效膜面积0.6m2,无锡超滤设备厂;聚砜纳滤膜 切割分子量150u,有效膜面积0.25m2,无锡超滤设备厂;KDC-12型低速离心机 科大创新股份有限公司中佳分公司;SHIMADZM LC-20AT高效液相色谱分析系统。
1.2 实验方法
1.2.1 碱醇溶液提取玉米皮中阿魏酸的工艺 为获得最适工艺,在单因素实验基础上,采用正交表L16(45)考察不同NaOH浓度、醇水比、料液比、提取时间和温度组合对玉米皮中阿魏酸释放量和料液粘度的影响(表1)。
取5.0g的干燥玉米皮置于250mL的平底烧瓶中,加入不同配比的醇/碱水溶液,放入磁转子,在磁力搅拌水浴中进行回流提取(120r/min),提取后冷却至室温,抽滤,采用毛细管法[13]测定滤液粘度;滤渣用1倍体积50%乙醇洗涤两次,合并滤液,蒸掉乙醇后定容;用移液管移取1mL料液置于离心管中,加9mL无水乙醇,振摇混合后于4000r/min下离心25min,用HPLC法[6]测定上清液中阿魏酸含量,并结合TOPSIS[14]多指标综合评价法筛选最适工艺。评分时以阿魏酸释放量为高优指标,以粘度为低优指标对原始数据矩阵进行归一化,确定正理想解和负理想解,计算每个方案到正理想解(A)和负理想解的距离(B):TOPSIS评分Y(%)=B/(A+B)×100,评分越高愈好。
1.2.2 超滤
1.2.2.1 阿魏酸提取液制备 取3.0kg玉米麸皮采用1.2.1中获得的最佳工艺,用20L的恒温反应器提取阿魏酸,冷却,用三足离心机离心,滤渣用50%乙醇洗两次,合并滤液,旋蒸(50℃)除去乙醇,料液冷却后超滤。
1.2.2.2 超滤 将料液过截留分子量为5000u的超滤膜,研究了在室温下不同压力(0.05、0.10、0.15MPa)对膜通量和阿魏酸透过率的影响。膜通量和阿魏酸透过率计算如下:
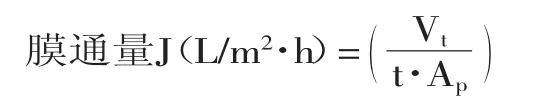
式中,Vt为t时刻透过液体积(L),Ap为膜面积(m2)。
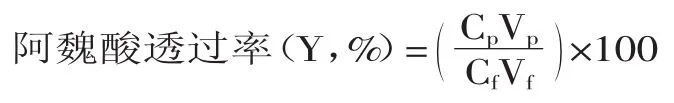
式中,Cp和Cf为透过液和原料液中阿魏酸浓度(mol/L),Vp和Vf为透过液和原料液体积(L)。
1.2.3 纳滤 研究了30℃下、1h时不同压力(0.05、0.15、0.30、0.45、0.55、0.65MPa)对膜通量变化的影响,30℃下不同压力(0.30、0.45、0.55MPa)下膜通量随时间的变化趋势,0.15MPa下、1h时不同温度(15、 20、30、40、45、50℃)对膜通量变化的影响,0.45MPa、30℃下浓缩时间(30、50、70、100、120、140min)对阿魏酸截留率和浓缩系数的影响,确定纳滤的最佳工艺。膜通量按1.2.2所述计算,阿魏酸截留率和浓缩系数计算如下:
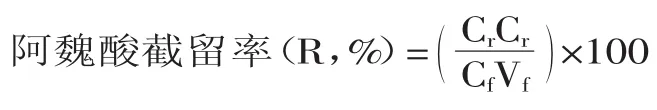
式中,Cr和Cf为截留液和原料液中阿魏酸浓度(mol/L),Vr和Vx为截留液和原料液体积(L)。
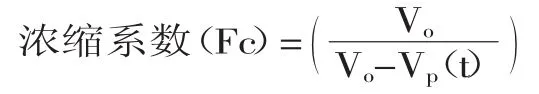
式中,Vo为原料液体积(L),Vp(t)为t时刻透过液体积(L)。
1.2.4 阿魏酸的结晶 将纳滤浓缩液用盐酸将pH调至2后室温沉降24h,过滤,析出物于40℃干燥,获得阿魏酸制品。
1.2.5 HPLC法测定阿魏酸含量[6]色谱条件:色谱柱Eclipse XDB-C18(4.6mm×250mm,5μm),流动相为
1%冰醋酸(甲相)-甲醇(乙相),洗脱条件:0~28min 28%甲醇,28~40min 95%甲醇,40~45min 28%甲醇,检测波长320nm,流速0.8mL/min,柱温40℃,进样量10μL。以保留时间定性,以外标法定量。除标注外,所有实验重复2次。
2 结果与讨论
2.1 不同提取条件对阿魏酸提取率和提取液粘度的影响
不同条件下阿魏酸释放量和料液粘度以及综合评分见表1。由表1可以看出实验7号(NaOH摩尔浓度0.5mol/L,醇水比7∶3,料液比1∶20,提取时间1.5h,提取温度75℃)综合评分最高,其次为3号(NaOH摩尔浓度0.25mol/L,醇水比7∶3,料液比1∶15,提取时间2.5h,提取温度85℃)和2号(NaOH摩尔浓度0.25mol/L,醇水比1∶1,料液比1∶10,提取时间2.0h,提取温度75℃);从阿魏酸释放量来看,2、3号产生的阿魏酸显著高于7号,但2、3号之间无显著差异。
对影响综合评分的各因素进行极差分析,R值越大说明该因素的影响越大。表1结果表明各因素对提取效果的影响程度依次为:C(料液比)>B(醇水比)>E(提取温度)>D(提取时间)>A(NaOH浓度)。因素水平最佳组合为A2B3C3D3E2,即NaOH摩尔浓度0.5mol/L,醇水比7∶3,料液比1∶15,提取时间2.5h,提取温度75℃。此组合下进行三次实验,结果表明阿魏酸释放量为(14.0±0.1)mg/g,粘度为(3.4±0.1×10-3)Pa·s,综合评分为67.9%,高于表1中其他实验组合最高得分66.4%。但其阿魏酸释放量与2、3号实验相比差异不显著,所用碱量较2、3号实验加倍。
2号条件温和,碱醇用量低,反应时间适中,粘度小,抽滤容易。因此,综合考虑生产成本,选择实验2号作为提取阿魏酸的最适工艺。
2.2 超滤工艺的选择
图1是不同压力下超滤平均膜通量随时间的变化关系。从图1中可以看出,0.05MPa时平均通量随时间增加变化较为平缓但膜通量较低;在0.10、0.15MPa时,20min前通量随时间变化均有较大变化但0.15MPa时膜污染更为严重,其后通量变化趋于平稳且相差不大。结果表明,压力越高,膜通量衰减越大,压力越低膜通量衰减越小,但过低压力会导致超滤时间过长难以满足生产需要;20min后膜通量已趋于平稳。因此,超滤压力选择为0.10MPa,时间选为20min。此时阿魏酸透过率为73.9%。
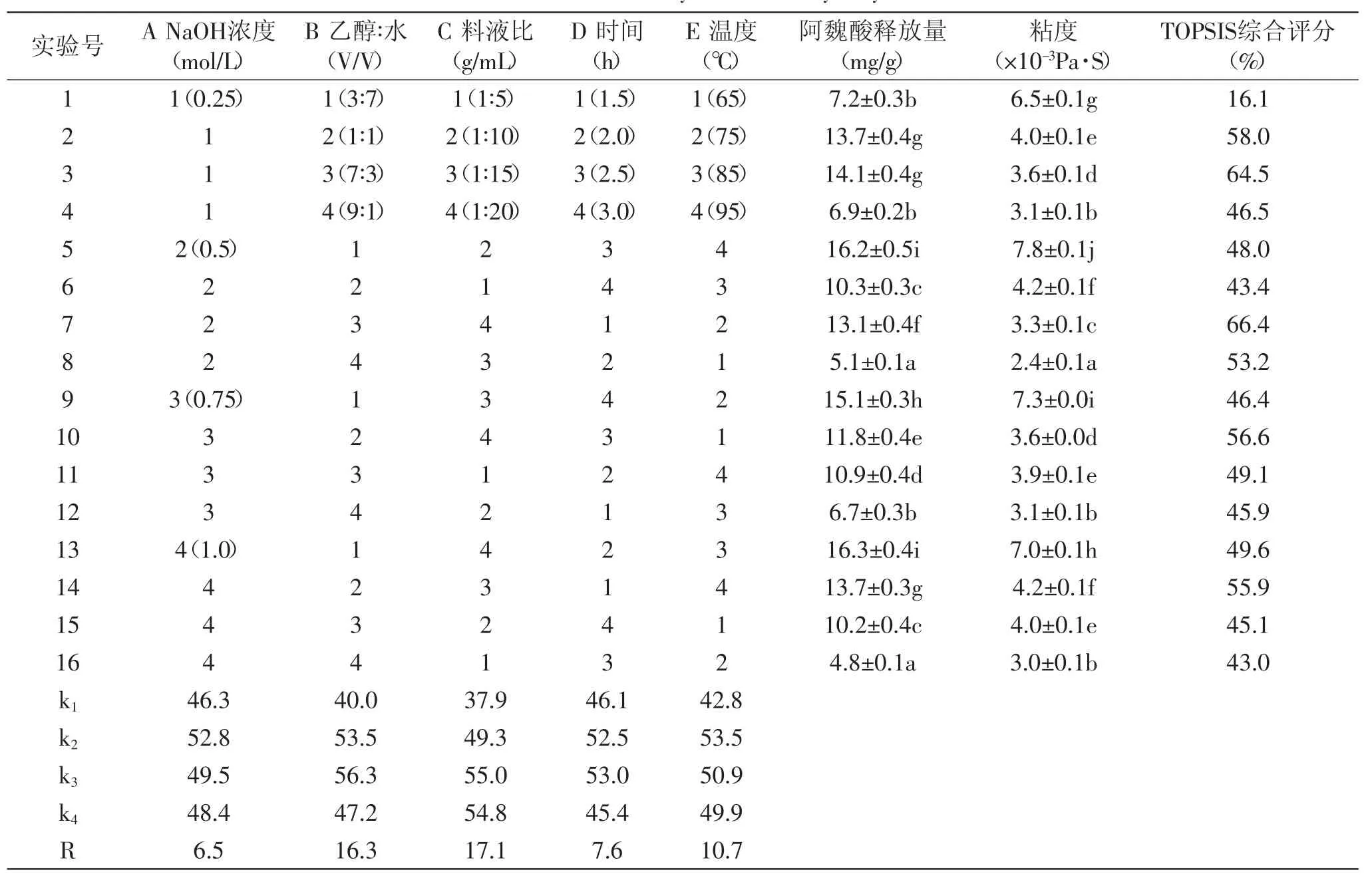
表1 NaOH浓度、醇水比、料液比、提取时间和温度对玉米皮中阿魏酸释放量和料液粘度的影响Table.1 Effect of the concentration of NaOH,ethanol/water ratio,soild/liquid ratio,hydrolysis time and temperature on the release of ferulic acid and viscosity of alkaline hydrolysate
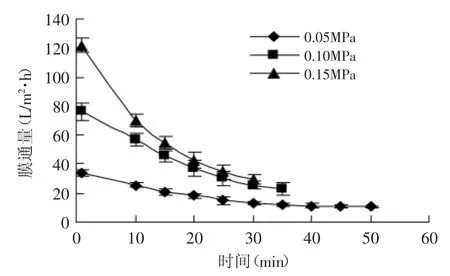
图1 不同压力下平均膜通量随时间的变化Fig.1 Change in flux during ultrafiltration at different pressures
为充分回收阿魏酸,浓缩20min后(浓缩系数为3.9),向截留液中加两倍水后再超滤,浓缩两倍后阿魏酸透过率达86.4%。
2.3 纳滤工艺的选择
2.3.1 纳滤压力的选择 图2是不同压力对膜通量的影响。从图2中可以看出,膜通量随压力增加而增大,在压力0.05~0.45MPa内,通量随压力增加基本上呈线性变化,0.45MPa后,通量随压力升高而趋于平稳。
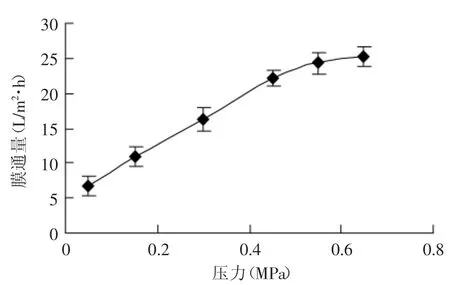
图2 压力对平均膜通量的影响Fig.2 Effect of pressure on the average flux of nanofiltration
图3是不同压力下膜通量随时间的变化关系。从图3中可以看出,不同压力下初始通量相差较大,膜通量随时间增加而降低,30min后膜通量变化已趋于平缓,随时间延长变化不大;30min时,在0.55MPa时膜通量下降较为突出表明膜污染较快,0.30MPa时膜通量变化较小,但其膜通量较小,0.45MPa时膜通量下降约为37%,30min时0.45、0.55MPa下的膜通量分别为26.2、28.4L/m2·h,通量相比差别不大。因此综合考虑生产效率和能耗选择0.45MPa为纳滤压力。
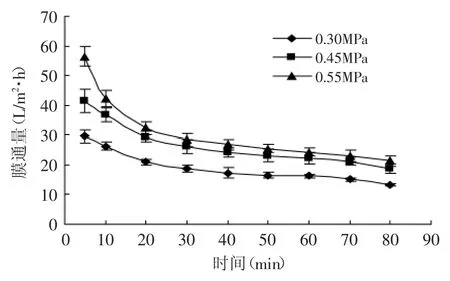
图3 不同压力下平均膜通量随时间的变化Fig.3 Change in flux during nanofiltration at different pressures
2.3.2 纳滤温度的选择 图4为温度对膜通量的影响。从图4中可以发现温度对膜通量有显著影响,膜通量随温度升高而极大提高。但过高的温度会降低膜使用寿命,一般纳滤膜的最高使用温度不超过50℃,因此纳滤温度选择20~40℃为宜,综合考虑能耗和生产效率,选择30℃为纳滤工艺温度。
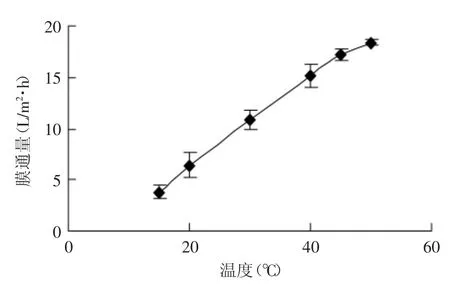
图4 温度对平均膜通量的影响Fig.4 Effect of temperature on the average flux of nanofiltration
2.3.3 纳滤时间的选择 表2为浓缩时间对阿魏酸截留率和浓缩系数的影响。从表2中可以看出,随浓缩时间增加,阿魏酸截留率降低,但总体差异不大,阿魏酸截留率在92%以上,表明所选纳滤膜对阿魏酸截留效果很好。同时,随着浓缩时间的增加,浓缩系数升高,但能耗会增加,综合考虑阿魏酸回收率,浓缩系数和降低能耗,选择浓缩时间120min,此时浓缩系数为4.3倍,阿魏酸截留率为94.3%。
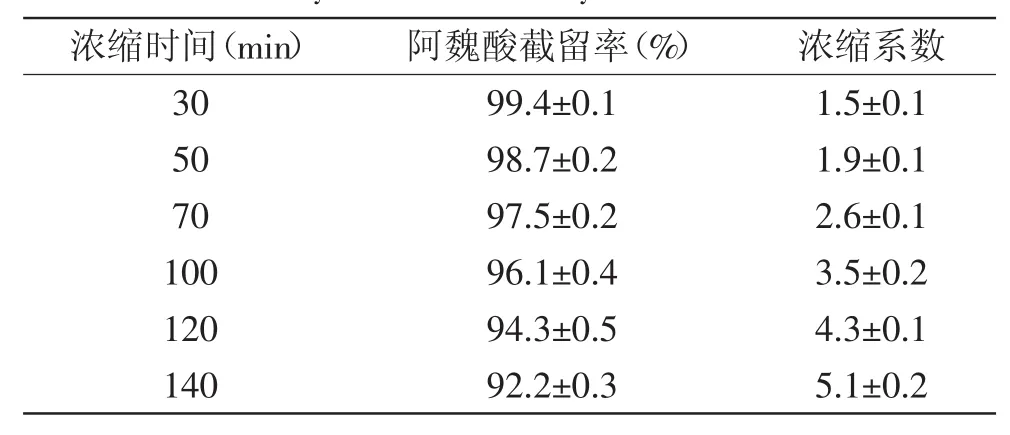
表2 浓缩时间对纳滤时阿魏酸截留率和浓缩系数的影响Table.2 Effect of time on the concentration factor and therecovery of ferulic acid by nanolfiltration
2.4 阿魏酸纯化制备
将纳滤截留液调pH2.0后,发现阿魏酸可直接结晶析出。抽滤、经低温干燥后获得阿魏酸质量分数为55.8%粗制品,粗制品得率为16.5g/kg玉米皮。与其他的文献的得率进行对比,较罗艳玲等[5]用乙酸乙酯萃取法制备玉米皮中阿魏酸的得率(纯度82.69%,收率148.92mg/10g玉米皮)略低,但高于张国升[15]采用结晶方法从米糠中提取阿魏酸的得率0.16%(以原料计)。
3 结论
采用碱醇水溶液可释放出玉米皮中大部分阿魏酸,料液粘度较低,可顺利实现离心和超滤,解决了固液分离和后续膜堵塞问题。采用超滤和纳滤结合可使玉米皮提取液中阿魏酸的纯化和浓缩,酸化后可直接结晶析出阿魏酸,阿魏酸收率仍有待提高。本研究开发的膜分离技术工艺简单,在制备阿魏酸的同时实现了大部分碱液回收(纳滤透过液可继续用于提取阿魏酸)。
[1]欧仕益.阿魏酸的功能和应用[J].广州食品工业科技,2002,18(4):50-53.
[2]Eun OK,Kyoung JM,Taeg KK,et al.Anti-inflammatory activity of hydroxycinnamic acid derivatives isolated from corn bran in lipopolysaccharide-stimulated Raw 264.7 macrophages [J].Food and Chemical Toxicology,2012,50:1309-1316.
[3]Jonas LB,Britta HP,Heiko S,et al.Antioxidant activities of corn fiber and wheat bran and derived extracts[J].LWT-Food Science and Technology,2013,50:132-138.
[4]Mussatto SI,Dragone G,Roberto IC.Ferulic and pcoumaric acids extraction by alkaline hydrolysis of brewer’s spent grain[J].Ind Crop Prod,2007,25:231-237.
[5]罗艳玲,欧仕益.碱解玉米皮制备阿魏酸的研究[J].中国食品学报,2007,5(7):97-101.
[6]Ou SY,Luo YL,Huang CH,et al.Production of coumaric acid from sugarcane bagasse[J].Innovative Food Science and Emerging Technologies,2009(10):253-259.
[7]Devin J R,George E I,Sean X L.Utilisation of corn(Zeamays)bran and corn fiber in the production of food components[J].J Sci Food Agric,2010,90:915-924.
[8]LASZLO J A,COMPTON D L,LI X L.Feruloyl esterase hydrolysis and recovery of ferulic acid from jojoba meal[J].Industrial Crop and Products,2006,23(1):46-53.
[9]PAOLO,TORRE,BAHAR A,et al.Release of ferulic acid from corn cobs by alkaline hydrolysis[J].Biochemical Engineering Journal,2008,40:500-506.
[10]杨雪,杨艳艳,张志清.麦麸中阿魏酸提取纯化工艺的研究进展[J].农产品加工·创新版,2010(7):21-27.
[11]MELLO BC B S,PETRUS JCC,HUBINGER MDH. Concentration of flavonoids and phenolic compounds in queous and ethanolic propolis extracts through nanofiltration[J].Journal of Food Engineering,2010,96:533-539.
[12]Paun G,Neagu E,Tache A,et al.Application of the nanofiltration process for concentration of polyphenolic compounds from Geranium robertianum and Salvia officinalis extracts[J]. Chemical and Biochemical Engineering,2012,25:453-460.
[13]高桂丽,李大勇,石德全.液体粘度测定方法及装置研究现状与发展趋势简述[J].检测与控制装置,2006,33(2):65-70.
[14]Wang YR,Ren LF,Chen LW.A novel improved TOPSIS method and its application[J].Journal of Central South University, 2013,38(2):196-201.
[15]张国升.从米糠中提取阿魏酸的研究[J].安徽中医院学报,1997,16(6):56-57.
Study on preparation of ferulic acid from corn bran by ultra-and nano-filtration
ZHAO Sheng-qiang1,YAO Sheng-wen1,OU Shi-yi1,ZOU Yue-yu1,LIN Jing1,PENG Xi-chun1,WU Xiao2
(1.Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China;2.Huixiangyuan Biological Technology Company,Guangzhou 511400,China)
Ferulic acid was released from corn bran by alkaline-ethanol aqueous solution,thus significantly decreased the viscosity of extracts and mad it easy for further purification by membrane separation.The optimal extraction technology was:one weight of corn bran was suspended in 10 volume of extraction solution(0.25mol/L NaOH dissolved in 50%ethanol solution)and extracted at 75℃ for 2h under constant stirring at 120r/min.Ferulic acid in the extract was concentrated and purified using ultrafiltration and nanofiltration successively.86.4%of ferulic acid was recovered in the permeats when extracts were ultrafiltrated using the membrane with 5000u molecular cutoff.These permeats after ultrafiltration was then nanofiltrated using a membrane with 150u molecular cutoff,when the concentration factor reached 4.3,94.3%of ferulic acid was maintained in the retentate,in which,the pH value was adjusted to 2.0 and the crystal of ferulic acid was obtained.After the extraction and separation processes,it was yielded 16.5g/kg of ferulic acid powder with the purity of 55.8%.
corn bran;ferulic acid;alkaline-ethanol;ultrafiltration;nanofiltration
TS210.9
B
1002-0306(2014)04-0204-05
2013-07-02
赵升强(1987-),男,硕士研究生,研究方向:粮食、油脂与植物蛋白工程。
暨南大学科研培育与创新基金(21613419);国家自然科学基金项目(31071596)。
