H10亚型禽流感病毒全球谱系分析
2014-02-24,,,,,
,,,,,
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.青岛市黄岛区动物卫生监督所,山东青岛 266400)
H10亚型禽流感病毒全球谱系分析
蒋文明1,于美芳1,王素春1,张玲妮2,陈继明1,黄保续1
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.青岛市黄岛区动物卫生监督所,山东青岛 266400)
本文借助于GenBank中的Inf l uenza Virus Resource和已发表的相关文献报道,对H10亚型禽流感病毒在全球和中国的流行谱系、流行情况和致病性进行了分析。全球H10亚型主要存在北美和欧亚2个谱系。H10病毒的HA受体结合位点分析表明,其倾向于结合α-2,3-唾液酸受体,属于典型的禽流感病毒特征。对H10病毒的HA裂解位点分析表明,大部分H10病毒具有低致病特性。综合分析认为,目前H10N8出现大规模流行的可能性不大,但仍需要提高警惕、加强监测。
禽流感;H10亚型;谱系分析;致病性
2013年12月,江西省南昌市在1例女患者病例标本中检测出H10N8禽流感病毒。报道显示,患者73岁,临床诊断为重症肺炎,并伴有高血压、心脏病、重症肌无力等基础性疾病,免疫水平低下,病人在入院治疗6天后死亡。据悉,死者生前有活禽经营市场暴露史,但所有密切接触者均未出现异常。H7N9还没有完全结束,现在又多了个H10N8,无疑将禽流感又推向了风头浪点。
1 禽流感病毒分类
禽流感病毒属于A型流感病毒,跟据其病毒血凝素蛋白(HA)的不同可分为1~18个亚型,根据神经氨酸酶(NA)的不同可分为1~11个亚型[1],HA的不同亚型和NA的不同亚型相互组合形成不同亚型的流感病毒,以HxNx方式组合,共可组合成近200种亚型。由于禽流感病毒存在抗原转变的特点,因此这个大家族里,会发生不断的组合,有的组合不稳定,转瞬即逝,有的较为稳定。加上此次出现的H10N8亚型,已发现9种人感染禽流感的亚型。
H10亚型禽流感病毒(AIV)属于低致病性毒株,研究表明,它主要存在于野生水禽体内。该亚型病毒除感染野生鸟类外,还可以感染各种家禽以及哺乳动物,如鸡、火鸡、家鸭、猪、水貂等,有些病毒能够引起发病。H10亚型AIV感染后,可再次感染其他亚型AIV,在宿主体内可能发生复杂的基因重组,产生新型的重组病毒。
2 全球H10亚型禽流感病毒谱系分析及流行情况
从GenBank的Influenza Virus Resource网站,下载所有的H10亚型禽流感病毒的血凝素基因核苷酸序列,用MUSCLE软件进行对比,再用MEGA5.2软件对其序列进行谱系分析。谱系分析的参数设置如下:采用Neighbor-joining计算方法,核苷酸变异设为Kimura 2-parameter模式,各位点变异速率设为Gamma分布(Gamma参数为4.0)。Bootstrap值的计算设置为1000个重复。
对H10亚型禽流感病毒HA系统进化分析表明,全球H10亚型禽流感病毒主要分成2个大的谱系(图1),北美谱系和欧亚谱系,与以前的报道相一致[2]。北美谱系又可分为2个明显的分支,一个是2000年之前的病毒分支,另一个是2000年之后的病毒分支;欧亚谱系也可分为2个明显的分支,一个是1985年之前的古老的病毒分支,另一个是1997年之后的新病毒分支。虽然全球的H10病毒分为2个明显的分支,但也出现了一些特殊的情况,如在澳大利亚的野生水禽中分离到的H10N7病毒,其HA属于北美谱系,NA接近于日本的水禽病毒,而6个内部基因属于欧亚谱系[3]。广东活禽市场分离的病毒A/Duck/Guangdong/ E1/2012 (H10N8)谱系分析表明,HA属于欧亚谱系,而NA属于北美谱系[4]。
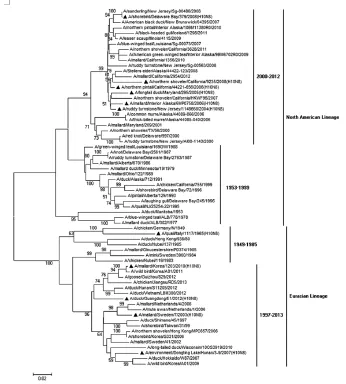
图1全球H10亚型禽流感病毒HA谱系分析(▲为H10N8毒株)
对Influenza Virus Resource中的数据进行统计分析,发现H10亚型的禽流感病毒NA基因包含了N1~N9的9个亚型,所占比例分别为3.40%(N1)、2.68%(N2)、6.17%(N3)、4.57%(N4)、2.21%(N5)、2.86%(N6)、72.23%(N7)、3.70%(N8)、2.19%(N9),H10N7亚型病毒占了绝大部分。H10亚型禽流感病毒的宿主主要是禽类,还包括了水貂(禽源)、猪(H10N5)和人类(2株,H10N7)。
3 中国H10亚型禽流感谱系分布及流行情况
中国的H10亚型禽流感病毒(H10N3、H10N4、H10N5、H10N7、H10N8、H10N9)属于欧亚谱系。对洞庭湖地区H10N8亚型禽流感病毒的进化分析表明,A/environment/DT/Hunan/3-9/07的HA基因属于欧亚谱系的水生禽源病毒,NA基因属于欧亚谱系的禽源病毒,PB2和PA基因与欧亚地区鸭的H5和H7亚型病毒的基因相近,PB1基因与欧洲一些国家的鸭、火鸡、人的H7亚型禽流感相近,NP基因与欧亚谱系的H5N3和H10N5相近,M和NS基因也属于欧亚谱系[5]。广东活禽市场分离的病毒A/Duck/Guangdong/ E1/2012 (H10N8)谱系分析表明,HA属于欧亚谱系,而NA属于北美谱系[4]。
通过监测发现,我国的广东(H10N7、H10N8)、洞庭湖(H10N3、H10N8)、江苏(H10N9、H10N3、H10N?)、湖北(H10N4、H10N5)、广西(H10N?)等一些地区存在某些H10亚型的禽流感病毒[6],大部分呈低致病性。
4 致病性分析
对H10病毒的HA受体结合位点分析表明,其倾向于结合α-2,3-唾液酸受体,属于典型的禽流感病毒特征[7]。
对H10病毒的HA裂解位点分析表明,大部分病毒HA裂解位点处的氨基酸基序为SEITQGRGLF,表明它们具有低致病特性。值得注意的是,一些H10亚型禽流感病毒,即使在HA裂解位点处不存在多个碱性氨基酸,仍然具备对鸡或水貂的高致病性,如A/ turkey/England/384/79 (H10N4)和A/mandarin duck/ Singapore/8058F-72/7/93 (H10N5),虽然在HA裂解位点处只有一个碱性氨基酸(PEIMQGR↓GLF),但其静脉接种致病指数>1.2,属于高致病性禽流感病毒[8]。反之,将病毒A/Mallard/Germany/R2075/2007 (H10N7)的HA裂解位点处引入5个碱性氨基酸,重组突变病毒仍然是低致病性的[9]。这说明裂解位点处的碱性氨基酸数目不是评判H10亚型禽流感病毒致病的唯一因素,如一些病毒的NS基因能够帮助病毒逃避先天免疫应答,提高其致病力[10]。同样是禽源的H10病毒,A/mink/Sweden/3900/84 (H10N4)和A/ chicken/Germany/N/49 (H10N7)对水貂的致病特性也不尽相同[10]。
对湖南洞庭湖分离的A/environment/DT/Hunan/3-9/07 (H10N8)进行致病性试验,表明其对鸡是低致病性的,但能在小鼠的肺脏中高效复制,适应后毒力快速增强[5]。广东活禽市场分离的病毒A/ Duck/Guangdong/E1/2012 (H10N8),HA裂解位点为PEIVQER↓GLF,属于低致病性特征[4]。
A/Duck/Hong Kong/562/79 (H10N9)感染野鸡后,在长期排毒过程中,感染后41天分离病毒与母本病毒的抗原性已经发生了显著的变异(抗原漂移),导致机体先天性免疫失败[11]。
5 结语
动物流感病毒感染人类的现象此前发生过多次,此次江西监测到H10N8是第一次在人体中检出这个病毒。但是,目前H10N8出现大规模流行的可能性不大,因为禽流感病毒进行跨物种传播,即要在人类中大规模传播,还需要发生较大的基因重组或变异才行。此次监测到的H10N8禽流感的基因暂时仍然全部属于禽鸟的基因,所以人传人的机会较低。
目前研究发现,H10N8病毒对氨酸酶类药物比较敏感,如感染者发现早,采用氨酸酶类抗流感病毒药物,病情可得到有效的控制。同时,在避免禽流感病毒感染方面,要做到勤洗手,减少与活禽、病死禽接触,特别是免疫功能低下的病人,要尤其减少或尽可能避免与禽类的接触。
虽然H10N8禽流感引发流行的几率较小,但仍需要我们提高警惕,加强监测和宣传,正确认识、理性看待、解放思想、科学防控。
[1] Tong S, Zhu X, Li Y, et al. New world bats harbor diverse inf l uenza A viruses[J]. PLoS Pathog. 2013, 9(10):e1003657.
[2] Liu S, Ji K, Chen J,et al. Panorama phylogenetic diversity and distribution of Type A inf l uenza virus[J]. PLoS One. 2009,4(3):e5022.
[3] Vijaykrishna D, Deng Y, Su Y C. F, et al. The Recent Establishment of North American H10 Lineage Inf l uenza Viruses in Australian Wild Waterfowl and the Evolution of Australian Avian Inf l uenza Viruses[J]. J. Virol. 2013, 87(18):10182.
[4] Jiao P, Cao L, Yuan R, et al. Complete Genome Sequence of an H10N8 Avian Inf l uenza Virus Isolated from a Live Bird Market in Southern China[J]. J. Virol. 2012, 86(14):7716.
[5] Zhang H, Xu B, Chen Q, et al. Characterization of an H10N8 inf l uenza virus isolated from Dongting lake wetland[J]. Virology Journal. 2011, 8:42.
[6] Peng Y, Xie Z, Liu J, et al. Epidemiological Surveillance of Low Pathogenic Avian Inf l uenza Virus (LPAIV) from Poultry in Guangxi Province, Southern China[J]. PLoS ONE. 2013,8(10): e77132.
[7] Nobusawa E, Aoyama T, Kato H, et al. Comparison of complete amino acid sequences and receptor-binding properties among 13 serotypes of hemagglutinins of inf l uenza A viruses[J]. Virology. 1991, 182(2):475-485.
[8] Wood G W, Banks J, Strong I, et al. An avian inf l uenza virus of H10 subtype that is highly pathogenic for chickens, but lacks multiple basic amino acids at the haemagglutinin cleavage site[J]. Avian Pathology. 1996, 25(4):799-806.
[9] Veitsa J, Webera S, Stecha O, et al. Avian inf l uenza virus hemagglutinins H2, H4, H8, and H14 support a highly pathogenic phenotype[J]. PNAS. 2012, 109(7): 2579–2584.
[10] Zohari S, Metreveli G, Kiss I, et al. Full genome comparison and characterization of avian H10 viruses with different pathogenicity in Mink (Mustela vison) reveals genetic and functional differences in the non-structural gene[J]. Virology Journal. 2010, 7:145.
[11] Humberd J, Boyd K, Webster R G. Emergence of Inf l uenza A Virus Variants after Prolonged Shedding from Pheasants[J]. J. Virol. 2007, 81(8):4044.
Global phylogenetic analysis of H10 subtype avian inf l uenza virus
Jiang Wenming1, Yu Meifang1, Wang Suchun1, Zhang lingni2, Chen Jiming1, Huang Baoxu1
(1.China Animal Health and Epidemiology Center, Qingdao, Shandong 266032;2.Animal Health Inspection Institute of Huangdao district, Qingdao, Shandong 266400)
In this paper, phylogenesis, prevalence and pathogenicity of H10 subtype of avian influenza virus in the world and China were analyzed, by means of Inf l uenza Virus Resource in GenBank and published reports. Globally,H10 subtype viruses are divided into two lineages: North America and Eurasia. It is shown that H10 viruses tend to combine α2, 3-sialic acid receptor by analysis of HA receptor binding site, which belongs to the typical characteristics of avian inf l uenza virus, and that most of the H10 virus with low pathogenic characteristics by analysis of HA cleavage site. Comprehensive analysis indicates that current H10N8 is unlikely to cause a pandemic, but still needs vigilance and monitoring.
avian inf l uenza;H10 subtype;phylogenetic analysis;pathogenicity
S852.65
:A
:1005-944X(2014)02-0056-03
