生物合成Cr2O3纳米颗粒
2014-02-23董国文吴钟海张丽华王仁章
董国文,吴钟海,张丽华,王仁章
(三明学院 资源与化工学院,福建 三明 365004)
生物合成Cr2O3纳米颗粒
董国文,吴钟海,张丽华,王仁章
(三明学院 资源与化工学院,福建 三明 365004)
微生物还原固定铬对Cr(VI)污染环境修复具有重要意义。筛选获得一株Cr(VI)还原菌株XMCr-6,并对其生物还原固定Cr(VI)进行了研究。动力学实验显示Cr(VI)是先还原,然后吸附固定在细胞表面。XPS分析表明铬在细胞表面主要是以三价的形式存在,高分辨透射电镜结合能谱分析进一步证实是形成Cr2O3纳米颗粒。
Cr(VI);生物修复;纳米Cr2O3;废水处理
在工业化进程加快的今天,环境问题日益凸显,特别是重金属铬污染问题越发严重。2012年“毒胶囊事件”使得铬污染及其对人体的危害再度成为公众关注的焦点。铬污染主要是指由Cr (VI)所引起的污染。具有毒性的Cr(VI)污染物不仅对环境、牲畜有毒害作用,对人体也有“三致”作用[1],其毒性约是Cr(III)的100倍[2]。把Cr(VI)还原成Cr(III),不仅是一种有效的解毒方式,而且也是从水环境中去除铬的关键步骤。已有研究发现环境中部分微生物能够在有氧或厌氧的条件下将 Cr(VI)还原成 Cr(III)[3-4],说明微生物在修复Cr(VI)污染的水体具有巨大的潜力。传统的物理化学方法如还原沉淀、离子交换和反渗透用来处理Cr(VI)的污染使其达标排放,意味着高运行成本,寻求一种高效便捷的铬污染治理方法显得尤为重要。
1 实验材料与方法
1.1 材料和试剂
菌株XMCr-6(本实验室保存),重铬酸钾(AR,国药集团化学试剂有限公司),二苯基碳酰二肼(AR,国药集团化学试剂有限公司),丙酮(AR,国药集团化学试剂有限公司),酵母粉(BR,OXOID),胰蛋白胨(BR,国药集团化学上海化学试剂公司)。LB培养基:10 g·L-1胰蛋白胨,5.0 g·L-1酵母提取物和 5.0 g·L-1氯化钠。
1.2 微生物还原Cr(VI)
菌株XMCr-6过夜培养,然后在4°C低温条件下离心获得完整细胞,完整细胞用无菌磷酸盐缓冲液(PBS,0.2 mol·L-1,pH=7.0)清洗3次,并重新悬浮,最终浓度为0.1 g·mL-1(湿重)。加入Cr(VI)并使终浓度为100 mg·L-1。还原反应在离心管中进行,28°C条件下连续震荡12 h(150 r·min-1)。细胞用PBS清洗3次,冷冻并低温(-50°C)干燥(EYELA FD-1000,Japan)。
1.3 胞外Cr2O3纳米颗粒的表征
冷冻干燥样品用于光电子能谱XPS分析(PHI,QUANTUM 2000,USA)。用于透射电镜(TEM)的样品用PBS清洗后用2.5%戊二醛在4°C固定2 h后,用移液器吸取5 μL溶液点滴到铜网的碳膜上,放置2 h用于TEM-EDX(Tecnai F30)表征。
1.4 测试方法
总铬采用AAS测试 (TAS-986,北京普析通用),Cr(VI)采用1,5二苯卡巴肼分光光度法测试(TU1900,北京普析)。
2 结果与讨论
2.1 不同生长条件对菌株XMCr-6还原Cr(VI)的影响
经过对菌株XMCr-6进行驯化,能够在48 h内还原100 mg·L-1的Cr(VI),同时考察了不同温度、pH和Cr(VI)初始浓度对其还原Cr(VI)的效果,结果见图1~3。
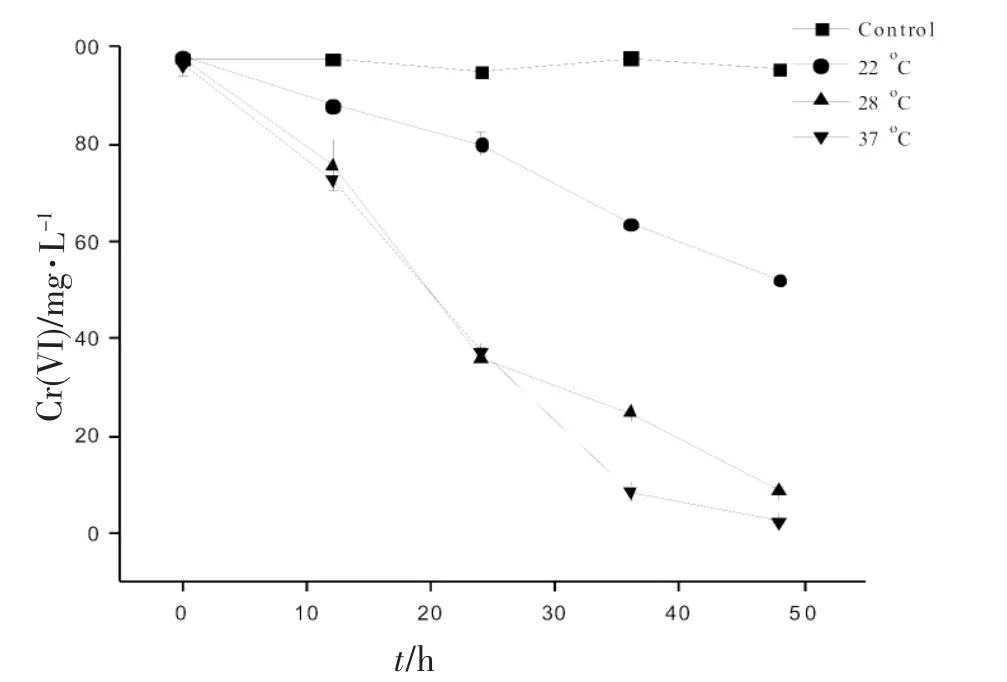
图1温度对菌株XMCr-6还原Cr(VI)的影响
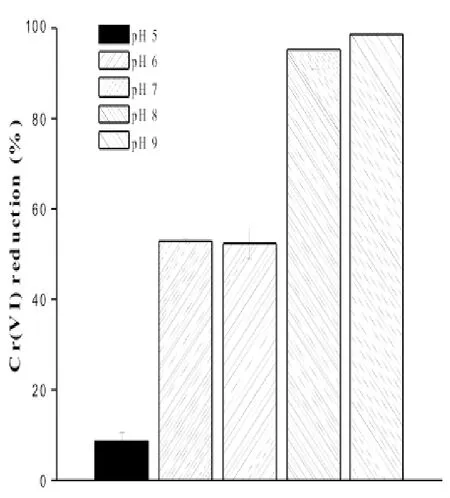
图2 pH对菌株XMCr-6还原Cr(VI)的影响
分别考察了菌株XMCr-6在温度为22,28,37°C条件下对Cr(VI)的还原情况,发现菌株XMCr-6 在3种温度条件下分别能还原46%,91%和97%的Cr(VI)(100 mg·L-1)。还原能力在温度为28和37之间差距较小,温度在22°C时还原能力有明显抑制。菌株XMCr-6在很广泛的pH(5~9)范围内能还原Cr(VI),最大的还原率出现在pH=8~9,但pH=5时,Cr(VI)的还原几乎停止。还考察了不同Cr(VI)浓度对菌株XMCr-6还原能力的影响,发现菌株XMCr-6在36和48 h内能分别完全还原50和100 mg·L-1Cr(VI)。在Cr(VI)浓度为150和200 mg·L-1时,菌株XMCr-6在84 h内分别能还原94%和70% 的Cr(VI)。
2.2 生物吸附还原机制
微生物还原Cr(VI)的机制有多种,还原过程也比较复杂,为了弄清楚菌株XMCr-6还原Cr(VI)的机制,做了菌体还原Cr(VI)的动力学实验。从图4中可知,Cr(VI)在pH=7的情况下没有吸附到细胞上。然而,当pH调到2时,立刻有大量(73%)的Cr(VI)被吸附到细胞上。先前生长条件实验中细胞均在pH=7的条件下还原Cr(VI)。并且已有报道酶促反应引起的Cr(VI)还原是在pH=7.0~7.5的条件下发生的,而非生物还原是在较低pH条件下(pH=2.0~3.0)[5]。这是由于Cr(VI)阴离子是带负电荷,在低pH条件下有利于吸附到细胞或者其他生物分子上。与此同时,动力学实验结果显示Cr(VI)的还原和Cr(III)的固定不是同步的(表1),还原反应3 h时,有40.4%的Cr(VI)被还原,然而只有71.4%的Cr (III)被固定。从3 h到15 h,Cr(III)的固定从71.4%上升到95.6%,说明Cr(VI)的还原要快于Cr(III)的固定。由此说明是Cr(VI)先还原,然后还原的Cr(III)与细胞吸附并被固定在细胞表面。

图3 Cr(VI)浓度对菌株XMCr-6还原Cr(VI)的影响

图 4 pH值对Cr(VI)吸附的影响

表1 不同时间铬的还原率和固定率
2.3 细胞表面纳米Cr2O3颗粒表征
Cr(VI)还原后细胞上铬的可能化学价态通过XPS来分析(图5),数据显示细胞表面的铬有两个明显的峰值:586.5 eV(Cr 2p1/2)和 577.8 eV(Cr 2p3/2),而标准的Cr2O3的峰为:Cr 2p1/2 586.0 eV 和 Cr 2p3/2 576.2 eV[6]。与标准的Cr2O3的峰值比较,证实细胞表面的铬是Cr(III)。通过TEM观察细胞表面,发现在细胞表面及细胞与细胞之间存在大量粒径在4 nm的颗粒(图6a),随后的EDX能谱显示这些沉积物包含铬(图6)。这些沉淀物主要是球形的和少量无定型的纳米颗粒。此外,高分辨透射电镜(HRTEM)已经有用来表征Cr(III)的纳米颗粒[7],本实验中用HRTEM来表征纳米颗粒(图6b),结果显示晶格间距是0.246 nm,这是Cr2O3的110面[8]。结合XPS的结果,可以证实形成的是Cr2O3纳米颗粒。
以前研究结果中很少有通过微生物还原形成球形的Cr2O3纳米颗粒。本研究中,Cr2O3纳米颗粒被菌株XMCr-6生物合成,主要是沉淀在细胞表面。Cheung报道了其他一些不同的观察结果,铬的聚集物存在于Bacillus megaterium TKW3的细胞膜内[9],而Daulton应用TEM-EDX发现密集的聚合物沉淀在整个细胞表面[10]。

图5 细胞表面纳米颗粒XPS表征

图6 细胞外纳米颗粒的TEM-EDX和HRTEM表征
3 结论
自然界中许多菌种具有Cr(VI)还原能力,因而用微生物法治理铬污染已受到人们的广泛认可。然而,大部分报道都集中在Cr(VI)的还原过程而很少关注形成Cr(III)的最终产物[11-12],其实Cr(III)的最终产物才决定铬的生物有效性。微生物还原Cr(VI)的最终产物一般包括可溶和不溶的Cr(III)[13]。如有些微生物能够将Cr(VI)还原为不溶的氢氧化物[9,14]、与有机配体形成可溶的有机-Cr(III)复合物[15]。Cr(III)的有机复合物或沉淀物对细胞的损伤是最小的[16],这可能是微生物为了保护自己而进行的一种解毒机制。本实验对菌株XMCr-6还原解毒Cr(VI)的特性和机理进行了研究与探讨,发现菌株XMCr-6能够在很宽的温度(22~37℃)和pH(6~9)范围内生长,48h内能完全还原100 mg·L-1的Cr(VI);菌株XMCr-6还原Cr(VI)的机制是先还原Cr(VI),逐步吸附沉淀到细胞上,最终形成Cr2O3纳米颗粒。微生物将Cr(VI)转化为Cr(III)的沉淀物而去除,被认为是生物解毒的一种机制,也是Cr(VI)污染物去除的一种彻底解决含铬有毒物的环保新技术,其结论可为含铬废水、废渣生物处理提供理论依据。
[1]ZHITKOVICH A.Chromiumindrinkingwater:sources,metabolism,andcancerrisks[J].ChemicalResearchin Toxicology,2011,24(10):1617-1629.
[2]CHEUNG K H,GU J D.Mechanism of hexavalent chromium detoxification by microorganisms and bioremediation application potential:a review[J].International Biodeterioration&Biodegradation,2007,59(1):8-15.
[3]ZHAO C Q,YANG Q H,CHEN W Y,et al.Removal of hexavalent chromium in tannery wastewater by Bacillus cereus [J].Canadian Journal of Microbiology,2012,58(1):23-28.
[4]THACKER U,PARIKH R,SHOUCHE Y,et al.Reduction of chromate by cell-free extract of Brucella sp isolated from Cr(VI)contaminated sites[J].Bioresource Technology,2007,98(8):1541-1547.
[5]DAS S K,GUHA A K.Biosorption of hexavalent chromium by Termitomyces clypeatus biomass:kinetics and transmission electron microscopic study[J].Journal of Hazardous Materials,2009,167(1):685-691.
[6]MANNING B A,KISER J R,KWON H,et al.Spectroscopic investigation of Cr(III)-and Cr(VI)-treated nanoscale zerovalent iron[J].Environmental Science&Technology,2007,41(2):586-592.
[7]DAS S K,SHOME I,GUHA A K.Surface functionalization of Aspergillus versicolor mycelia:in situ fabrication of cadmium sulphidenanoparticles and removal of cadmium ions from aqueous solution[J].RSC Advances,2012,2(7):3000-3007.
[8]PANDA N R,ACHARYA B S,NAYAK P,et al.Role of Cr3+ions on superexchange coupling in alpha-Fe2O3nanoparticles[J].Physica B-Condensed Matter,2012,407(14):2716-2720.
[9]CHEUNG K H,LA H YI,GU J D.Membrane-associated hexavalent chromium reductase of Bacillus megatelium TKW3 with induced expression[J].Journal of Microbiology and Biotechnology,2006,16(6):855-862.
[10]DAULTON T L,LITTLE B J,LOWE K,et al.Electron energy loss spectroscopy techniques for the study of microbial chromium(VI)reduction[J].Journal of Microbiological Methods,2002,50(1):39-54.
[11]DAS S K,MUKHERJEE M,GUHA A K.Interaction of chromium with resistant strain Aspergillus versicolor:investigation with atomic force microscopy and other physical studies[J].Langmuir,2008,24(16):8643-8650.
[12]PARK D,YUN Y S,HYE JO J,et al.Mechanism of hexavalent chromium removal by dead fungal biomass of Aspergillus niger[J].Water Research,2005,39(4):533-540.
[13]CHENG Y J,YAN F B,HUANG F,et al.Bioremediation of Cr(VI)and Immobilization as Cr(III)by Ochrobactrum anthropi[J].Environmental Science&Technology,2010,44(16):6357-6363.
[14]LI B,PAN D M,ZHENG J S,et al.Microscopic investigations of the Cr(VI)uptake mechanism of living Ochrobactrum anthropi[J].Langmuir,2008,24(17):9630-9635.
[15]PUZON G J,ROBERTS A G,KRAMER D M,et al.Formation of soluble organo-chromium(III)complexes after chromate reduction in the presence of cellular organics[J].Environmental Science&Technology,2005,39(8):2811-2817.
[16]BENCHEIKH-LATMANI R,OBRAZTSOVA A,MACKEY M R,et al.Toxicity of Cr(III)to Shewanella sp strain MR-4 during Cr(VI)reduction[J].Environmental Science&Technology,2007,41(1):214-220.
(责任编辑:朱联九)
Biosynthesis of Cr2O3Nanoparticles by Strain XMCr-6
DONG Guo-wen,WU Zhong-hai,ZHANG Li-hua,WANG Ren-zhang
(College of Resource and Chemical Engineering,Sanming University,Sanming 365004,China)
A basic understanding related to the immobilization of chromium by bacteria is essential for chromate pollutant remediation in the environment.In this work,the Cr(VI)-immobilization process by strain XMCr-6 was studied. The kinetics experiment result showed that Cr(VI)reduction and Cr(III)immobilization happened asynchronously,the binding sequence of Cr(III)on the cell surface was bound after reduction.X-ray photoelectron spectroscopy(XPS)analysis revealed that the chromium accumulated on bacteria were mostly in Cr(III)states.Scanning electron microscopy (SEM)observations showed that noticeable Cr(Ill)precipitates were accumulated on bacterial surfaces.HRTEM image coupled with energy-dispersive X-ray spectroscopy showed that the Cr2O3nanoparticles were obtained during the Cr(VI) reduction process.
Cr(VI);Bioremediation;Cr2O3Nanoparticles;waste treatment.
X172
A
1673-4343(2014)04-0001-05
10.14098/j.cn35-1288/z.2014.04.001
2013-12-08
国家自然科学基金(41301346);福建省科技厅重点项目(2012Y0061);福建省大学生创新计划项目(ZL1125/CS);2011洁净煤气化技术协同创新中心项目
董国文,男,安徽宿松人,博士,讲师。研究方向:污染环境生物修复。
