核桃乳(露)饮品中花生、大豆成分的PCR检测方法
2014-02-21魏晓璐张阿梅夏雪山
魏晓璐,黄 鑫,冯 悦,张阿梅,夏雪山,刘 丽
(昆明理工大学生命科学与技术学院,云南昆明650500)
核桃主要由脂肪和蛋白质组成[1],核桃蛋白因具有很高的营养价值而被越来越多的应用到食品生产中。核桃乳(露)饮料凭借其纯天然的植物蛋白原材料、不失核桃仁原有营养成份、增强大脑记忆功能[2]等特点为大众所喜爱。不法商家为谋取私利,采用价格低廉的花生或大豆为原材料仿造核桃乳(露)饮料并以低价争抢市场。这种食品掺假行为严重侵害了消费者的合法权益,不仅欺骗了消费者,也会危害对花生和大豆过敏的消费者。现行植物蛋白饮料卫生标准(GB 16322-2003)注明以核桃仁以外的原料制成的饮品不符合核桃乳(露)定义标准[3]。植物蛋白饮料-核桃乳(露)执行标准(QB/T 2301-1997)以物理和化学方法对核桃乳(露)的感官、净含量和各种理化指标进行检测[4],但无法对其中是否掺入其他植物蛋白做出判断。为保证核桃乳(露)饮品质量和保护消费者权益,有必要建立检测核桃乳(露)饮品中掺杂其他植物蛋白的方法。
目前国内外对食品中植物成分残留以及植物蛋白的检测研究主要集中在ELISA、普通PCR和实时荧光定量PCR等方面[5-11],在食品鉴伪相关文献报道[12-18]中,没有对核桃乳(露)中掺入花生或大豆进行快速鉴别的有效方法。本研究针对花生特异性过敏基因Arah 1以及大豆特异性过敏基因Gly m Bd28 K设计引物,建立了核桃乳(露)中花生、大豆成分的PCR检测方法。旨在为核桃乳(露)中掺入大豆、花生成分的检测提供快速、简便、准确的方法依据,为保护消费者权益、规范保健食品研制和生产经营提供有力的技术支持和技术保障。
1 材料与方法
1.1 材料与仪器
黄大豆、青大豆、黑大豆、黑小豆、扁豆、绿豆、蚕豆、白芸豆、红芸豆、豌豆、麻豇豆、豇豆、红小豆、赤豆、腰果、核桃、花生、燕麦、香蕉、白芝麻、榛子、碧根果、苹果、开心果;瓜子;黑芝麻;杏仁;松子市售不同品牌核桃乳(露)饮品22种 购自当地超市。
台式高速冷冻离心机 购自德国Eppendorf公司;PCR仪 购自美国Applied Biosystems公司;电泳仪 购自美国Biorad公司;凝胶成像仪 购自美国UVP公司;500bp ladder DNA marker、2000bp ladder DNA marker 购自上海生工生物工程有限公司;2×Prem ix Taq 购自TAKARA生物有限公司;离心柱型植物基因组DNA提取试剂盒(目录号:DP305) 购自天根公司。

表1 PCR引物序列Table1 Sequence of PCR primer

表2 PCR扩增反应条件Table2 PCR reaction condition
1.2 实验方法
1.2.1 DNA的提取 固体样品经液氮研磨成粉末后取100mg,液体样品经冷冻干燥后取粉末100mg,分别加入1.5m L离心管中。使用天根公司离心柱型植物基因组提取试剂盒提取DNA。
1.2.2 引物设计 根据不同物种具有各自特异的基因,从Genbank数据库下载花生过敏基因(Arah 1)序列、大豆过敏基因(Gly m Bd28 K)序列。通过Mega软件对序列进行比对,利用Oligo软件,设计一对花生特异性引物Arah 1-F/R、一对大豆特异性引物Bd 28K-F/R。植物通用引物CP 03、核桃特异性引物WAL-F/R参照文献[5]。本实验所有引物序列见表1。引物委托华大基因有限公司合成。
1.2.3 PCR扩增及产物检测 PCR扩增总体积为25μL,反应体系如下:12.5μL 2×Prem ix Taq (TaKaRa)、0.5μL引物(上下游各0.5μL)、1.0μL模板,补双蒸水到25μL。PCR扩增反应条件见表2。
取6μL PCR产物,在已加入溴化乙锭的1.5%琼脂糖凝胶和1×TAE缓冲液中电泳20min(120V)。以500bp ladder DNA maker或2000bp ladder DNA maker作为分子量对照,于凝胶成像仪下观察结果。
2 结果与分析
2.1 核桃乳(露)中DNA提取效率
核桃乳(露)中的DNA经过高温、高压、灭菌等多道加工工艺,很难直接检测出DNA提取是否成功。而通过检测植物中叶绿体DNA片段,可以判定DNA是否符合PCR扩增标准,从而避免检测结果的假阴性。
本研究采用文献报道的植物CP 03通用引物[5],对各种品牌核桃乳(露)中DNA的提取质量和提取效率进行了PCR检测。扩增结果表明:除阴性对照外,被检测的所有样品均能扩增出123bp片段大小的条带,如图1。说明所有样品DNA均符合PCR扩增的要求。
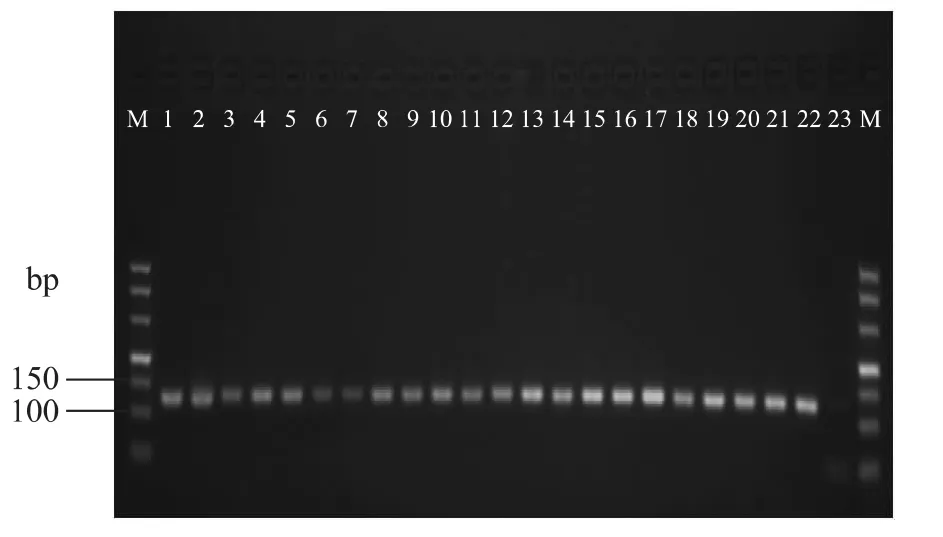
图1 CP 03对不同核桃乳(露)样品DNA扩增的结果Fig.1 The PCR result of primer CP 03 in differentwalnutmilk materials
2.2 引物的特异性
以市面上一些常见坚果、水果与大豆、花生、核桃的DNA为模板,分别用Arah1、Bd28 K引物进行PCR扩增。扩增结果表明:Arah 1引物仅对花生DNA扩增阳性,如图2;Bd28 K引物仅对大豆DNA扩增阳性,如图3、图4。
2.3 检测方法的灵敏度
以花生DNA为标准添加品,按比例添加至核桃DNA中,获得花生含量分别为10%、1%、0.1%、0.01%的系列稀释品,Arah1引物PCR扩增结果如图5。可见随着花生成分浓度的降低,条带逐渐减弱,Arah 1引物最低检测限达到1%。大豆引物灵敏度检测方法为,以大豆DNA为标准添加品,按上述方法进行稀释。可见Bd28 K引物最低检测限达到0.1%,PCR结果如图6。
2.4 核桃乳(露)中花生、大豆成分的检测
在对所有核桃乳(露)样品进行了植物成分DNA检测后(图1),分别进行了核桃、花生、大豆成分的PCR扩增检测。

图2 Arah 1引物对不同植物DNA扩增的结果Fig.2 The specificity test result of primer Arah 1 in different plants

图3 Bd28 K引物对常见豆科植物DNA扩增的结果Fig.3 The specificity test result of primer Bd28 K in common leguminosae

图4 Bd28 K引物对常见非豆科植物DNA扩增的结果Fig.4 The specificity test result of primer Bd28 K in non-leguminosae plants
结果表明:有四种样品(5、6、7、21)未扩增出核桃目的片段,如图7。但用植物通用引物鉴定饮品DNA质量时结果呈阳性,说明已提取出适合PCR扩增的DNA,可能由于其核桃成分含量较低,低于检测灵敏度以下,或根本不含核桃成分DNA所至。

图5 Arah 1引物灵敏度检测结果Fig.5 The sensitivity test of primer Arah 1

图6 Bd28 K引物灵敏度检测结果Fig.6 The sensitivity test of primer Bd28 K
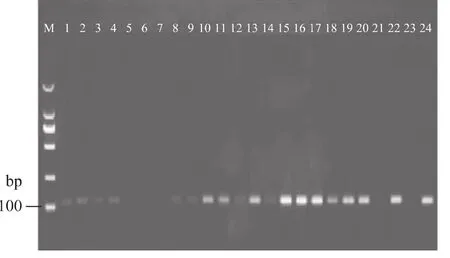
图7 不同核桃乳(露)样品中核桃成分检测结果Fig.7 Detection of walnut in differentwalnutmilk materials
在所有被检测的22种核桃乳(露)中,有4种(样品1、5、18、21)标明含有花生成分。4种标注含有花生成分的样品均能扩增出花生目的条带,与产品中所标识的成分完全一致。另有3种(样品8、12、14)未标明含花生成分的样品也扩增出花生目的条带,说明也含有花生成分,为核桃与花生的混合饮品,与产品中所标识的成分不符,表明掺假,如图8。
在所有被检测的22种核桃乳(露)中,有1种(样品11)标明含有大豆成分,但未扩增出大豆目的条带,可能不含大豆成分或含量较少。另2种(样品1、22)未标注含有大豆成分的样品也扩增出大豆目的条带,说明含有大豆成分,为核桃与大豆的混合饮品,与产品中所标识的成分不符,表明掺假,如图9。

图8 不同核桃乳(露)样品中花生成分检测结果Fig.8 Detection of peanut in differentwalnutmilk materials

图9 不同核桃乳(露)样品中大豆成分检测结果Fig.9 Detection of soybean in differentwalnutmilk materials
3 结论与讨论
核桃乳(露)在加工过程中经过高温加热等工艺,可能导致大量蛋白质变性,使得蛋白水平的检测困难且灵敏度不高。但PCR技术具有高效、灵敏、操作简便的优点,在加工食品尤其是深加工食品的有效成分鉴定方面具有重要作用[19],它检测的对象是比蛋白质稳定的DNA,在深加工食品中仍有DNA的存在。而且PCR方法较ELISA方法更为准确,同时避免了对大量抗体的需求。因此,PCR检测法更适用于深加工食品的检测[14,20]。
在所有被检测的22种核桃乳(露)中有3种未标明含有花生的样品检测出花生成分、2种未标明含有大豆的样品检测出大豆成分,与产品标识不符。有2种品牌核桃乳(露)未检测到原材料核桃成分,可见被其他植物成分取代。这些掺假行为损害了消费者的利益,扰乱了饮品市场,因此,建立快速、灵敏的核桃乳(露)中掺入花生、大豆成分的检测方法,不但能可靠鉴别核桃乳(露)中的花生、大豆成分,同时也可将此方法作为核桃乳(露)饮品中其他植物源成分检测的依据。本研究通过对植物叶绿体基因的检测来判断是否提取出DNA,从而可有效防止假阴性结果的发生,保证检测结果的准确性和可靠性。研究结果表明该方法提取的DNA效率高、纯度好,Arah 1和Bd28 K引物灵敏度分别达1%和0.1%,适于PCR扩增。可作为核桃乳(露)中掺入花生、大豆成分检测的有效方法,也可为其他与食品鉴伪相关的方法研究提供可靠参考依据。
[1]Sze-Tao KWC,Sathe SK.Walnuts(Juglans regia L): proximate composition,protein solubility,protein amino acid composition and protein in vitro digestibility[J].Journal of the Science of Food and Agriculture,2000,80(9):1393-1401.
[2]Haider S,Batool Z,Tabassum S,et al.Effects of walnuts (Juglans regia)on learning andmemory functions[J].Plant Foods for Human Nutrition,2011,66(4):335-340.
[3]周玉宇,吕兵.核桃乳饮料的研制[J].食品科技,2006,31 (2):69-72.
[4]于明,何伟忠,吴新凤.鲜核桃乳生产工艺研究[J].新疆农业科学,2010,47(10):2117-2120.
[5]Yano T,Sakai Y,Uchida K,et al.Detection ofwalnut residues in processed foods by polymerase chain reaction[J].Bioscience Biotechnology Biochemistry,2007,71(7):1793-1796.
[6]Wang H,Yuan F,Wu Y,et al.Detection of allergen walnut component in food by an improved real-time PCR method[J].Journal of Food Protection®,2009,72(11):2433-2435.
[7]Hird H,Lloyd J,Goodier R,et al.Detection of peanut using real-time polymerase chain reaction[J].European Food Research and Technology,2003,217(3):265-268.
[8]Platteau C,De Loose M,De Meulenaer B,et al.Detection of allergenic ingredients using real-time PCR:a case study on hazelnut(Corylus avellena)and soy(Glycinemax)[J].Journal of Agricultural and Food Chemistry,2011,59(20):10803-10814.
[9]Pedersen MH,Holzhauser T,Bisson C,et al.Soybean allergen detectionmethods-a comparison study[J].Molecular Nutrition&Food Research,2008,52(12):1486-1496.
[10]Doi H,Touhata Y,Shibata H,et al.Reliable enzyme-linked immunosorbent assay for the determination of walnut proteins in processed foods[J].Journal of Agricultural and Food Chemistry,2008,56(17):7625-7630.
[11]Ortola-Vidal A,Schnerr H,Rojmyr M,et al.Quantitative identification of plant genera in food products using PCR and Pyrosequencing® technology[J].Food Control,2007,18(8): 921-927.
[12]Reid LM,O’Donnell CP,Downey G.Recent technological advances for the determination of food authenticity[J].Trends in Food Science&Technology,2006,17(7):344-353.
[13]Tanabe S,Miyauchi E,Muneshige A,et al.PCR method of detecting pork in foods for verifying allergen labeling and for identifying hidden pork ingredients in processed foods[J].Bioscience Biotechnology Biochemistry,2007,71(7):166-1667.
[14]李富威,高琴,张舒亚,等.实时荧光PCR方法在食品真伪辨别中的应用[J].食品工业科技,2012,33(14):367-370.
[15]郭云霞,包建强,张舒亚,等.食品中鲨鱼源性成分真实性PCR鉴别研究[J].食品工业科技,2011,32(10):421-42.
[16]陈颖,钱增敏,徐宝梁,等.保健品中牛羊源性成分的PCR检测[J].食品科学,2004,25(10):215-218.
[17]潘海云,赵文秀,汪之和,等.基于物种特异性PCR对海鳗鱼糜掺假检测技术的研究[J].食品工业科技,2012,33 (13):325-326.
[18]岳巧云,陈定虎,伍朝晖,等.实时荧光PCR在鉴别奶粉中掺入大豆成分的应用研究[J].食品科学,2009(12): 190-193.
[19]刘辉,杨利平,张滨.PCR及其改进技术在食品检测中的应用[J].食品与机械,2008,24(4):166-169.
[20]张霞,张海英,刘培,等.定量检测食品中榛果过敏原成分[J].食品研究与开发,2010,31(12):140-143.
