急性脑梗死后炎症因子的动态变化及其与神经功能的相关性研究
2014-02-14曹红元刘雨辉李惠允石倩千陈东万姚秀卿严家川许志强周华东王延江
曹红元,刘雨辉,李惠允,石倩千,易 旭,陈东万,王 鑫,胥 娟,姚秀卿,严家川,王 琳,许志强,周华东,王延江
脑梗死(cerebral infarction,CI)是多种原因引起的血管狭窄或闭塞,导致局部脑组织血液供应障碍,引起缺血、缺氧,致使脑组织坏死的一组脑血管疾病[1]。全国每年新发脑卒中约200万人,脑梗死占全部卒中的70%,是导致老年人死亡和残疾的主要疾病,给家庭和社会带来沉重负担。
脑梗死发生后,会经历如下几个阶段的病理生理变化:神经兴奋性毒性期、缺血半暗带去极化期、炎症反应期和细胞程序化凋亡期[2]。脑梗死发生后的炎症反应是梗死区和缺血半暗带区神经元损伤的重要机制之一[3]。但炎症反应水平和神经功能缺损的相关性目前尚不完全清楚。白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)和 γ-干扰素(IFN-γ)是参与脑内炎症反应的主要因子。本研究旨在探讨急性脑梗死患者血清IL-1β、IL-6、TNF-α和IFN-γ在卒中后不同时点的变化特点,以及入院时血清炎症因子水平与卒中严重程度和14 d后神经功能的相关性,为脑梗死的预后判断提供依据。
1 对象和方法
1.1 研究对象 选取2012年5月—2013年10月治疗的35例发病24 h以内的脑梗死患者(观察组),所有病例均符合全国第四届脑血管病会议通过的急性脑梗死诊断标准,并经 CT或 MRI证实[4-5]。对照组选择同期在体检中心年龄与性别匹配的查体人员。排除标准:①1个月内发生过急性或慢性感染性疾病者;②恶性肿瘤患者;③自身免疫性疾病患者;④近期或长期服用非甾体类抗炎药者;⑤慢性肝炎、肾炎及严重肝肾功能不全者。
观察组35例,其中男23例,女12例,平均年龄63.4岁,高胆固醇血症占25.71%(9/35),高血压病31.43%(11/35),糖尿病22.86%(8/35)。对照组43例,男26例,女17例,平均年龄64.4岁,其中高胆固醇血症占 25.58%(11/43),高血压病44.19%(19/43),糖尿病20.93%(9/43)。两组在性别、年龄和血管危险因素(高胆固醇血症、高血压病和糖尿病)等方面无显著差异(P>0.05),具有可比性。
1.2 临床评估和治疗 所有患者入院后,采集病史、共患病、用药等情况,物理查体,行CT或MRI检查,采集空腹血液,检查血脂、血糖、同型半胱氨酸、肝肾功能、凝血功能。在神经功能评估方面,所有患者在入院时和发病后14 d采用NIHSS量表和Barthel指数量表对神经功能进行评分。所有患者的评分均由经过培训的高年资神经内科住院医生完成。入院后的治疗,按照中华医学会神经病学分会脑血管病学组制定的《中国急性缺血性脑血管病诊治指南(2010)》进行。
1.3 血液收集和炎症因子检测 所有患者分别在入院时和发病后3、7、14 d时抽取空腹静脉血,分离血清于-80℃保存备用。采用酶联免疫吸附测定法(ELISA)检测血清中 IL-1β、IL-6、TNF-α 和 IFN-γ 水平。检测试剂盒均购于北京四正柏科技有限公司,按照试剂盒说明书进行操作。采用酶标仪(BioTek,USA),在450 nm读取吸光度,依据标准曲线将吸光度转换成pg/ml。
1.4 统计分析 两组均数比较采用两独立样本t检验,炎症因子与NIHSS评分以及Barthel指数相关性分析采用Spearman相关分析,并校正年龄、性别和共患病。统计分析采用SPSS 18.0软件。α=0.05为检验水准。
2 结果
2.1 急性脑梗死患者血清炎症因子的变化 观察组在入院时、卒中后3、7和14 d血清 IL-1β、IL-6、TNF-α和IFN-γ水平均高于对照组,并存在统计学差异(P<0.05,P<0.01)。卒中后各时点 TNF-α、IFN-γ、IL-1β和IL-6水平无统计学差异(P>0.05),但均于卒中后14 d达到最高水平,见表1。
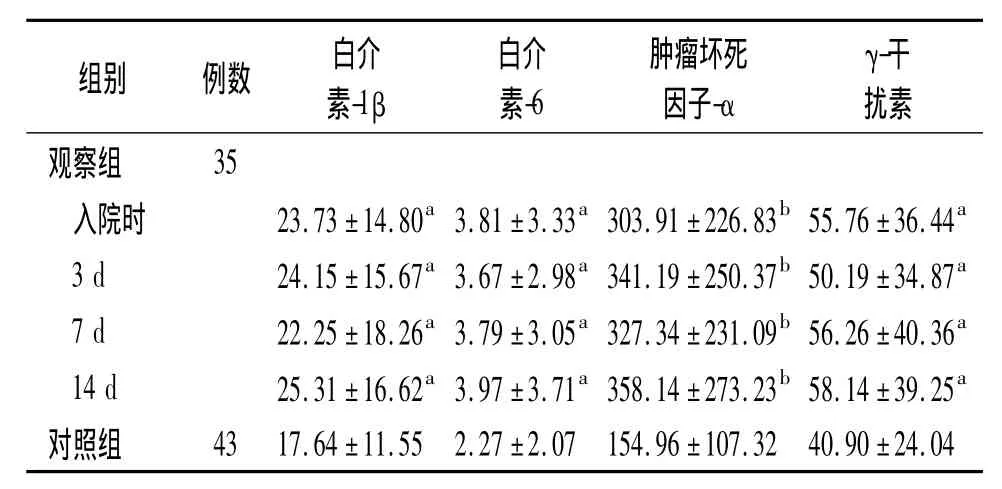
表1 观察组及对照组血清炎症因子的变化(x ± s,pg/ml)
2.2 卒中后血清炎症因子水平与入院时卒中严重度的相关性 入院时观察组NIHSS评分为5.9±5.1,Barthel指数为60.6±29.2。血清IL-6水平与入院时NIHSS评分呈正相关,与Barthel指数无相关性。入院时血清IL-1β、TNF-α和IFN-γ水平与入院时的NIHSS和Barthel无相关性,见表2。
2.3 卒中后血清炎症因子水平与发病14 d神经功能的相关性 发病14 d观察组NIHSS评分为3.2±3.6,Barthel指数为73.9±29.3。入院时血清IL-1β、IL-6水平与发病14 d时的NIHSS评分呈正相关,与Barthel评分呈负相关。入院时血清TNF-α、IFN-γ水平与发病14d时的NIHSS和Barthel评分均无相关性,见表3。
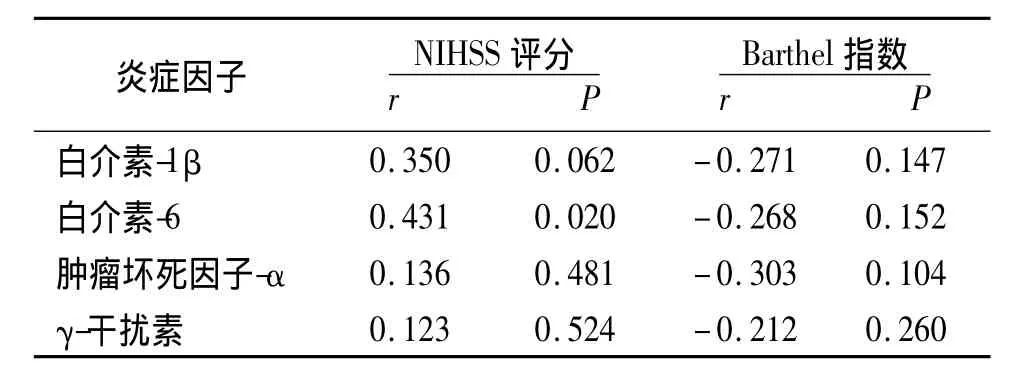
表2 观察组入院时炎症因子水平与神经功能评分的相关性分析
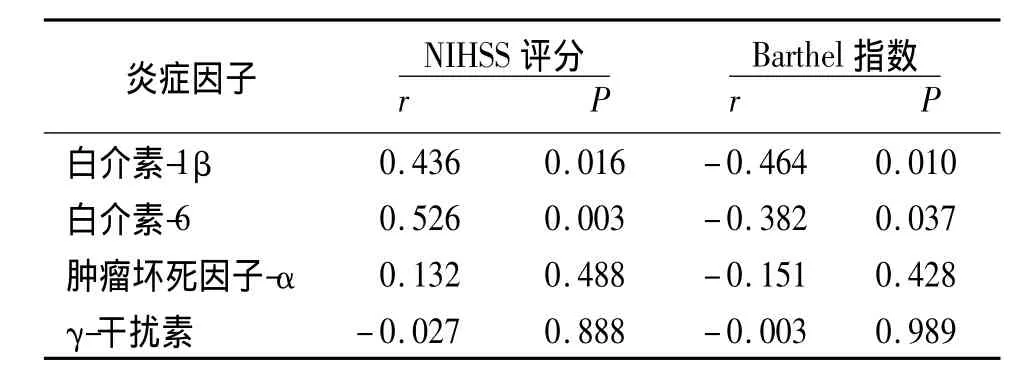
表3 观察组入院时炎症因子水平与发病14 d神经功能评分的相关性分析
3 讨论
近年来,随着人们对脑梗死病理机制的不断深入研究,认识到脑缺血早期引起的炎性反应是中心梗死区和周围缺血半暗带神经元损伤的重要机制之一。脑梗死发生后,炎症反应被激活。参与炎症反应的细胞主要有中性粒细胞、巨噬细胞、淋巴细胞和小胶质细胞等,所释放的炎性介质主要包括白介素类(IL-1、IL-6、IL-8、IL-10)、TNF-α 和 IFN-γ 等[6]。脑梗死组织炎症因子的释放及随后引发的炎症级联反应加重脑组织的损伤。因此,探讨炎症因子与脑梗死后神经功能缺损的关系,对脑梗死的早期治疗和预后判断具有重要价值。
IL-1是最早发现的神经肽细胞因子之一,在血浆和组织液中主要以IL-1β的形式存在,通过促白细胞与内皮细胞黏附而激发炎症反应,对中枢神经系统的损伤主要是通过诱导细胞产生神经毒性因子导致神经元死亡[7]。国外有研究表明,针对大鼠的永久性或短暂性大脑中动脉血流阻断研究显示可诱导IL-1β表达[8]。而在脑室内或外周注射人重组的IL-1受体拮抗剂可减少永久性的大脑中动脉闭塞模型大鼠的脑梗死神经功能缺损症状,减少神经元的死亡[9]。目前有部分临床研究显示IL-1β在脑梗死后急性期有升高表现,提示可能参与急性脑梗死的炎症反应[10-12]。本项研究也得到相同结论。在进行与神经功能评分的相关性分析时发现,入院时IL-1β水平与卒中严重度(入院时神经功能评分)无相关性,但与卒中预后(发病14 d时的神经功能评分)相关,提示24 h内的IL-1β水平对疾病的预后存在一定的关系。
IL-6在中枢神经系统主要由星形胶质细胞和小胶质细胞合成和分泌,正常情况下含量极少,但生物活性极高,对神经系统和造血系统具有广泛作用。当前研究显示,IL-6对神经系统具有保护性和损害性的双重作用:一方面,IL-6可减轻脑梗死后的神经损伤[13],另一方面,IL-6作为一种重要的炎症因子,在梗死区以及缺血半暗带的过度表达可能参与神经组织的继发损伤[14]。本项研究显示观察组IL-6水平较对照组增高,与当前研究一致。且入院时IL-6水平与卒中严重度(入院时NIHSS评分)和卒中预后(发病后14 d NIHSS评分与Barthel指数)相关,提示发病24 h内的IL-6水平与疾病的预后存在一定的关系。
TNF-α是一种前炎性细胞因子,脑内存在Ⅰ型、Ⅱ型以及可溶性TNFR三种TNF的受体。当脑组织缺血缺氧时,TNF-α在颅内大量表达,其在脑梗死的发病以及病理过程中通过多种途径发挥重要的神经毒性作用。本项研究显示血清TNF-α水平在发病后即明显增高,并在14 d时达到高峰,这与当前的国内外研究结果一致。同时,国外部分研究表明,脑梗死后TNF-α水平与病情的严重程度呈正相关,但本项研究显示发病后TNF-α水平与发病后的神经功能评分以及14 d时的神经功能评分均无相关性,此与先前的部分研究结果不相符,尚需大样本量的临床研究来证实[15-17]。
IFN-γ产生于NK细胞和T细胞。研究表明,正常脑组织中并不表达IFN-γ,而当脑组织发生缺血损伤,激活T细胞和NK细胞后,IFN-γ才被表达,IFN-γ还能促进脑组织中小胶质细胞和炎性细胞的浸润[18]。当前的部分临床研究显示,急性脑梗死患者外周血中IFN-γ水平显著升高,并在7 d达到峰值,此后呈下降趋势[19]。本项研究也显示IFN-γ在入院时即增高,表明IFN-γ参与了脑梗死的病理生理过程;但在此后14 d内,IFN-γ持续维持在一个较高水平,无明显的下降趋势。同时还有动物实验研究发现脑梗死后梗死的体积与IFN-γ的水平有正相关性,这在一定程度上反映了疾病的严重程度[20],但本项研究对脑梗死发生后24 h的IFN-γ水平与发病后的神经功能评分的相关性分析得到了阴性结果,提示在临床上IFN-γ水平可能无法反映疾病的严重程度。
综上所述,脑梗死患者血清中IL-1β、IL-6、TNF-α和IFN-γ含量均增高并在14 d内均维持在较高水平,提示炎症因子均参与了脑梗死急性期和亚急性期的炎症反应,并一定程度上反映了疾病早期的严重程度以及疾病的预后情况,为脑梗死的治疗和远期预后判断提供科学的理论依据。
[1] 姚东陂,张锦丽,王红欣.脑梗死的治疗现状及研究进展[J].解放军医药杂志,2012,24(12):55-59.
[2] Kim H M,Shin H Y,Jeong H J,et al.Reduced IL-2 but elevated IL-4,IL-6,and Ig E serum levels in patients with cerebral infarction during the acute stage[J].J Mol-Neurosci,2000,14(3):191-196.
[3] Dziedzic T.Clinical significance of acute phase reaction in stroke patients[J].Front Biosci,2008,13:2922-2927.
[4] 赵素岗,李红儒,邓玉云,等.CT灌注成像在脑梗死前期局部低灌注中的应用价值[J].中国医学影像学杂志,2005,13(4):254-256.
[5] 杨振燕,靳令经.脑梗死后代谢产物演变的磁共振化学位移成像研究[J].中国医学影像学杂志,2005,13(6):401-404.
[6] Lindsberg P,Grau A.Inflammation and infections as risk factors for ischemic stroke[J].Stroke,2003,34(10):2518-2532.
[7] Weber A,Wasiliew P,Kracht M.Interleukin-1(IL-1)pathway[J].Sci Signal,2010,3(105):2.
[8] Amantea D,Bagetta G,Tassorelli C,et al.Identification of distinct cellular pools of interleukin-1beta during the evolution of the neuroinflammatory response induced by transient middle cerebral artery occlusion in the brain of rat[J].Brain Res,2010,1313:259-269.
[9] Denes A,Wilkinson F,Bigger B,et al.Central and haematopoietic interleukin-1 both contribute to ischaemic brain injury in mice[J].Dis Model Mech,2013,6(4):1043-1048.
[10]Lambertsen K L,Biber K,Finsen B.Inflammatory cytokines in experimental and human stroke[J].J Cereb Blood Flow Metab,2012,32(9):1677-1698.
[11] Smith CJ,Emsley H C,Udeh C T,et al.Interleukin-1 receptor antagonist reverses stroke-associated peripheral immune suppression[J].Cytokine,2012,58(3):384-389.
[12] Luheshi N M,Kovacs K J,Lopez-Castejon G,et al.Interleukin-1alpha expression precedes IL-1beta after ischemic brain injury and is localised to areas of focal neuronal loss and penumbral tissues[J].J Neuroinflammation,2011,8:186.
[13] Kwan J,Horsfield G,Bryant T,et al.IL-6 is a predictive biomarker for stroke associated infection and future mortality in the elderly after an ischemicstroke[J].Exp Gerontol,2013,48(9):960-965.
[14] Spalletta G,Cravello L,Imperiale F,et al.Neuropsychiatric symptomsandinterleukin-6serum levels in acute stroke[J].J Neuropsychiatry Clin Neurosci,2013,25(4):255-263.
[15] Cure M C,Tufekci A,Cure E,et al.Low-density lipoprotein subfraction,carotid artery intima-media thickness,nitric oxide,and tumor necrosis factor alpha are associated with newly diagnosed ischemic stroke[J].Ann Indian Acad Neurol,2013,16(4):498-503.
[16] Tong Y,Geng Y,Xu J,et al.The role of functional polymorphisms of the TNF-alpha gene promoter in the risk of ischemic stroke in Chinese Han and Uyghur populations:two case-control studies[J].Clin Chim Acta,2010,411(17):1291-1295.
[17] Wang J,Yang Z,Liu C,et al.Activated microglia provide a neuroprotective role by balancing glial cell-line derived neurotrophic factor and tumor necrosis factor-αsecretion after subacute cerebral ischemia[J].Int J Mol Med,2013,31(1):172-178.
[18] Yilmaz G,Arumugam T V,Stokes K Y,et al.Role of T lymphocytes andinterferon-gamma in ischemic stroke[J].Circulation,2006,113(17):2105-2112.
[19]杨健,蔡志友,王咏龙.急性脑梗死患者VEGF与炎症因子 IL-18、IFN-γ 的临床研究[J].重庆医学,2009,38(8):928-930.
[20]柴福民,邱建东,阎彬彬,等.大鼠脑缺血后IFN-γmRNA 的表达[J].中国实用医药,2006,1(1):2-5.
