综合干预措施对老年糖尿病患者轻度认知功能障碍的影响
2014-02-14张严高王文慧张友琴刘兴振
范 洁 ,张严高,王文慧,张友琴,刘兴振
随着生活水平提高、生活方式的改变及人口老龄化的加剧,我国糖尿病和糖尿病前期患病率分别为9.7%(男性为10.6%,女性为 8.8%)和 15.5%(男性为16.1%,女性为14.9%),糖尿病患者已达9240万人[1]。糖尿病已成为严重的公共健康问题。糖尿病不仅可以导致大血管、微血管及神经病变,还可加速脑老化。已有大量研究证明,糖尿病与认知功能障碍存在高度相关[2],发生机制可能为脑内胰岛素抵抗(insulin resistance,IR)和胰岛素不足导致认知障碍和神经退行性病变[3]。轻度认知功能障碍(mild cognitive impairment,MCI)为痴呆(alzheimer disease,AD)前期,糖尿病患者MCI的发生率高达32.7%[4],MCI向 AD转化的年转化率为6% ~25%[5]。本研究采用综合干预措施对伴有轻度认知功能障碍的老年糖尿病患者进行干预,探讨积极的综合干预措施对老年糖尿病患者认知功能的影响。
1 资料与方法
1.1 一般资料 选取2008年5月—2011年5月于南京军区杭州疗养院确诊的伴MCI的老年糖尿病患者80例,诊断均符合WHO制订的2型糖尿病诊断标准[6];MCI的诊断以简易智力状态量表(minimental state examination,MMSE)[7]得分为标准。所有患者随机分为干预组和对照组,每组40例。干预组男28例,女12例;年龄57~82(72.7±6.2)岁;糖尿病病程(12.6±7.3)年。对照组男26例,女14例;年龄 59~86(73.9±6.7)岁;糖尿病病程(11.3±6.9)年。两组性别、年龄、糖尿病病程、文化程度等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 对照组住院期间采取常规治疗,疗程结束后给予常规出院指导。干预组除上述常规治疗措施外,还给予综合干预,由内分泌科、营养科、神经内科医生和护士组成综合干预小组,具体方法:制订详细的饮食、运动、降糖药物应用方案,每周通过电话了解血糖波动、饮食、运动、降糖药物使用情况并给予指导,向患者讲解糖尿病及MCI方面的保健知识;利用住院期间心理评估结果制订个体化的心理支持方案,使家庭氛围融洽,减轻患者恐慌、焦虑、紧张等不良情绪;当地患者每2周来院进行干预,当面了解情况、讲授保健知识,并通过一些小游戏训练患者注意力和计算力;外地患者主要通过其所在医疗机构完成面对面的指导。
1.3 评价方法 分别于干预前及干预后1、3、6、12及18个月检测两组糖代谢指标[糖化血红蛋白(HbA1c)、胰岛素抵抗指数(HOMA-IR)及空腹C肽(FC-P)],并通过邮寄或面对面方式发放量表进行评价。使用蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)[8]和日常生活能力量表(activity of daily living scale,ADL)[9]评定。MoCA 量表总分30分,得分≥26分为正常,得分越高表明认知功能越好。ADL量表总分>20分为社会或行动能力不同程度下降,20分为正常,分数越高表明社会或行动能力下降越严重。
1.4 统计学方法 应用SPSS 18.0软件进行统计学处理,正态分布的计量资料采用均数±标准差(±s)表示,非正态分布的计量资料经过对数转换基本符合正态分布后分析,两组间比较采用独立样本t检验;计数资料以率(%)表示,采用 χ2检验。α=0.05为检验水准。
2 结果
2.1 糖代谢改善情况 两组干预前3项糖代谢指标差异无统计学意义(P>0.05)。干预后不同时间点,干预组HbA1c、HOMA-IR、FC-P均较干预前有显著降低,差异有统计学意义(P<0.05);对照组HbA1c、HOMA-IR及FC-P干预前后比较差异无统计学意义(P>0.05)。干预后相同时间点两组比较,除干预后1个月及6个月HbA1c外,其余糖代谢指标差异均有统计学意义(P<0.05),见表1。
表1 两组老年糖尿病干预前后糖代谢变化情况(±s)
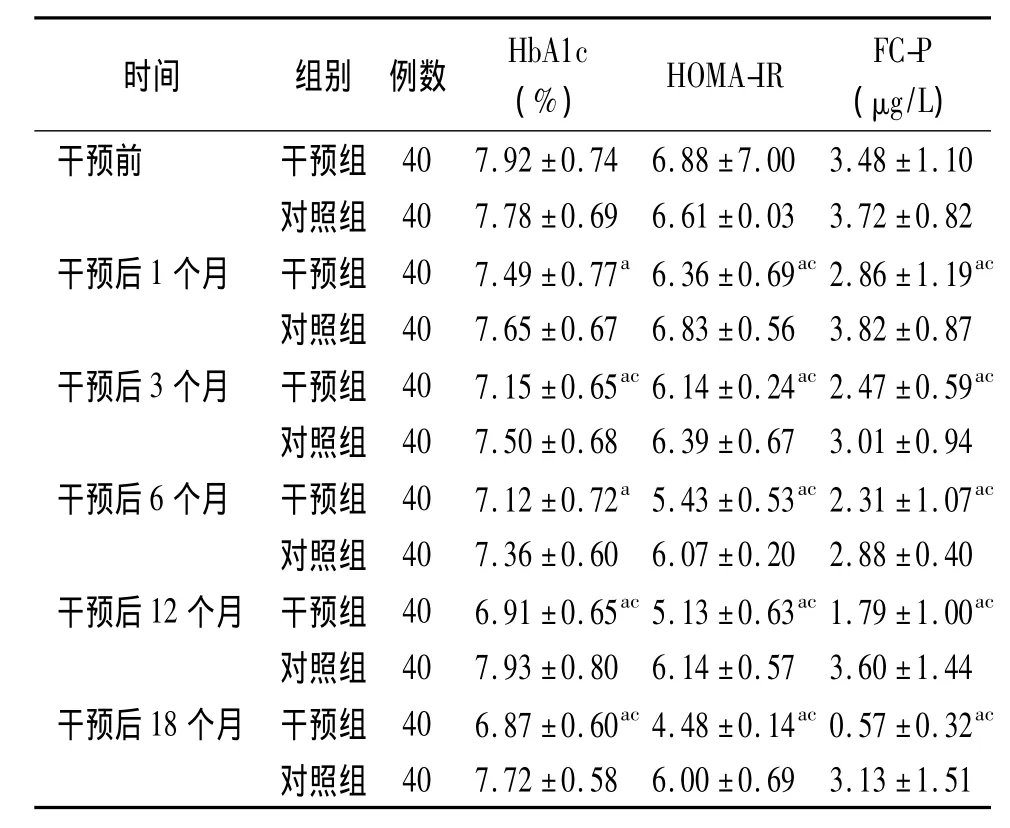
表1 两组老年糖尿病干预前后糖代谢变化情况(±s)
注:对照组:住院期间采取常规治疗,疗程结束后给予常规出院指导;干预组:在常规治疗基础上给予综合干预。HbA1c:糖化血红蛋白,HOMA-IR:胰岛素抵抗指数,FC-P:空腹C肽。与本组干预前比较,a P<0.05;与对照组相同时间点比较,c P <0.05
?
2.2 认知能力及生活质量改善情况 两组干预前MoCA、ADL评分比较,差异无统计学意义(P>0.05);干预后不同时间点,干预组MoCA评分均较干预前显著提高,差异有统计学意义(P<0.05);同时间点比较,干预组MoCA评分均高于对照组,差异有统计学意义(P<0.05)。干预组ADL评分与干预前比较,自干预后6个月开始有显著提高(P<0.05);与对照组比较,自干预后12个月开始有显著提高(P<0.05)。对照组干预前后MoCA、ADL评分比较差异均无统计学意义(P>0.05)。见表2。
表2 两组老年糖尿病干预前后MoCA、ADL评分结果(±s,分)

表2 两组老年糖尿病干预前后MoCA、ADL评分结果(±s,分)
注:对照组:住院期间采取常规治疗,疗程结束后给予常规出院指导,干预组:在常规治疗基础上给予综合干预;MoCA:蒙特利尔认知评估量表,ADL:日常生活能力量表;与本组干预前比较,a P<0.05;与对照组同时间点比较,c P<0.05
时间MoCA干预组(n=40)对照组(n=40)ADL干预组(n=40)对照组(n=40)干预前20.3 ±5.9 20.1 ±4.6 15.4 ±3.7 16.2 ±5.6干预后1 个月 21.2 ±6.1ac 20.3 ±6.4 15.5 ±4.2 16.1 ±2.9干预后3 个月 22.4 ±7.2ac 21.4 ±5.3 15.8 ±5.2 15.2 ±7.6干预后6 个月 23.7±4.7ac 20.8±6.2 16.9±4.9a 16.7±3.6干预后12 个月 23.9 ±5.4ac 21.1 ±7.7 17.1 ±5.8ac 15.5 ±5.1干预后18 个月 24.1 ±4.8ac 21.3 ±4.1 18.2 ±4.6ac 15.1 ±3.9
3 讨论
MCI是指存在超出年龄和文化所允许范围的记忆障碍和(或)其他认知功能的轻度障碍,主要表现为日常生活中出现明显的记忆减退、时间观念产生混淆、出现忧郁或攻击行为,但个体的社会职业或日常生活等其他功能完好[10]。糖尿病患者MCI发病较为隐匿,一旦进展为AD往往对患者生活质量造成极大影响,也给其家属及社会带来沉重的负担。尽管MCI的诊断标准依赖于特殊的神经心理学检查[11],但灵活运用MMSE或MoCA等量表对老年糖尿病患者进行评估筛查[12-14],依然可以及早发现一部分伴MCI的糖尿病患者,从而对其及早进行干预,起到延缓MCI向AD进展的目的。
在美国糖尿病协会(ADA)第73届科学年会上,研究人员首次正式对外公布了糖尿病患者健康行动临床研究数据。尽管强化生活方式干预人群(包括体育锻炼和减轻体重)与药物治疗人群相比,心血管发病率、病死率及低密度脂蛋白胆固醇(LDL-C)并未显著下降,但强化生活方式干预确实可以为患者带来一些益处,包括降低肾脏疾病风险、减少自述视网膜病变和抑郁症状,还可以改善患者生活质量、减少每年住院次数和费用。本研究结果显示,采取综合干预措施对伴MCI的老年糖尿病患者的IR、认知能力及生活能力均有一定改善作用。IR普遍存在于多种生理和病理状态中,可以加剧Tau蛋白异常过度磷酸化修饰及 B-淀粉样蛋白(amylond B-protein,A13)的沉积,而上述作用形成的神经毒素反过来又可以降低神经元对胰岛素的敏感性,从而导致或加重MCI或AD[15-16]。因此,基于糖尿病与MCI共同的病理生理机制[17],当综合干预措施使糖尿病患者IR改善后,MCI的症状也有所缓解。另外,糖尿病患者的MCI症状缓解后,其自我管理能力也将有所提高,从而有利于血糖的控制和IR的改善。
有研究显示,低血糖为2型糖尿病伴MCI的独立危险因素[18]。因此,需要强调的是在综合干预的过程中应重点关注老年糖尿病患者有无低血糖的发生。长期低血糖不仅能够增加患者心血管事件的发生率,还可能加重老年患者MCI的症状,影响患者的生活质量、增加社会医疗负担[19]。2010年美国退伍军人事务部/国防部(VA/DOD)指南建议患病时间长(>10年)、并发症多的老年糖尿病患者,可控制 HbA1c<8%[20];2013 年 ADA 指南建议[21]:对于身体良好、无认知障碍、预期寿命较长的老年患者,可制订与年轻成人糖尿病患者相同的治疗目标,但并发症较多的老年糖尿病患者应放宽目标,制订个体化的血糖控制标准。在临床工作中建议老年糖尿病患者睡前血糖不低于8 mmol/L,夜间血糖不低于5 mmol/L。对于使用胰岛素特别是容易出现夜间峰值的中效胰岛素的患者,一旦出现上述情况应及时调整胰岛素用量,以减少低血糖发生的风险。
总之,采取综合干预措施在有效控制血糖、改善IR的同时,能提高糖尿病伴MCI患者的认知能力和生活质量。对老年糖尿病伴MCI患者进行积极综合干预,可延缓患者认知功能障碍的进展,提高日常生活能力,减轻家属和社会的负担。
[1] Yang W,Lu J,Weng J,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090-1101.
[2] Barrou Z,Lemaire A,Boddaert J,et al.Diabetes mellitus and cognition:is there a link?[J].Psychol Neuropsychiatr Vieil,2008,6(3):189-198.
[3] Holscher C,Li L.New roles for insulin-like hormones in neuronal signaling and protection:new hopes for novel treatments of Alzheimer's disease?[J].Neurobiol Aging,2010,31(9):1495-1502.
[4] 司俊霞,谈跃,徐勉,等.胰岛素水平与轻度认知障碍关系的临床研究[J].中国糖尿病杂志,2008,16(7):418-420.
[5] Petersen R C,Stevens J C,Ganguli M,et al.Practice parameter:early detection of dementia:mild cognitive impairment(an evidence-based review).Report of the Quality Standards Subcommittee of the American Academy of Neurology[J].Neurology,2001,56(9):1133-1142.
[6] World Health Organization.Definition.diagnosis and classification of diabetes mellitus and its complication:report of a WHO consultation[R].Geneva:WHO,1999:1-44.
[7] 张明园.精神科评定量表手册[M].长沙:湖南科学技术出版社,1998:166-168.
[8] Nasreddine Z S,Phillips N A,Bedirian V,et al.The Montreal Cognitive Assessment,MoCA:a brief screening tool for mild cognitive impairment[J].JAm Geriatr Soc,2005,53(4):695-699.
[9] 何燕玲.日常生活能力量表(ADL)[J].上海精神医学,1989,7(3):124-126.
[10] Staekenborg S S,Koedam E L,Henneman W J,et al.Progression of mild cognitive impairment to dementia:contribution of cerebrovascular disease compared with medial temporal lobe atrophy[J].Stroke,2009,40(4):1269-1274.
[11]王延平,李海员,杨少青,等.轻度认知功能障碍患者的神经心理学研究[J].中华神经医学杂志,2010,9(4):412-415.
[12] O'Bryant SE,Humphreys JD,Smith G E,et al.Detecting dementia with the mini-mental state examination in highly educated individuals[J].Arch Neuro,2008,65(7):963-967.
[13] Petersen R C,Smith G E,Waring SC,et al.Mild cognitive impairment:clinical characterization and outcome[J].Arch Neurol,1999,56(3):303-308.
[14]李海员,王延平,黄绍宽,等.蒙特利尔认知评估量表在轻度认知功能障碍筛查中的应用[J].中华神经医学杂志,2009,8(4):376-379.
[15]杨雁,胡蜀红,张建华,等.肥胖及2型糖尿病大鼠Alzheimer病样Tau蛋白过度磷酸化修饰及机制探讨[J].生物化学与生物物理进展,2006,33(5):458-464.
[16] Grossman H.Does diabetes protect or provoke Alzheimer's disease?Insights into the pathobiology and future treatment of Alzheimer's disease[J].CNSSpectr,2003,8(11):815-823.
[17] Yaffe K,Falvey C,Hamilton N,et al.Diabetes,glucose control,and 9-year cognitive decline among older adults without dementia[J].Arch Neurol,2012,69(9):1170-1175.
[18]郝云玲,严励.2型糖尿病合并轻度认知功能障碍相关因素分析[J].中国医药导报,2012,9(35):84-85,88.
[19] Ahrén B.Avoiding hypoglycemia:a key to success for glucose-lowering therapy in type 2 diabetes[J].Vasc Health Risk Manag,2013,9:155-163.
[20] United States Department of Veterans Affairs.VA/DOD clinical practice guidelines:Management of diabetes mellitus in primary care(2010)[EB/OL].(2010-07-02)[2012-09-27].http://www.healthquality.va.gov/diabetes.
[21] American Diabetes Association.Standards of medical care in diabetes——2013[J].Diabetes Care,2013,36(Suppl 1):S11-S66.
