胃肠道间质瘤中c-kit和PDGFRA基因突变多态性分析
2014-02-14田玉旺许春伟高文斌张玉萍石明伟亓岽东
田玉旺,许春伟,高文斌,张玉萍,石明伟,亓岽东
胃肠道间质瘤(gastrointestinal stomal tumors,GIST)是胃肠道最常见的原发性间叶性肿瘤[1-2]。GIST免疫组化一般为CD117胞膜阳性、胞质弥漫阳性或核周阳性,表型与Cajal细胞分化相同[3],大部分病例具有c-kit或PDGFRA活化突变,并相互独立地获得传导性激活。即在无配体结合的情况下,ckit或PDGFRA蛋白仍然能保持持续的自身酪氨酸蛋白激酶活性,从而激活下游的信号传导通路[4-6]。其基因功能获得性突变被认为是GIST发病的主要机制[7]。目前对GIST中c-kit或PDGFRA基因的突变率、基因突变与生物学行为的关系报道不一[8-11],而临床体外和体内实验均已证明伊马替尼对GIST的疗效与有无基因突变及突变位点和类型密切相关[12-13],因此对GIST相关基因突变进行研究具有重要的临床意义。本研究通过PCR扩增、测序法获得基因突变类型,分析GIST患者相关基因突变情况,为判断疾病发展过程、预后及伊马替尼靶向治疗提供分子病理学依据。
1 材料与方法
1.1 材料
1.1.1 标本来源:收集北京军区总医院、大连大学附属中山医院和山东省潍坊市人民医院2007~2013年病理诊断为GIST并行c-kit和PDGFRA基因检测的标本共93份,93例中男53例,女40例;首发年龄23~83岁,中位年龄57岁;肿瘤直径5~45 cm,中位直径8.7 cm;原发病变部位:胃71例(76.34%),十二指肠8例(8.60%),直肠、食管各5例(5.38%),回肠、结肠、胸膜、宫腔各 1例(1.08%);依据 Fletcher等[14]方案危险度分级:极低度和低度侵袭危险41例,中度侵袭危险17例,高度侵袭危险35例。每例标本由3名病理医师复查。
1.1.2 GIST纳入标准:常规形态符合GIST诊断要点,有85例免疫组化CD117为胞膜弥漫强阳性而确诊,8例CD117阴性者中有3例DOG-1阳性而确诊,其余5例因SMA、Desmin和S-100均阴性,排除了平滑肌源性和神经源性肿瘤,形态符合GIST而纳入本研究。
1.1.3 主要试剂和仪器:DNA提取试剂盒(德国QIAGEN公司),核酸蛋白质浓度测量仪B-500(上海创萌生物科技有限公司),CD117(福建迈新生物技术开发有限公司,克隆号:YR145),DOG-1(福建迈新生物技术开发有限公司,克隆号:SP31),SMA(北京中杉金桥生物技术有限公司,克隆号:IA4),Desmin(北京中杉金桥生物技术有限公司,克隆号:ZC18),S-100(福建迈新生物技术开发有限公司,克隆号:4C4.9),引物合成(上海英俊生物科技有限公司),ABI9700PCR扩增仪(ABI公司)。
1.2 方法
1.2.1 免疫组化染色:所有标本常规石蜡包埋,4μm厚连续切片,60℃温箱烘烤90 min。采用En-Vision二步法,试验过程严格按照试剂盒说明书进行,高温高压抗原修复,DAB显色,PBS代替一抗为阴性对照,已知阳性的结肠腺体组织为阳性对照。
1.2.2 引物设计:c-kit基因和PDGFRA基因序列参照 GenBank(http://www.ncbi.nlm.nih.gov),GenBank Accession:NC_000004和 NG_009250。引物由Primer及Oligo软件设计,设计标准:引物扩增片段大小190~270 bp,引物长度17~25 bp,GC含量40%~70%,两条引物的Tm值尽量接近。避免引物内部或之间形成3 bp以上的互补序列。对其进行BLAST检查符合要求,并由上海英俊生物科技有限公司合成。c-kit和PDGFRA基因各外显子引物序列见表1。

表1 c-kit和PDGFRA基因各外显子引物序列
1.2.3 DNA提取:采用QIAamp DNA FFPE Tissue Kit试剂盒提取病变组织DNA,将含有DNA组织的蜡块连切5张10μm的厚蜡膜,严格按照试剂盒说明步骤进行操作,并测定其纯度和浓度备用。
1.2.4 PCR扩增:PCR反应体系(50μl):2×Taq PCR Master Mix 25μl;DNA模板2μl;上、下游引物各2μl(10 pmol);灭菌去离子水19μl。反应条件:94℃预变性 5 min;94℃、30 s,56℃、45 s,72℃、1 min,共45 个循环;72℃延伸5 min,4℃冷却5 min。灭菌去离子水代替模板作为阴性对照。PCR扩增产物送北京金唯智生物科技有限公司纯化并测序,有突变的标本再行反向测序证实,确定基因突变类型。
2 结果
2.1 c-kit基因突变分析 93例GIST中共64例(68.82%)检测到c-kit突变,均为CD117阳性,其中87.50%(56/64)为11号外显子突变;6.25%(4/64)为9号外显子突变;4.69%(3/64)为13号外显子突变,其中1例与11号外显子共突变;1.56%(1/64)为17号外显子的突变,为与11号外显子共突变。在 CD117阳性的病例中,c-kit突变比例达75.29%(64/85)。11号外显子的突变中91.07%为杂合性突变(51/56),仅8.93%(5/56)为纯合性突变。检测到的11号外显子突变形式有:55.36%(31/56)缺失突变、26.79%(15/56)点突变、14.29%(8/56)插入突变(串联重复)和3.57%(2/56)伴有点突变的缺失突变(图1)。62.50%(35/56)的突变集中在5'端累及密码子550~560的热点区。最常见的形式为5'端第557~558个密码子WK(Trp-Lys)的缺失突变,占12.50%(7/56);其次为第559个密码子V(Val)的缺失突变和Val突变为Ala的点突变(V575A),均为7.14%(4/56)。14.29%(8/56)的GIST存在11号外显子插入2~14个氨基酸的现象,包括5例3'端的串联重复序列(internal tandem duplications,ITD)和 3 例 5'端的ITD,5例3'端ITD患者中有2例为女性。6.25%(4/64)的GIST中检出了c-kit 9号外显子的突变,均为第502和503个密码子编码丙氨酸和酪氨酸(Ala-Tyr)的6个核苷酸的串联重复插入(图2),其中3例为杂合性突变;3例位于十二指肠,1例位于胃部。仅4.69%(3/64)的GIST检出了13号外显子突变,3例均为第642个密码子Lys突变为Arg的点突变(K642R,图3)。仅1.56%(1/64)的GIST中检出了17号外显子突变,此例为与11号外显子第551~554个密码子KPMY(Lys-Pro-Met-Tyr)的缺失突变共存的双突变,即第820个密码子由Asp突变为Tyr的点突变(D820Y,图4)。
2.2 PDGFRA基因突变分析 29例无c-kit突变的GIST中共检测到4例PDGFRA突变,占总病例数的4.30%(4/93)和无c-kit突变病例的13.79%(4/29),其中1例为伴c-kit突变11号外显子第576个密码子Leu突变为Pro(L576P)的双突变共存型,为18号外显子第824个密码子Val内部GTC>GTT碱基的同义点突变(图5)。其余3例也均为18号外显子突变,突变位点为第842个密码子Asp突变为Val的点突变(D842V)。4例除双突变共存型外,其余3例均为CD117阴性病例。
3 讨论
c-kit原癌基因定位于人染色体4号长臂1区2和3带(4q12-13),其产物是Ⅲ型酪氨酸激酶生长因子受体,编码145 kD的跨膜糖蛋白酪氨酸激酶受体。c-kit基因具有21个外显子,正常情况下c-kit的活化依赖配体干细胞因子(stem cell factor,SCF)的触发,使底物蛋白磷酸化激发信号传导通路,最终激发重要的细胞功能,如增生、凋亡等,而突变后的c-kit基因可以不依赖配体而自动磷酸化,细胞增生不可控,最终可能导致肿瘤的发生、发展。有研究者指出c-kit的基因功能获得性突变(gain-of-function mutation)可能是肿瘤发生、发展的核心事件[14]。其中在c-kit基因胞内近膜结构域的11号外显子突变最为常见,由于各研究组用于提取DNA的组织、实验方法、病例构成等不同,因而其突变率报道差异很大,为21% ~92%[13,15-18]。国外 3 组大样本量的研究显示,11号外显子突变率分别为69.32%(296/427)、72.36%(233/322)和 51.50%(103/200)[15,19-20]。本研究为 60.22%(56/93),与上述研究基本一致。
c-kit基因突变的第1个热点是11号外显子5'端的点突变和框内缺失,第2个热点位于11号外显子的3'端,为框内ITD。本组仅4例(4.30%)检出了c-kit胞外结构域的9号外显子突变,与Lasota等[20]报道较大样本突变率(3.00%,6/200)相近,但略低于 Corless 等[19]、Antonescu 等[21]和 Wozniak等[17]报道的7.26% ~10.84%。c-kit磷酸转移酶结构域的17号外显子突变非常少见,本组发现1例与11号外显子共存的双突变,突变位点为新发现的D820Y点突变。近来,对CD117阴性GIST的诊断较为困难,基因突变检测是重要诊断手段之一,但检测情况报道不一[22-23]。本资料中8例CD117阴性GIST中3例检测出c-kit11号外显子突变。
PDGFRA基因和c-kit基因位于人4号染色体的相邻位置上,两者的氨基酸序列有很高的同源性。PDGFRA总体突变率与来自中国台湾、韩国的数据相近[17-18],但低于西方患者数据[19]。Heinrich 等[4]发现,在无c-kit基因突变的GIST中存在PDGFRA基因的活化突变,也可能是GIST形成的机制之一。PDGFRA的信号传导通路与c-kit基因相似,包含23个外显子,其表型以上皮细胞型为主,其突变也可以产生自动磷酸化,促发信号传导通路的瀑布级联反应,使得细胞生长失控无序。本组4.30%(4/93)检出了PDGFRA突变,其中1例为第824个密码子Val内部GTC>GTT碱基的点突变,为与c-kit基因11号外显子的共突变,其余3例为18号外显子的点突变,占无c-kit表达病例的10.34%(3/29),占CD117阴性病例的37.50%(3/8)。Tu等[24]曾报道过1例肾移植受者的胃肠道外间质瘤PDGFRA第824个密码子Val内部GTC>GTT碱基的同义点突变,但未见c-kit外显子点突变。此研究为第2例报道PDGFRA第824个密码子Val内部GTC>GTT碱基的同义点突变且为伴11号外显子第576个密码子Leu突变为Pro(L576P)的双突变共存型。


图2 胃肠道间质瘤c-kit 9号外显子第502和503个密码子编码丙氨酸和酪氨酸的6个核苷酸的串联重复插入(箭头所示)

图3 胃肠道间质瘤c-kit 13号外显子第642个密码子Lys突变为Arg的点突变(箭头所示)
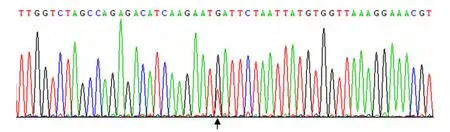
图4 胃肠道间质瘤c-kit 17号外显子第820个密码子由Asp突变为Tyr的点突变(箭头所示)

图5 胃肠道间质瘤PDGFRA 18号外显子第824个密码子Val内部GTC>GTT碱基的点突变(箭头所示)
伊马替尼是一种选择性抑制BCR-ABL、PDGFRA和c-kit酪氨酸激酶活性的小分子制剂,临床治疗GIST很有效[25]。基因突变的位置和性质能影响GIST对伊马替尼的反应[26]。研究发现c-kit 11号外显子突变的GIST患者对伊马替尼呈现良好的反应,而9号外显子突变者对伊马替尼的反应略差[27]。另一些体外和临床研究已初步提示抑制剂对突变在激酶位点的病例疗效不明显[28],如c-kit 17号外显子和PDGFRA 18号外显子突变。但仍有30%PDGFRA突变的病例对伊马替尼敏感的报道[28]。提示临床应重视 CD117阴性 GIST的诊断问题,以及应进行相应基因突变检测判断是否适用于伊马替尼治疗。另外,年龄较小的患者中可能有部分为儿童性GIST,其基因突变类型多为野生型,对伊马替尼敏感性稍差[29]。
本研究对GIST患者进行c-kit和PDGFRA基因突变的检测分析发现,c-kit突变主要集中于11号外显子经典热点和3'端热点,PDGFRA基因突变主要见于CD117阴性GIST,并首次在国内外报道了17号外显子与11号外显子原发同基因双突变、ckit和PDGFRA基因双突变共存型各1例。异基因双突变共存型中PDGFRA 18号外显子第824个密码子Val内部GTC>GTT碱基的同义点突变目前也仅在国内报道过1例。总之,大部分GIST均存在ckit或PDGFRA基因突变,其基因突变分型能指导伊马替尼的肿瘤靶向治疗。
[1] Rubin B P,Heinrich M C,Corless C L.Gastrointestinal stromal tumour[J].Lancet,2007,369(9574):1731-1741.
[2] 钱锋,胡新,刘佳佳,等.539例胃肠道间质瘤的临床分析[J].中华消化外科杂志,2013,12(4):272-275.
[3] Kwon JG,Hwang SJ,Hennig G W,et al.Changes in the structure and function of ICC networks in ICC hyperplasia and gastrointestinal stromal tumors[J].Gastroenterology,2009,136(2):630-639.
[4] Heinrich M C,Corless C L,Duensing A,et al.PDGFRA activating mutations in gastrointestinal stromal tumors[J].Science,2003,299(5607):708-710.
[5] Nedeljkovic SS,Wasan A,Jamison R N.Assessment of efficacy of long-term opioid therapy in pain patients with substance abusepotential[J].Clin J Pain,2002,18(4 Suppl):S39-S51.
[6] Joensuu H,Kindblom L G.Gastrointestinal stromal tumors——a review [J].Acta Orthop Scand Suppl,2004,75(311):62-71.
[7] Heinrich M C,Rubin B P,Longley B J,et al.Biology and genetic aspects of gastrointestinal stromal tumors:KIT activation and cytogeneticalterations[J].Hum Pathol,2002,33(5):484-495.
[8] Lasota J,Jasinski M,Sarlomo Rikala M,et al.Mutations in exon 11 of c-Kit occur preferentially in malignant versus benign gastrointestinal stromal tumors and do not occur in leiomyomas or leiomyosarcomas[J].Am J Pathol,1999,154(1):53-60.
[9] Kim T W,Lee H,Kang Y K,et al.Prognostic significance of c-kit mutation in localized gastrointestinal stromal tumors[J].Clin Cancer Res,2004,10(9):3076-3081.
[10]Corless C L,McGreevey L,Haley A,et al.KIT mutations are common in incidental gastrointestinal stromal tumors one centimeter or lessin size[J].Am J Pathol,2002,160(5):1567-1572.
[11]贺慧颖,方伟岗,钟镐镐,等.165例胃肠道间质瘤中ckit和PDGFRA基因突变的检测和临床诊断意义[J].中华病理学杂志,2006,35(5):262-266.
[12]Debiec Rychter M,Dumez H,Judson I,et al.Use of c-KIT/PDGFRA mutational analysis to predict the clinical response to imatinib in patientswith advanced gastrointestinal stromal tumours entered on phaseⅠandⅡstudies of the EORTC Soft Tissue and Bone Sarcoma Group[J].Eur JCancer,2004,40(5):689-695.
[13] Miettinen M,Lasota J.Gastrointestinal stromal tumors:review on morphology,molecular pathology,prognosis,anddifferential diagnosis[J].Arch Pathol Lab Med,2006,130(10):1466-1478.
[14] Fletcher CD,Berman J J,Corless C,et al.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Hum Pathol,2002,33(5):459-465.
[15]侯英勇,朱雄增.胃肠道间质瘤的分子生物学研究[J].肿瘤研究与临床,2006,18(8):507-512.
[16] Battochio A,Mohammed S,Winthrop D,et al.Detection of c-KIT and PDGFRA gene mutations in gastrointestinal stromal tumors:comparisonof DHPLC and DNA sequencing methods using a single population-based cohort[J].Am JClin Pathol,2010,133(1):149-155.
[17]Wozniak A,Rutkowski P,Piskorz A,et al.Prognostic value of KIT/PDGFRA mutations in gastrointestinal stromal tumours(GIST):Polish Clinical GIST Registry experience[J].Ann Oncol,2012,23(2):353-360.
[18]党运芝,高静,李健,等.胃肠间质瘤临床病理特征与基因分型(附660例分析)[J].中国实用外科杂志,2013,33(1):61-65.
[19] Corless CL,Fletcher JA,Heinrich M C.Biology of gastrointestinal stromal tumors[J].J Clin Oncol,2004,22(18):3813-3825.
[20] Lasota J,Wozniak A,Sarlomo Rikala M,et al.Mutations in exons 9 and 13 of KIT gene are rare events in gastrointestinal stromal tumors.Astudy of 200 cases[J].Am JPathol,2000,157(4):1091-1095.
[21]Antonescu CR,Sommer G,Sarran L,et al.Association of KIT exon 9 mutations with nongastric primary site and aggressive behavior:KIT mutation analysis and clinical correlates of 120 gastrointestinal stromal tumors[J].Clin Cancer Res,2003,9(9):3329-3337.
[22] Medeiros F,Corless C L,Duensing A,et al.KIT-negative gastrointestinal stromal tumors:proof of concept and therapeutic implications[J].Am J Surg Pathol,2004,28(7):889-894.
[23] Tzen CY,Mau B L.Analysis of CD117-negative gastrointestinal stromal tumors[J].World J Gastroenterol,2005,11(7):1052-1055.
[24] Tu H,Li Q,Cai J,et al.Extragastrointestinal stromal tumor in a kidney transplant recipient[J].Clin Exp Nephrol,2012,16(2):350-353.
[25]李健.胃肠道间质瘤的分子靶向治疗[J].中华消化外科杂志,2013,12(4):253-256.
[26] Nickl N J.Gastrointestinal stromal tumors:new progress,new questions[J].Curr Opin Gastroenterol,2004,20(5):482-487.
[27]陈慧娟.c-kit和PDGFRA基因对胃肠间质瘤的影响[J].中国生物化学与分子生物学报,2009(8):697-701.
[28]贺慧颖,项一宁,李燕,等.胃肠道间质瘤60例中c-kit和PDGFRA基因突变的检测[J].北京大学学报(医学版),2005,37(3):320-324.
[29]Kim SY,Janeway K,Pappo A.Pediatric and wild-type gastrointestinal stromal tumor:new therapeutic approaches[J].Curr Opin Oncol,2010,22(4):347-350.
