聚类分析法对不同产地半夏药材质量的综合评价
2014-02-13甫志锦陈后江郑小磊杨永寿
甫志锦,黄 涛,陈后江,郑小磊,杨永寿
(大理学院药学与化学学院,云南大理 671000)
聚类分析法对不同产地半夏药材质量的综合评价
甫志锦,黄 涛,陈后江,郑小磊,杨永寿*
(大理学院药学与化学学院,云南大理 671000)
目的:综合比较、评价不同产地半夏药材的质量。方法:采用电位滴定法、紫外分光光度法、硫酸-蒽酮法和酸性染料比色法对不同产地半夏药材中的总有机酸、氨基酸、多糖和生物碱含量进行测定,并采用聚类分析法对测定结果进行综合评价。结果:不同产地的半夏药材中总有机酸、氨基酸、多糖和生物碱的含量差异较大。结论:半夏药材的质量受产地影响较大,经聚类分析可将39份来源不同的半夏药材分为Ⅲ类,第Ⅰ类产地主要为云南、贵州地区,这类药材中总有机酸、氨基酸、多糖和生物碱的含量普遍偏低,综合质量较差;第Ⅱ类产地为甘肃,质量居中;第Ⅲ类产地为四川,这类药材中各主要成分的含量较高,综合质量较好。
半夏药材;不同产地;聚类分析
半夏是天南星科植物三叶半夏Pinellia ternate(Thunb.)Breit.的干燥块茎,是临床上最常用的有毒中药材,在我国大部分地区均有分布,主产于四川、湖北、河南、贵州、安徽、云南等省。其味辛、性温、有毒,归脾、胃、肺经,具有燥湿化痰、消痞散结、降逆止呕的功效〔1〕。据研究报道,半夏主要含有有机酸、生物碱、半夏蛋白、挥发油、氨基酸和多糖等成分。半夏药材中的有机酸为镇咳、抗肿瘤的有效成分之一〔2〕,氨基酸中的天门冬氨酸具有镇咳祛痰的功效〔3〕,多糖也为半夏主要活性成分〔4〕。而生物碱具有降压、降脂作用,同时对体外肿瘤细胞的增殖具有较强的抑制作用〔5〕,但中国药典2010年版收载的“半夏药材质量标准”,只对药材中的有机酸含量进行控制〔6〕,不能客观反映药材的质量,而中药材的药效作用往往是药材中多成分共同作用的结果,加上中药材由于产地不同、炮制方法不同,质量亦有差异〔7〕,为客观评价半夏药材的质量,本研究在半夏药材各主要成分含量测定的基础上,拟采用聚类分析法对39份不同产地半夏药材的质量进行综合评价,目的在于建立一种能客观评价半夏药材质量的方法。
1 仪器与材料
1.1仪器pHS-25数显pH计(上海精密科学仪器有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);UV2500双光束紫外可见分光光度计(日本岛津);DHG-9420A电热恒温鼓风干燥箱(上海一恒科技有限公司);AE240电子分析天平(瑞士梅特勒);SB2200超声波清洗器(宁波新芝生物科技股份有限公司);DZKW-4电子恒温水浴锅(上海金桥科析仪器厂)。
1.2材料半夏药材由大理州食品药品检验所中药室鉴定为:天南星科植物三叶半夏Pinellia ternate(Thunb.)Breit.的干燥块茎,并免费提供给课题组作为研究使用(共39份);缬氨酸对照品(上海伯奥生物科技有限公司,批号:050202);葡萄糖对照品(中国药品生物制品检定所,批号:110742-200517);盐酸麻黄碱对照品(贵州迪大生物科技有限公司,批号:GZDD-0675);其它试剂均为分析纯。
2 溶液的配制
2.1 2%茚三酮溶液的配制称取茚三酮1.0 g加无水乙醇溶解成50 mL,即得2.0%茚三酮溶液,现配现用〔8〕。
2.2 pH 6.80磷酸盐缓冲液的配制取0.2 mol∕L磷酸二氢钾溶液250 mL,加0.2 mol∕L的NaOH溶液118 mL,用蒸馏水稀释至1 000 mL,摇匀,即得,pH值为6.80的磷酸盐缓冲液〔8〕。
2.3缬氨酸对照品溶液的配制精密称取缬氨酸对照品50 mg,用蒸馏水溶解,定容至500 mL,即得0.1 mg∕mL缬氨酸对照品溶液〔8〕。
2.4 5%苯酚溶液的配制取苯酚100 g,加铝片1 g和碳酸氢钠0.1 g,蒸馏,收集182℃馏分。称取精制苯酚10 g,加水溶解,于200 mL棕色量瓶中定容〔9-10〕。
2.5葡萄糖对照品溶液的配制精密称取干燥至恒重的无水葡萄糖10.0 mg,于50 mL量瓶中加蒸馏水溶解并稀释至刻度,摇匀即可〔11〕。
2.6醋酸-醋酸钠缓冲溶液的配制取醋酸钠54.6 g加1 mol∕L醋酸溶液20 mL溶解后,加水稀释至500 mL,即得,pH值为6.0的醋酸-醋酸钠缓冲液〔6〕。
2.7溴麝香草酚蓝标准溶液的配制取溴麝香草酚蓝0.1 g,加0.05 mol∕L的NaOH溶液3.2 mL使溶解,再加水稀释至200 mL,即得溴麝香草酚蓝标准溶液〔6〕。
2.8盐酸麻黄碱对照品溶液的配制取盐酸麻黄碱对照品10 mg,精密称定,至50 mL的容量瓶中,用氯仿溶解,并稀释至刻度,摇匀,即得0.2 mg∕mL盐酸麻黄碱对照品溶液〔5〕。
2.9总有机酸含量测定用样品溶液的配制取半夏药材适量,粉碎,过20目筛。精密称取5.0 g药材粉末,加70%乙醇50 mL,加热回流1 h,重复提取2次,放冷,过滤,合并滤液,蒸干。精密移取0.1 mol∕L的NaOH 10.0 mL加入残渣中,超声处理(500 W,40 kHz)30 min,使其残渣完全溶解,转移至500 mL量瓶中,加入新煮沸冷却的蒸馏水至刻度,摇匀,即得〔6〕。
2.10氨基酸含量测定用样品溶液的配制精密称取干燥、粉碎过20目筛的半夏粉末1.0 g,加50%的乙醇20 mL,在70℃的恒温水浴锅中回流30 min,重复提取2次,放冷,过滤,合并滤液,蒸干。残渣加少量蒸馏水,超声处理(500 W,40 kHz)至完全溶解,转移至50 mL量瓶中,定容,即得〔12〕。
2.11多糖含量测定用样品溶液的配制精密称取干燥、粉碎过20目筛的半夏粉末1.0 g,加6倍量的水浸泡过夜,煎煮3次,每次2 h,合并水提液,冷却,离心去除不溶性杂质,合并离心液,用0.1 mol∕L的NaOH调溶液的pH至中性,减压浓缩,加3倍量体积的95%的乙醇溶液沉淀,静置过夜使沉淀完全,沉淀依次用无水乙醇、丙酮、乙醚洗涤,待有机溶剂挥尽,加蒸馏水溶解,定容至50 mL,摇匀即得〔11〕。
2.12生物碱含量测定用样品溶液的配制精密称取干燥、粉碎过20目筛的半夏粉末1.0 g,置于50 mL三角瓶中,加浓氨水0.5 mL,湿润后,加氯仿10 mL,冷浸3 h,超声30 min,过滤,残渣以10 mL氯仿分3次洗涤,合并滤液与洗液,回收氯仿至干,加入10 mL氯仿使溶解,定容至50 mL,即得〔5〕。
3 实验方法
3.1总有机酸的含量测定精密量取“2.9”项下制备的样品溶液25.00 mL,照电位滴定法用0.1 mol∕L的HCl标准溶液滴定剩余的NaOH溶液,并用空白试验校正,每1 mL 0.1 mol∕L的NaOH溶液相当于5.904 mg的琥珀酸〔6〕。
3.2氨基酸的含量测定精密移取“2.3”项配制的缬氨酸对照品溶液1 mL,“2.10”项配制的供试品溶液2 mL,分别置25 mL量瓶中,分别加0.5 mL茚三酮溶液、1 mL pH 6.80的磷酸盐缓冲溶液,摇匀,置沸水浴中加热15 min,取出,冷却,加蒸馏水稀释至25 mL,摇匀,同法制备空白溶液。在568 nm下分别测定吸光度值,照下列公式计算半夏中总氨基酸的含量:总氨基酸含量(mg/g)=(C×D×1.024)∕W。W为供试品含量(g);C氨基酸含量(µg);D为稀释倍数;转换系数1.024是氨基酸的平均分子量120除以缬氨酸的分子量117.15所得〔8,13〕。
3.3多糖的含量测定精密移取“2.5”项配制的葡萄糖对照品溶液1 mL,“2.11”项配制的供试品溶液1 mL,分别置25 mL量瓶中,分别加入1 mL 5%的精制苯酚溶液、5 mL浓硫酸。摇匀,置水浴中加热25 min,取出冷却,加水定容至25 mL,摇匀,同法制备空白溶液,在625 nm下分别测定其吸光度值〔11〕。
3.4生物碱的含量测定精密移取“2.8”项下配制的盐酸麻黄碱对照品溶液1 mL,“2.12”项下配制的供试品溶液1 mL,分别置25 mL量瓶中,分别加入10 mL pH 6.0的缓冲液和1 mL溴麝香草酚蓝标准液,充分振摇后,静置30 min,分取氯仿层,水层再用氯仿同法萃取2次,每次10 mL。合并氯仿层,回收至干,残留物用氯仿溶解,置于10 mL量瓶中,并用氯仿稀释到刻度,摇匀,同法制备空白溶液,在416 nm下分别测定其吸光度值〔5〕。
3.5结果与分析
3.5.1 半夏药材中三种主要成分的测定结果 按“3.1”、“3.2”、“3.3”、“3.4”项下方法测定来源不同的39份半夏药材中总有机酸、氨基酸、多糖和生物碱的含量。见表1。3.5.2 半夏药材中主要成分的聚类分析 采用SPSS17.0数据处理软件对测定结果进行处理,并采用Euclidean distance系数对不同产地半夏药材质量指标进行聚类分析。当阈值为10时,39个不同产地半夏药材样品被聚为3组:1、2、3、5、7、8、9、10、12、13、14、15、16、20、22、24、25、27、28、29、30、32、33、34、35、36、37、39聚为Ⅰ组;11聚为Ⅱ组;4、6、17、18、19、21、23、26、31、38聚为Ⅲ组。结合表1分析可以看出,第Ⅰ组除1、22、27、28、36、37号外其余都为云南、贵州地区,总有机酸含量多在0.401%~0.756%范围,且生物碱含量多数低于0.400%,第Ⅱ组产地为甘肃地区,氨基酸与多糖的含量较高,且氨基酸含量最高可达1.646%,第Ⅲ组除4号外产地都为四川地区,总有机酸和生物碱含量较高,总有机酸含量主要集中在1.841%~2.680%范围,生物碱含量主要集中在0.477%~0.706%范围。见图1。
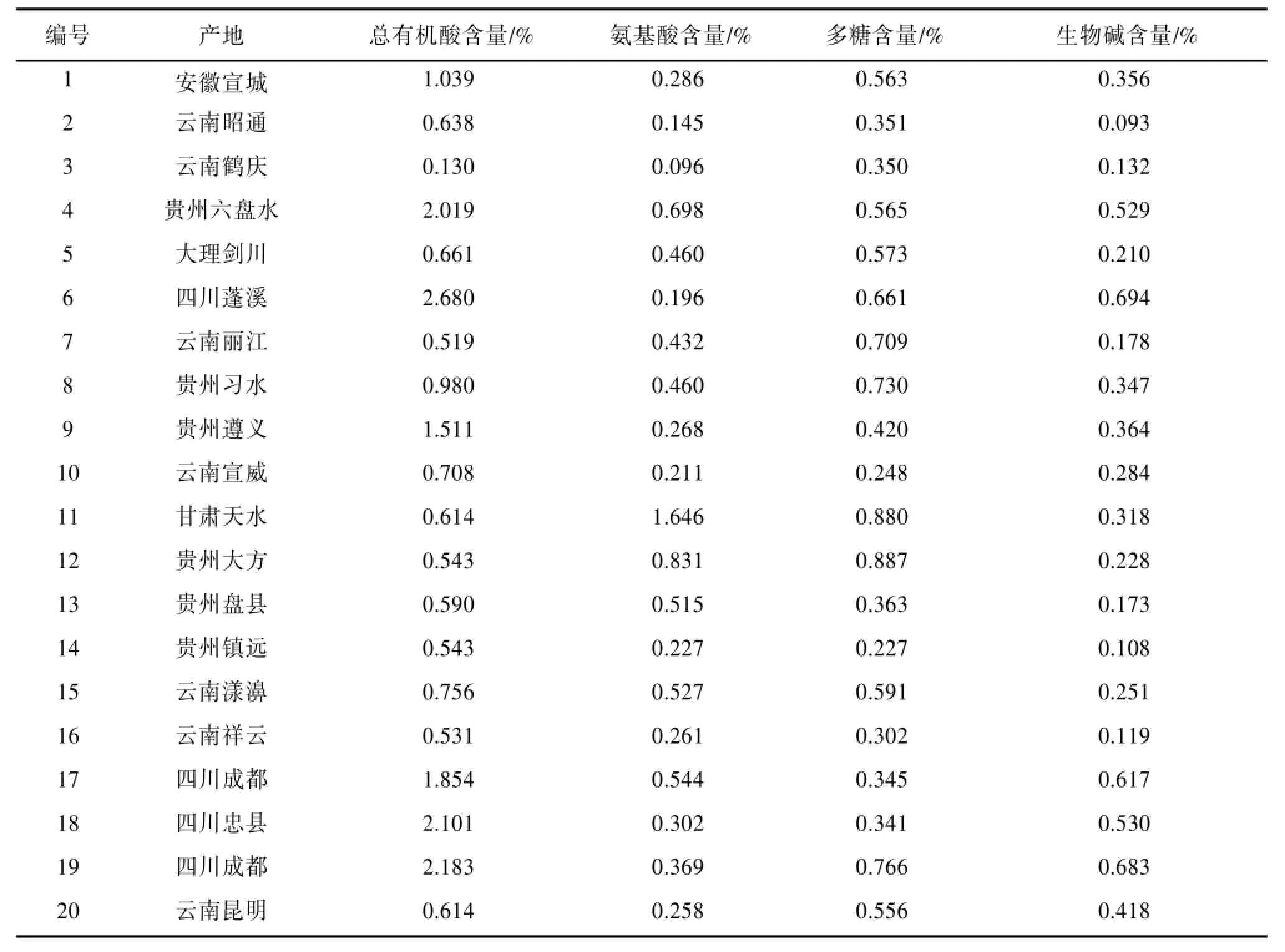
表1 半夏药材中总有机酸、氨基酸、多糖和生物碱的含量测定结果(n=3)
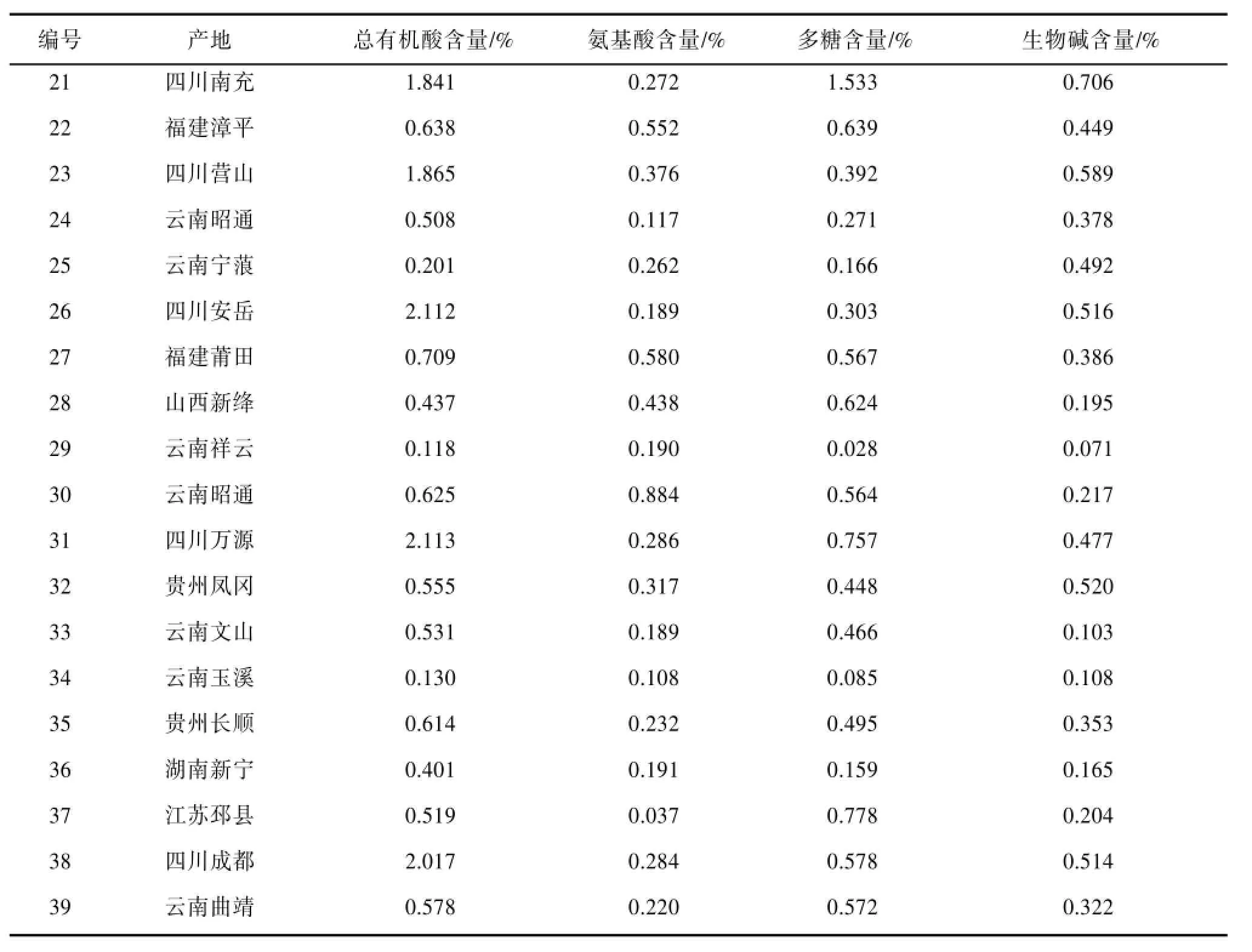
续表
4 讨论
从表1可以看出:不同产地半夏中总有机酸的含量差异显著,最低为0.118%,最高达2.680%。《中国药典》2010年版一部〔6〕收载的“半夏药材”中总有机酸含量规定为不得低于0.250%,所测的39份样品中有4份样品中有机酸的含量不合格,且这四份样品均产自云南,这是否与生长的环境因素有关,有待进一步研究。
半夏药材中氨基酸的含量差异性不及总有机酸的含量,最高为1.650%,最低为0.037%,但多数样本的氨基酸含量集中在0.108%~0.698%之间,表明产地对半夏中氨基酸含量的影响相对有机酸的影响小。与此同时,不同产地半夏药材中多糖的含量也具有明显的差异,最高含量可达1.533%,最低则为0.028%,但主要集中在0.103%~0.706%之间。而不同产地半夏药材中生物碱的含量在0.071%~0.706%之间,产地对生物碱含量影响较以上3个化学成分小。
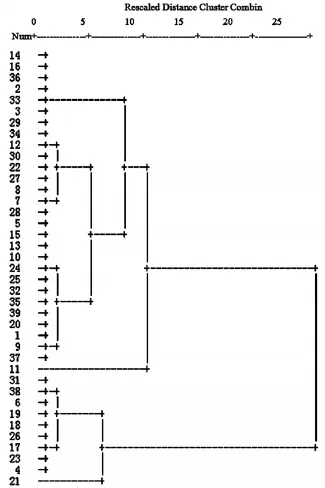
图1 39个不同产地半夏药材样品中主要成分的聚类分析
运用聚类分析对39个不同产地的半夏药材进行分析评价,结果表明不同产地半夏中总有机酸、氨基酸、多糖和生物碱含量有明显差异,以总有机酸来看,除3号、25号、29号、34号4个云南产的样品低于《中国药典》2010版一部规定的0.25%外,其余样品均符合要求。半夏喜温和、湿润气候,怕干旱,本文对半夏药材中的4种主要成分进行聚类分析,结果可知四川产的半夏药材综合质量最好,云南、贵州地区较四川质量较差。四川大部分地区属亚热带湿润气候,常年温暖湿润,半夏药材的分布较为集中,药材品质也较好,是我国半夏药材的主产区之一〔14〕,这与本文的分析结果一致。
此外,半夏药材现行质量标准中的【含量测定】项只测定总有机酸的含量,未规定氨基酸、多糖和生物碱的含量,而氨基酸、多糖和生物碱都为半夏药材的主要活性成分〔14〕,建议将其纳入半夏药材的质量标准中。
〔1〕龚千峰,丁安伟,孙秀梅,等.中药炮制学〔M〕.北京:中国中医药出版社,2003:324-330.
〔2〕许风清,吴浩,周倩.半夏药材中总有机酸的定量方法和含量测定研究〔J〕.南京中医药大学学报,2005,21(1):34-35.
〔3〕刘布鸣,梁凯妮,黄平,等.鲜品水半夏和水半夏药材中氨基酸成分分析〔J〕.广西中医药,2003,26(6):51-52.
〔4〕宋立人,洪恂,丁绪亮,等.现代中药学大辞典〔M〕.北京:人民卫生出版社,2001:743-747.
〔5〕邬浩杰.半夏总生物碱的含量测定〔J〕.海峡药学,2010,22(7):69-70,27.
〔6〕国家药典委员会.中华人民共和国药典:一部〔S〕.北京:中国医药科技出版社,2010:110.
〔7〕朱悦,丁安伟.炮制对中药材化学成分的影响〔J〕.中国药业,2007,16(6):59-60.
〔8〕曹玮娟,杨竹雅,梁晓原.紫外可见分光光度法测定山珠半夏中总游离氨基酸的含量〔J〕.云南中医学院报,2010,33(1):41-45.
〔9〕任雪峰,杨自嵘,王克众,等.苯酚-硫酸法测定人参果中多糖含量〔J〕.河西学院学报,2010,26(2):42-46.
〔10〕李景恩,聂少平,杨美艳,等.香薷中多糖含量的测定〔J〕.食品科学,2008,29(9):487-490.
〔11〕张晓静.硫酸蒽酮法测定半夏多糖的含量研究〔J〕.中国医药指南,2012,10(19):120-121.
〔12〕王玎伟,李海波,蒋学云.美洲大蠊药材中总氨基酸提取工艺优化研究〔J〕.大理学院学报,2008,7(12):3-5.
〔13〕范美华,周吉源.半夏的研究进展〔J〕.西北药学杂志,2004,19(2):90-92.
〔14〕葛秀允,吴晧.半夏的化学成分及质量评价方法〔J〕.中国药业,2009,18(9):3-5.
*通信作者:杨永寿,高级实验师.
(责任编辑 李 杨)
Comprehensive Quality Evaluation of Rhizoma Pinelliae from Different Origin by Clustering Analysis Method
FU Zhijin,HUANG Tao,CHEN Houjiang,ZHENG Xiaolei,YANG Yongshou*
(College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China)
Objective:To comprehensively compare and evaluate the quality of Pinellia ternate from different origin.Methods:Electrometric titration,UV spectrophotometry and sulfuric acid-anthrone method were applied to determine the organic acids,amino acids and polysaccharides.The results of the above were conducted cluster analysis for comprehensive evaluation.Results:The content of total organicacid,polysaccharide and amino acidsdiffered greatly in Pinellias ternate from different origins.Apart from No.3,No.25, No.29 and No.34 samples of Yunnan origin,the remaining samples passed the requirements of medicinal.Conclusion:The quality of Pinellia ternata was greatly influenced by the place of production.The cluster analysis could divide 39different Pinellia ternata into 3 categories.Type I were most from Yunnan and Guizhou areas,which showed lower total content of organic acids,amino acids and polysaccharides,as well as poorer comprehensive quality.Type III were from Sichuanarea,which showed higher content of total organic acidbettercomprehensivequality.
Pinelliaternate;different origin;clusteranalysis
R284
A
1672-2345(2014)02-0015-05
10.3969∕j.issn.1672-2345.2014.02.006
大理学院教学改革重点资助项目(JG200506)
2013-11-08
2013-12-10
甫志锦,药学专业2010级本科生.
