马铃薯体细胞杂种后代青枯病抗性鉴定及分子标记检测
2014-02-13李朋蔡兴奎陈琳柳俊
李朋,蔡兴奎,陈琳,柳俊
(华中农业大学生命科学技术学院,华中农业大学园艺植物生物学教育部重点实验室,国家蔬菜改良中心华中分中心,湖北武汉430070)
遗传育种
马铃薯体细胞杂种后代青枯病抗性鉴定及分子标记检测
李朋,蔡兴奎,陈琳,柳俊*
(华中农业大学生命科学技术学院,华中农业大学园艺植物生物学教育部重点实验室,国家蔬菜改良中心华中分中心,湖北武汉430070)
马铃薯(Solanum tuberosum L.)青枯病是由茄科雷尔氏菌(Ralstonia solanacearum)引起的一种毁灭性的细菌性土传病害。马铃薯青枯病抗性资源主要存在于一些野生种中,体细胞杂交是创制马铃薯青枯病抗性资源的一种有效途径。本研究以具有对青枯病抗性的体细胞杂种与栽培种杂交产生的100个后代为材料,对其进行青枯病抗性评价,旨在筛选可供育种利用的青枯病抗性资源。青枯病抗性鉴定结果表明,在试管苗组培鉴定中100个杂交后代共有6个基因型表型抗青枯病,温室钵栽接种鉴定有8个基因型表现为抗病,在两种接种鉴定中均表现为抗病的有3个基因型(07SF.3-79、07SF.6-8和07SF.6-5)。选用本实验室前期筛选的与青枯病抗性相关的4对SSR标记引物(STI0051、STI0054、STI0056、STI0057),对100个基因型进行分子标记检测,结果显示,有3个标记(STI0051.180、STI0054.180、STI0056.205)可以明确鉴定抗感基因型,它们表现为抗病稳定的3个基因型的标记位点与抗病对照的带型一致,而在感病对照中缺失,与表型鉴定结果吻合,表明筛选的SSR标记可以用于具有S.chacoense遗传背景材料的青枯病抗性辅助选择。
马铃薯;体细胞杂种;青枯病;抗性鉴定;分子标记
马铃薯(SolanumtuberosumL.)青枯病是由茄科雷尔氏菌(Ralstoniasolanacearum)引起的细菌性病害,由于细菌性病害的系统感染特性,导致其药物防治十分困难[1]。而且,马铃薯栽培种又缺乏抗性资源,因此导致马铃薯青枯病抗病育种十分困难。20世纪30~60年代期间,美国测试了普通栽培种的上万份品种和无性系,并未发现高抗青枯病的品种,只有少部分材料发病期比感病对照稍晚[2]。中国的研究人员也曾鉴定了育种单位选育的品种、高代无性系栽培种资源等400多份,结果显示几乎所有材料都表现中感或高感青枯病。因此,利用体细胞杂交获得携带野生种的青枯病抗性的种质资源是目前创制青枯病抗性资源的主要途径。20世纪末至21世纪初,国内外研究人员利用具有青枯病抗性的野生种与马铃薯栽培种进行体细胞杂交,获得了大批具有青枯病抗性的体细胞杂种。Laferriere等[3]利用野生种S.commersonii与栽培种双单倍体融合,再生的杂种植株其抗性水平显著高于感病对照品种‘Atlantic’和‘Superior’。Fock等[4]利用原始栽培种S.phureja与栽培种双单倍体进行融合,再生的体细胞杂种及其亲本植株进行室内青枯菌接种鉴定,结果表明,体细胞杂种植株对青枯菌生理小种1号和3号菌株均具有明显的抗性,其中杂种株系BP9的抗性水平显著高于抗性亲本S.phureja。他们又利用S.stenotomum与栽培种融合也得到了类似的结果[5]。本实验室蔡兴奎等[6]利用来自S.chacoense的一个抗青枯病的无性系与栽培种进行体细胞杂交,也获得了一批抗青枯病的体细胞杂种。然而,由于一些野生不良性状的累赘,这些杂种还不能直接用于育种。在前期的研究中,郭鲜蒲[7]利用一个抗青枯病且可以正常开花的体细胞杂种3c28-1为亲本,与栽培品种进行杂交成功并获得杂种后代,但这些杂种后代是否仍然具有青枯病抗性还不清楚。本研究对这些杂种后代进行了系统的青枯病抗性评价,以期筛选出可用于青枯病抗性育种的亲本材料。
1 材料与方法
1.1 材料
2007和2008年,3c28-1、3c35-3以及8c6-2与7个马铃薯四倍体栽培种优良品系进行有性杂交。3c28-1、3c35-3选自S.chacoense和3#的体细胞杂种后代,8c6-2选自S.chacoense和8#的体细胞杂种后代,它们均具有对青枯病的抗性,3#和8#是马铃薯品种‘中薯2号’经授粉诱导孤雌生殖产生的双单倍体。实生种子在无菌条件下发芽获得试管苗,获得8个组合的后代共100个基因型,杂交组合及后代数量列于表1。
1.2 方法
1.2.1 试管苗组培条件下接种鉴定
青枯菌选用生理小种1号、生理小种3号。青枯菌培养基配制方法按照本实验室青枯病菌培养操作指南进行(实验室内部资料未发表),涂皿后在37℃条件下培养48 h,用无菌水冲洗下菌株,使用紫外分光光度计测菌液浓度,稀释至0.1 OD,即1×108个/mL的浓度用于接种。
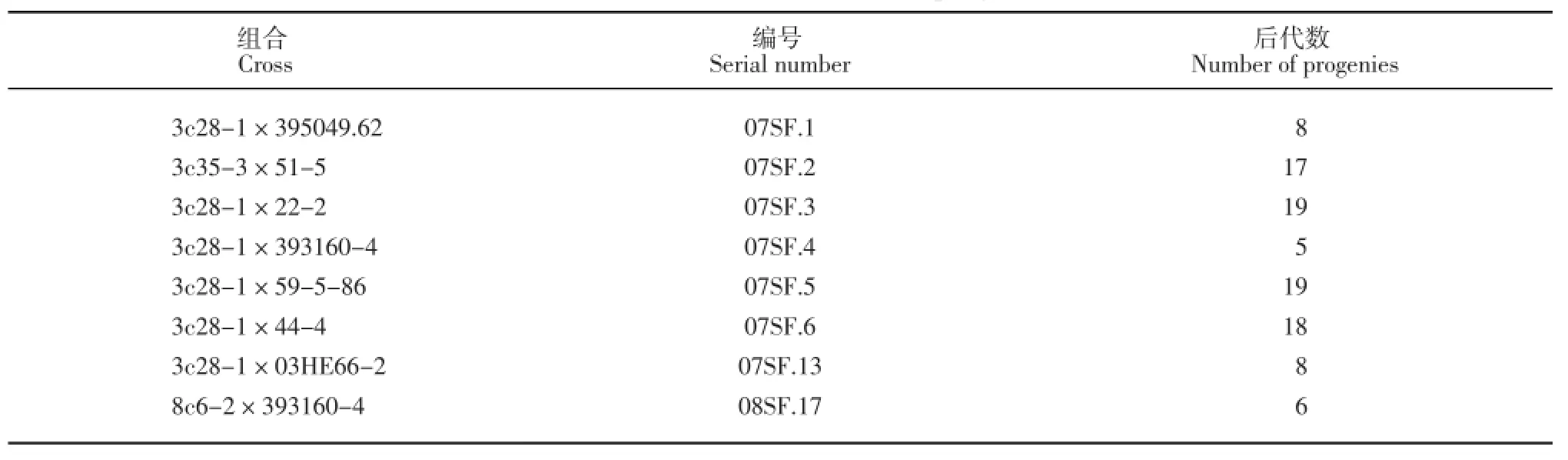
表1 杂交组合及后代数Table 1Cross combinations and progenies
每个基因型按照马铃薯切段培养方法每盒接入9个节段,在每天光照16 h、温度20℃的条件下培养3周,选用生长一致的试管苗4盒用于青枯病接种。接种使用手术刀片划“#”伤根后3盒注入菌液5 mL,1盒注入等量无菌水作为对照。置于25± 1℃,光照16 h/d的培养室培养。接种后每天观察发病情况,以抗病和感病对照差异最大(15 d左右)的时间点作为记录发病表型判别的记录时间。
1.2.2 试验材料的钵栽接种鉴定
选取生长状况良好的植株栽种于营养钵中,每个基因型栽种4钵,25℃温室培养3周,3钵使用手术刀片伤根后加入10 mL稀释后的菌液,1钵伤根后加入10 mL蒸馏水作为对照,白天气温控制在28℃左右,晚上保持在20℃以上,接种后每天观察发病情况。当抗病对照与感病对照出现差异时开始统计,统计方法及抗性评价标准同室内接种鉴定标准。
1.2.3 青枯病抗性评价
青枯病抗性评价参照本实验室前期建立的方法进行,根据发病情况分为0~4级:
0级为无叶片萎蔫;
1级为<25%叶片萎蔫;
2级为25%~50%叶片萎蔫;
3级为50%~75%叶片萎蔫;
4级为75%以上叶片萎蔫。
基因型抗(感)病确定:
0.0~1.0为抗病(R);
1.0~2.0为中抗(MR);
2.0~3.0为中感(MS);
3.0~4.0为感病(S)。
基因型病情指数计算:
病情指数=Σ(每个病级的植株数×级别数)/总植株数×最高级别数。
1.2.4 分子标记检测
实验采用前期实验室已筛选的与青枯病抗性相关SSR标记引物4对[7],引物信息与扩增条件见表2。
DNA的抽提、PCR扩增、PAGE胶检测等按照本实验室分子操作指南进行。

表2 研究涉及的SSR引物信息Table 2SSR primers used in experiment
2 结果与分析
2.1 体细胞杂种与栽培种杂交后代的青枯病抗性评价
2.1.1 组织培养条件下试管苗接种鉴定
接种采用前述的伤根法进行。对照基因型为体细胞杂种亲本、体细胞杂种融合亲本以及四倍体杂交亲本共13个,其中体细胞杂种亲本3c28-1、3c35-3、8c6-2以及野生种融合亲本S.chacoence(cha)为抗病对照,395049.62、51-5、59-5-86、44-4、22-2、393160-4、03HE66-2以及体细胞融合亲本3#和8#为感病对照。以抗病对
照与感病对照表现出最大差异时的发病情况作为评价时间点进行群体材料的抗病表型评价,试验结果分析以三次独立的生物学重复资料进行统计评价。
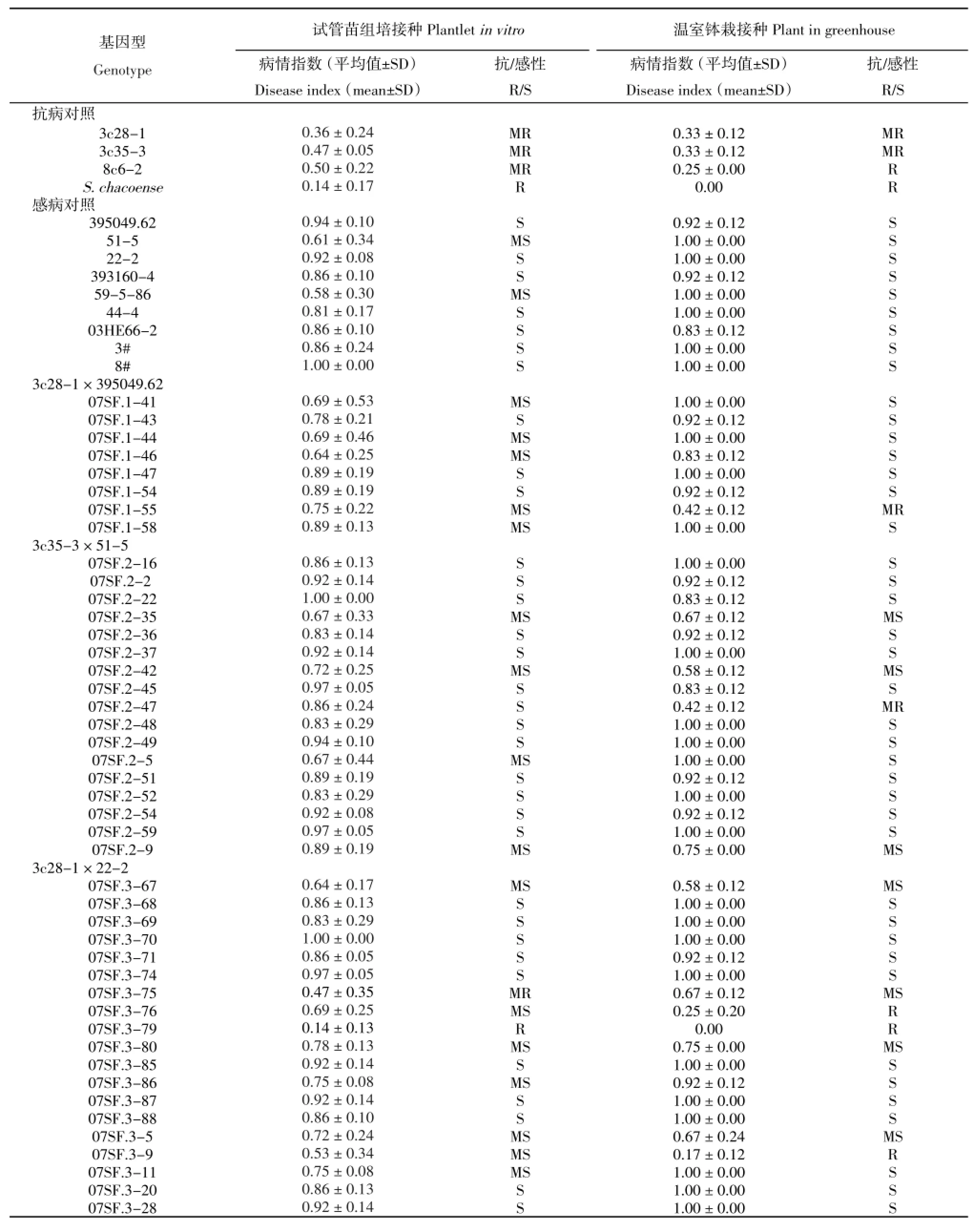
表3 体细胞杂种融合亲本,抗青枯病体细胞杂种及其与四倍体马铃薯品系杂交后代的青枯病抗性评价Table 3Evaluation for resistance toR.solanacearumof somatic hybrid parents,resistant somatic hybrids and progenies derived from crosses between resistant somatic hybrids and tetraploid potato breeding lines
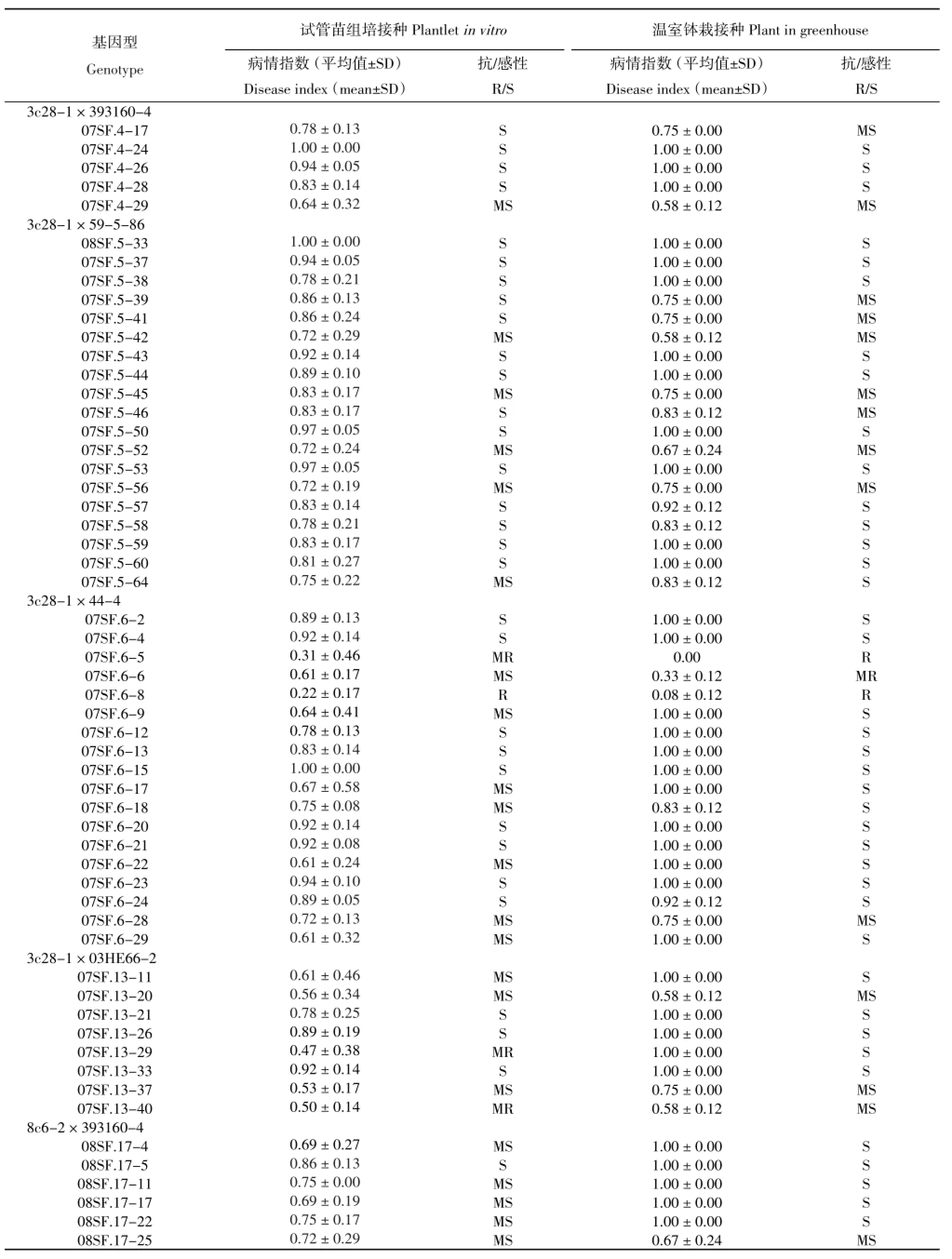
续表3
接种青枯病菌后观察显示,接种7 d后抗病对照与感病对照就开始出现表型的分化,感病材料出现下部叶片萎蔫,14 d后茎秆开始变黄脱水甚至整个植株死亡,而抗病对照萎蔫脱水现象都不明显。从表3可以看出,9个感病对照在本研究接种条件下均表现为感病,其中以融合亲本8#感病最严重,病情指数达到1。4个抗病对照均表现为抗病。来自8个组合的100个后代基因型的接种表型显示,只有6个基因型表现出抗病,其中07SF.3-79和07SF.6-8表型为抗病(R),07SF.6-5、07SF.13-29、07SF.13-40和07SF.3-75表现为中抗(MR),其余94个基因型均表现感病(表3)。
2.1.2 温室条件下钵载接种鉴定
体细胞杂种钵栽后,7~8叶时进行青枯病接种。接种青枯病菌后每天观察发病情况,接种4 d后抗病对照与感病对照就开始出现表型的分化,感病基因型出现下部叶片萎蔫,植株有倒伏趋势,7 d后植株开始变黄脱水萎蔫甚至整个植株死亡倒伏,而抗病对照萎蔫脱水现象并不明显。从表3可以看出,9个感病对照在本研究中均表现为感病,4个抗病对照表现为抗病或中抗,其中野生种融合亲本S.chacoence(cha)抗病性最强。杂种后代鉴定结果显示,92个基因型表现为感病,只有8个基因型表现为抗病,它们是:表现抗病的07SF.3-76、07SF.3-79、07SF.6-5、07SF.6-8和07SF.3-9;表现中抗的07SF.1-55、07SF.2-47和07SF.6-6。
2.2 青枯病抗性分子标记检测
研究选用实验室前期筛选的与青枯病抗性相关的4对SSR引物(STI0051、STI0054、STI0056和STI0057),对100个杂交后代及抗感亲本和对照进行了PCR扩增,其中STI0051有1个符合参考文献给定的分子量范围的目标带,根据相对分子量命名该标记为STI0051.180;STI0054、STI0056和STI0057均有2个符合分子量大小的目标带,根据相对分子量分别为STI0054.188、STI0054.180、STI0056.173、STI0056.205、STI0057.173、STI0057.180,即4对引物共产生7个标记。根据7个标记在所有基因型中的扩增结果分析显示,100个杂种基因型共扩增有316个标记位点,平均每个基因型3.16个。进一步分析显示,标记在基因型间的分布不均匀,有超过一半的基因型(57个)标记位点数在2~4个之间,其余43个基因型中,有13个基因型标记数最少(3个基因型未扩增出标记带,10个基因型只有一个标记带)。在20个标记位点较多的基因型中,携带有全部7个标记位点的基因型有2个(07SF.6-13、07SF.6-15),携带6个标记位点的基因型有4个(07SF.1-43、07SF.4-17、07SF.4-29、07SF.13-26),另有14个基因型携带有5个标记位点。
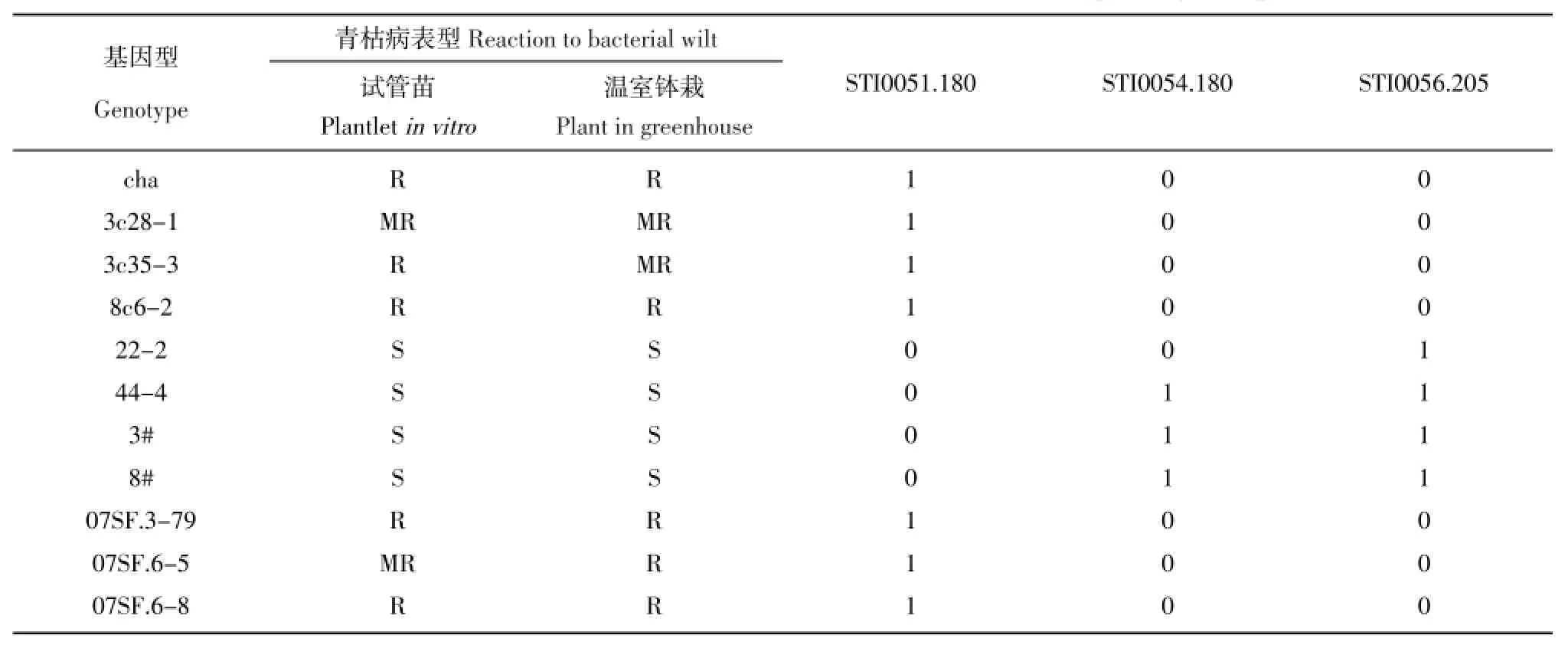
表43 个SSR标记在抗感基因型中的带型特征Table 4Band data of three SSR markers in resistant and susceptible genotypes
携带标记位点数与抗病表型相关性分析显示,二者之间并没有显著相关性。单个标记与抗青枯病相关分析也没有发现显著相关的标记。但将表现抗病稳定的3个基因型的标记位点与抗感基因型标记特征分析发现,有3个标记在3个抗病基因型中的带型与抗病对照一致,而与感病对照相反。标记STI0051.180,在抗病基因型中表型为有带,在感病基因型中表现为无带,3个杂种基因型均表现有带。STI0054.180和STI0056.205在抗病基因型中均表现无带,除STI0054.180在感病基因型22-2中也表现无带外,在其它感病基因型中均表现有带,3个抗病杂种基因型均表现无带(表4)。
3 讨论
本研究同时采用试管苗组培条件下接种和温室钵栽伤根接种方法鉴定了100个体细胞杂种与栽培种的杂交后代基因型的青枯病抗性。从整体看,体细胞杂种后代大部分基因型为感病基因型,两种鉴定方法共有11个基因型表现出不同程度的抗病性,其中,组培条件下鉴定有6个基因型表现不同程度的抗病性,钵栽伤根接种有8个基因型表现为抗病,两种鉴定方法均表现为抗病的只有3个基因型(07SF.3-79、07SF.6-8和07SF.6-5)。进一步分析其余8个基因型的鉴定的结果显示,其中有4个基因型均为中抗或者中感的差异,如07SF.1-55和07SF.6-6在组培条件下鉴定表现为MS,在温室条件下表现为MR;07SF.3-75和07SF.13-40在组培条件下鉴定表现为MR,在温室条件下表现为MS。另外4个基因型则至少在一个鉴定条件中表现为中抗或者中感,但在另一个条件下鉴定则偏向为抗或者感,如07SF.3-9和07SF.3-76,在组培条件下鉴定表现为MS,但在温室条件下表现为R;07SF.2-47在组培条件下鉴定表现为S,在温室条件下表现为MR;07SF.13-29在组培条件下鉴定表现为MR,在温室条件下表现为S。上述结果表明,当抗性级别较高时,无论采用何种方法鉴定,其表型相对稳定,而处于中抗和中感水平时,其鉴定方法对表型影响较大。尽管如此,但从整体看,两种接种方法的结果表型基本一致,因为占总数89%的感病基因型在两种条件下的表型是基本一致的(表3)。
从本研究中还可以看出,尽管由于杂交的困难,每个组合获得的后代数较少,但进一步分析显示,杂交后代抗病性基因型在组合间存在差异。本研究中至少在一种条件下表现抗病的11个基因型来自5个组合,且抗病亲本均为抗病性中等的体细胞杂种3c28-1;抗病亲本为体细胞杂种8c6-2的组合,后代均表现感病。这一结果表明,虽然都是抗病体细胞杂种,但这种抗性传递给后代的能力存在差异,造成这种差异的原因可能与不同体细胞杂种的染色体整合程度、位置等有关,但目前还缺少这一领域的深入研究。
以表型为评价依据的病害接种鉴定具有直观、试验无需特殊复杂操作等优点,但由于受环境控制难以完全一致的限制,会产生重复间结果不一致而影响判别。分子标记反应的是植物本身的遗传基础,采用分子标记辅助进行病害鉴定是未来抗病育种的方向。本研究利用前期筛选的4个与青枯病抗性相关的标记,对体细胞杂种与栽培种杂交产生的100个后代进行了检测,结果显示在3个抗性稳定的基因型中,其带型显示与抗病对照和抗病亲本一致,而与感病对照和感病亲本相反。这一结果表明,利用分子标记辅助鉴定抗病性是可能的。
[1]何礼远,康耀卫.植物青枯菌(Pseudomonas solanacearum)致病机理[J].自然科学进展,1995,5:7-15.
[2]Nielsen L,Haynes F.Resistance in Solanum tuberosum to Pseudomonas solanacearum[J].Am J Pot Res,1960,37:260-267.
[3]Laferriere L T,Helgeson J P,Allen C.Fertile Solanum tuberosum +S.commersonii somatic hybrids as sources of resistance to bacterial wilt caused by Ralstonia solancearum[J].Theor Appl Genet,1999,98:1272-1278.
[4]Fock I,Collonnier C,Purwito A,et al.Resistance to bacterial wilt in somatic hybrids between Solanum tuberosum and Solanum phureja[J].Plant Sci,2000,160:165-176.
[5]Fock I,Collonnier C,Luisetti J,et al.Use of Solanum stenotomum for introduction of resistance to bacterial wilt in somatic hybrids of potato[J].Plant Physiol Biochem,2001,39:899-908.
[6]蔡兴奎,柳俊,谢从华.马铃薯栽培种与野生种叶肉细胞融合及体细胞杂种鉴定[J].园艺学报,2004,31(5):623-626.
[7]郭鲜蒲.马铃薯体细胞杂种及其回交后代的遗传稳定性分析[D].武汉:华中农业大学,2011.
Evaluation of Resistance and Associated Molecular Markers of Bacterial Wilt
of Potato Somatic Hybrid Offspring
LI Peng,CAI Xingkui,CHEN Lin,LIU Jun*
(College of Life Sciences and Technology,Huazhong Agricultural University,Key Laboratory of Horticultural Plant Biology
(Huazhong Agricultural University),Ministry of Education,National Center for Vegetable Improvement
(Central China),Wuhan,Hubei 430070,China)
Ralstonia solanacearum,the causal pathogen of potato(Solanum tuberosum L.)bacterial wilt,is soil-borne and destructive for potato production.Somatic hybridization between S.tuberosum and wild relatives is an effective way to obtain germplasm possessing resistance to R.solanacearum.Evaluation of resistance to R.solanacearum on 100 progenies derived fromsomatichybridizationbetweenS.tuberosumandwildrelativeswereconductedinthisstudytoscreenforgermplasmsthat possessresistancetoR.solanacearumandarerelevanttobreeding.Theresultsshowedthatsixclonesexhibitedresistanceto the pathogen in vitro inoculation and eight clones performed resistance to the pathogen by the inoculation with greenhouse grownplantsamongthe100progenies.Noticeably,threeresistantclones(07SF.3-79,07SF.6-8and07SF.6-5)wereconsistent for resistance level in the two tests.Four SSRs(STI0051,STI0054,STI0056 and STI0057)previously identified were used to test all of the 100 clones mentioned above.The results demonstrated that three markers(STI0051.180,STI0054.180 and STI0056.205)could differentiate resistant genotype from susceptible ones.The three clones considered resistant in the two inoculations amplified the same bands as resistant control while they were absent in susceptible control.These were inaccordancewiththediseasephenotypingandsuggestanapplicationpotentialoftheseSSRsinmarker-assistantselectionof bacterialwiltresistanceintrogressedfromS.chacoense.
Solanum tuberosum;somatic hybrid;bacterial wilt;resistance evaluation;molecular marker
S532
A
1672-3635(2014)06-0321-07
2014-07-07
教育部创新团队(IRT13065);现代农业产业技术体系建设专项资金(CARS-10-P06)。
李朋(1989-),男,硕士研究生,研究方向为马铃薯生物技术育种。
柳俊,教授,研究方向为马铃薯生物技术育种,E-mail:liujun@mail.hzau.edu.cn。
