利用聚酰胺树脂分离纯化马铃薯皮中的黄酮类物质
2014-02-13张薇罗亚琴
张薇,罗亚琴
(1.湖南农业大学,湖南长沙410128;2.东方科技学院,湖南长沙410128)
栽培生理
利用聚酰胺树脂分离纯化马铃薯皮中的黄酮类物质
张薇1*,罗亚琴2
(1.湖南农业大学,湖南长沙410128;2.东方科技学院,湖南长沙410128)
利用聚酰胺树脂分离纯化马铃薯皮中的总黄酮,通过静态吸附试验和动态吸附试验研究了各因素对黄酮类物质的吸附及解吸附影响。结果表明,静态洗脱过程中,调节pH值为6左右,温度为30℃左右,振荡4 h后静置24 h,并采用浓度为70%乙醇作为洗脱液,即能获得最佳工艺;采用20 g聚酰胺树脂装层析柱的动态洗脱过程中,径高比为2.0/10.0(cm/cm),以70%乙醇作为洗脱液,即能获得动态的最佳工艺。
马铃薯皮;黄酮;聚酰胺树脂;分离纯化
马铃薯(Solanum tuberosum L.)为茄科植物,马铃薯中的黄酮类化合物是一种天然的抗氧化剂,具有抗A型流感病毒、消炎、抑制异常的毛细血管通透性增加及阻力下降、扩张冠状动脉、增加冠状流量、影响血压、改变体内酶活性、改善微循环、解痉、抑菌、抗肝炎病毒和抗肿瘤等作用,有很高的药用价值[1-6]。聚酰胺分离原理主要是靠吸附力,即聚酰胺中的酰氨基与化合物中的一些基团形成氢键而产生的吸附作用,由于各化合物结构不同,因而与聚酰胺形成氢键的能力不同,使化合物得以分离。聚酰胺柱层析法分离效果好,样品容量大,适于在制备分离工艺中应用。用聚酰胺层析柱对各种黄酮苷类进行分离,效果较好。本研究对马铃薯块茎中的黄酮类化合物进行提取,用聚酰胺树脂分离纯化马铃薯皮中总黄酮,进行效果的试验研究,获得该树脂分离纯化马铃薯皮中的黄酮的实验参数,包括pH值、料液浓度、洗脱液组成、洗脱流速、柱径高比等,以确定该树脂分离纯化马铃薯皮中黄酮的最佳条件。研究结果对马铃薯皮中黄酮的应用具有重要意义[7-9]。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料
芦丁标准品AR(中国食品药品检定所),99.8%乙醇AR、亚硝酸钠AR、硝酸铝AR、氢氧化钠AR(国药集团化学试剂有限公司),聚酰胺型号14-30目pH 6-7视比重小于0.25 g∕mL(浙江省台州市路桥四甲生化塑料厂)。
芦丁标准母液:准确称取0.0253 g芦丁标准品,用70%乙醇溶解,置于50 mL容量瓶中定容至刻度,得到浓度为0.0240 mg∕mL标准母液。
1.1.2 仪器
紫外分光光度计,UV-2450,日本岛津公司。
1.2 试验方法
1.2.1 马铃薯皮中提取液的制备
将新鲜马铃薯洗净,沥干水分,切碎(保留皮部分),取10.0 g湿马铃薯皮,放入500 mL圆底烧瓶中,按1:20(w:v)的料液比添加酒精溶液(10 g马铃薯添加200 mL 70%的乙醇),使用微波提取法(微波时间10 min,微波功率400 W的条件下,产率最高)提取黄酮[9,10],抽滤获得提取液,并将滤液用旋转蒸发仪浓缩到一定体积定容作为待用液。
1.2.2 黄酮含量的测定
1.2.2.1 马铃薯皮黄酮含量的测定——NaNO2-Al (NO3)3-NaOH比色法
黄酮母核中含有碱性氧原子,一般又多带酚羟基,能和Al3+产生黄色络合物,加入NaNO2溶液和NaOH,在碱性溶液中呈红色,溶液在一定波长处有最大吸收,显色反应在60 min内稳定。黄色的深浅与黄酮的含量呈一定的比例关系,可以用芦丁为对照品,用Al(NO3)3作为显色剂,因为吸光度与芦丁的浓度呈线性关系,采用分光光度法对总黄酮进行含量测定[2]。
1.2.2.2 测定波长的确定
分别移取芦丁标准母液0.00和10.00 mL于25.00 mL容量瓶中,分别加入1.00 mL 5%的NaNO2,摇匀后静置6 min,然后再加入1.00 mL 10%的Al(NO3)3,摇匀后静置6 min,加入10.00 mL 4%的NaOH,用70%乙醇定容至刻度,摇匀后静置15 min。以70%乙醇空白作参比,用UV-2450型紫外可见分光光度计在200~800 nm波长范围内进行光谱扫描,扫描最大吸收波长。
1.2.2.3 标准曲线的制备
分别准确移取0.00,1.00,2.00,3.00,4.00,5.00和6.00 mL浓度为0.0240 mg∕mL芦丁标准母液至25.00 mL容量瓶中,参照1.2.2.2中方法处理,以70%乙醇空白作参比,用UV-2450型紫外分光光度计在最大吸收波长处测定吸光度Y,绘制标准曲线。
1.2.2.4 马铃薯皮黄酮含量测定
准确移取10.00 mL黄酮提取液至25.00 mL容量瓶中,按1.2.2.1中方法处理,测定其吸光度,并结合标准曲线计算含量。
1.2.3 聚酰胺树脂的预处理
将聚酰胺树脂用适量的浓度95%乙醇浸洗24 h,至浸洗液加适量蒸馏水无白色浑浊现象时为止,再用水反复清洗干净至无醇味,加入浓度为2 mol∕L的NaOH溶液浸泡12 h,以水洗至中性;再用浓度为4 mol∕L的HCl溶液浸泡12 h,用蒸馏水洗至中性后,在60℃下烘干备用。
按下式计算树脂的吸附量Qe和吸附率q1:
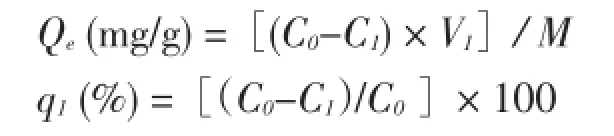
式中:
C0——原液质量浓度(mg∕mL);
C1——吸附液质量浓度(mg∕mL);
V1——溶液体积(mL);
M——干树脂重(g)。
按下式计算树脂的解析量Qd和解析率q2:
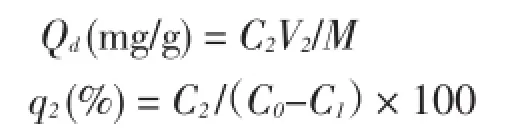
式中:
C0——原液质量浓度(mg∕mL);
C1——吸附液质量浓度(mg∕mL);
C2——解析液质量浓度(mg∕mL);
V2——解析液体积(mL)。
1.2.4 静态工艺条件考察
1.2.4.1 树脂的饱和吸附量
称取已处理好的聚酰胺树脂1.0 g共5份,置于100 mL三角瓶中,按料液比1∶10,1∶15,1∶20,1∶25和1∶30(g∕mL)的比例分别加入马铃薯皮粗提液(黄酮含量为0.053 mg∕mL),然后振荡吸附3 h,静置24 h,使其达到饱和吸附,吸取上层液测定吸光度,以吸附率为评价指标,考察树脂的饱和吸附量。
1.2.4.2 pH值对树脂吸附率的影响
黄酮类化合物为多羟基酚类,呈弱酸性,因此要找出吸附的最佳条件,即考察pH对树脂吸附性能的影响。准确称取已预处理好的聚酰胺树脂1.0 g共8份,置于100 mL三角瓶中,各加入20.00 mL马铃薯皮粗提液(黄酮含量为0.128 mg∕mL),并分别调节pH分别为2,3,4,5,6,7,8和9(用HCl或NaOH溶液调节溶液的pH值),置于30℃水浴摇床中分别振荡吸附3 h,振后静置24 h,使其达到饱和吸附,吸取上层液测定吸光度,以吸附率为评价指标,考察pH对树脂的吸附率的影响。
1.2.4.3 吸附时间对树脂吸附率的影响
称取已预处理好的聚酰胺树脂1.0 g共5份,置于100 mL三角瓶中,分别加入20.00 mL马铃薯皮粗提液(黄酮含量为0.054 mg∕mL),置于30℃水浴摇床中分别振荡1,2,3,4和5 h,振后静置24 h,使其达到饱和吸附,吸取上层液测定吸光度,以吸附率为评价指标,考察不同吸附时间对树脂的吸附量和吸附率的影响。
1.2.5 静态解析工艺条件考察
1.2.5.1 乙醇浓度对树脂解析率的影响
称取已预处理好的聚酰胺树脂1.0 g共8份,置于100 mL三角瓶中,分别加入20.00 mL马铃薯皮粗提液(黄酮含量0.053 mg∕mL),置于30℃水浴摇床中振荡3 h,振后静置24 h,使其达到饱和吸附,过滤溶液,分离树脂,分别加入20.00 mL 60%,70%,80%,90%和95%乙醇溶液,置于30℃水浴摇床中振荡2 h,过滤,测定滤液的吸光度,根据标准曲线得出浓度,考察不同乙醇浓度对树脂解析率的影响。
1.2.5.2 解析时间对树脂解析率的影响
称取已预处理好的聚酰胺树脂1.0 g共5份,置于100 mL三角瓶中,分别加入20.00 mL马铃薯皮粗提液(黄酮含量0.053 mg∕mL),置于30℃水浴摇床中振荡2 h,振后静置24 h,使其达到饱和吸附,过滤溶液,分离树脂,加入20 mL 80%乙醇溶液,置于30℃水浴摇床中振荡1,2,3,4和5 h,过滤,测定滤液的吸光度,根据标准曲线得出浓度,考察不同时间对树脂解析率的影响。
1.2.6 动态工艺条件考察
1.2.6.1 径高比对树脂吸附率的影响
根据聚酰胺树脂的吸附量和上样量设定一系列柱高,称取已处理好的聚酰胺树脂5.0,10.0,15.0和20.0 g,用湿法装柱,按径高比分别为2.0∶2.9,2.0∶5.2,2.0∶7.7和2.0∶10.0于同一型号(2.0 cm× 20 cm)的柱子中,将马铃薯皮粗提液(黄酮含量0.128 mg∕mL)2.5 mL加去离子水稀释至100 mL,以流速为2~3 mL∕min上样,收集流出液,测定流出液的黄酮含量,计算树脂吸附率。
1.2.6.2 洗脱液体积对损失率的影响
取已处理好的大孔吸附树脂20.0 g共3份,湿法装入层析柱中,将马铃薯皮黄酮粗提液2.5 mL稀释至25 mL上样,用25,50和75 mL去离子水冲洗,以流速2~3 mL∕min过柱,收集流出液,测流出液中黄酮含量,计算水洗体积对样品损失率。
1.2.6.3 最佳条件下的洗脱曲线
用经过预处理的聚酰胺树脂装入内径为2.0 cm的层析柱,使柱高为10.0 cm,将浓缩提取液过柱,采用上述试验确定的最佳参数即上样浓度为0.184 mg∕mL,pH为3.0和6.0,上样流速0.4 mL∕min,用70%的乙醇以0.4 mL∕min的流速洗脱。每5 min收集一管流出液,并且使用紫外分光光度计测定吸光度,并计算马铃薯皮黄酮浓度,以洗脱体积(mL)为横坐标,马铃薯皮黄酮浓度(mg∕mL)为纵坐标,绘制洗脱曲线。
2 结果与分析
2.1 最大吸收波长的确定
按1.2.2.2试验方法,以蒸馏水空白作参比,在300~800 nm波长范围内,扫描测定其最大吸收波长。从扫描结果可知,芦丁与显色剂在503 nm处有较好的吸收峰,因此选取503 nm为最大吸收峰。
2.2 芦丁标准曲线的绘制
在503 nm波长下,以蒸馏水空白为参比,以浓度(mg∕L)为横坐标,吸光度为纵坐标,绘制标准曲线图,得到线性回归方程为:Y=10.27425X-0.04713,R2=0.9930,说明在浓度0.012~0.060 mg∕mL范围内线性关系良好。
2.3 马铃薯皮黄酮含量测定
根据Y-X曲线方程和下列公式计算样品浓度和黄酮提取率。
黄酮浓度X(mg∕L)=(Y+0.04713)∕10.27425×n式中:
Y——样品的吸光值;
n——稀释倍数。
马铃薯皮黄酮提取率(%)=X×V×10-6∕原料质量×100
式中:
X——黄酮浓度(mg∕L));
V——浸提液体积(mL)。
2.4 静态吸附工艺条件研究
2.4.1 树脂的饱和吸附量
按照1.2.4.1方法,考察树脂的饱和吸附量,结果如图1所示。
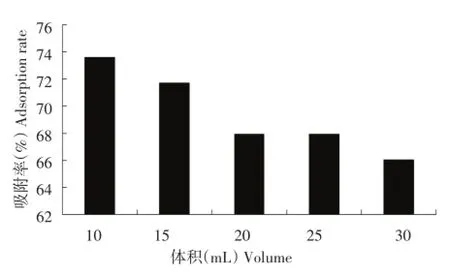
图1 树脂的饱和吸附量Figure 1Saturated adsorption capacity of resin
由图1可知,树脂的饱和吸附量在体积为20.00 mL时趋于稳定,故选择20.00 mL作为最佳吸附量。
2.4.2 pH对树脂吸附率的影响
通过1.2.4.2 pH值对树脂吸附率的影响的试验,结果如图2所示。
由图2可以看出,pH值对吸附量影响较大,随着pH值的增加,吸附量也增加,当吸附液浓度pH在4~6左右时具有良好的吸附率,且粗提液的浓度pH值在5~6附近,所以吸附液无需调pH。但为了准确性,在吸附液浓度pH值为3左右时也进行了测定作对比。
2.4.3 吸附时间对树脂吸附率的影响
按照1.2.4.3方法,考察不同吸附时间对树脂吸附率的影响,结果如图3所示。
由图3可看出,随着吸附时间增加吸附率也随着增加,但是吸附时间达到4 h后,吸附率增加速率变得慢。进而,以4 h作为最佳吸附时间。
2.5 静态解析工艺条件结果
2.5.1 乙醇浓度对树脂解析率的影响
按照1.2.5.1方法考察不同浓度乙醇对树脂解析率的影响,结果如图4所示。
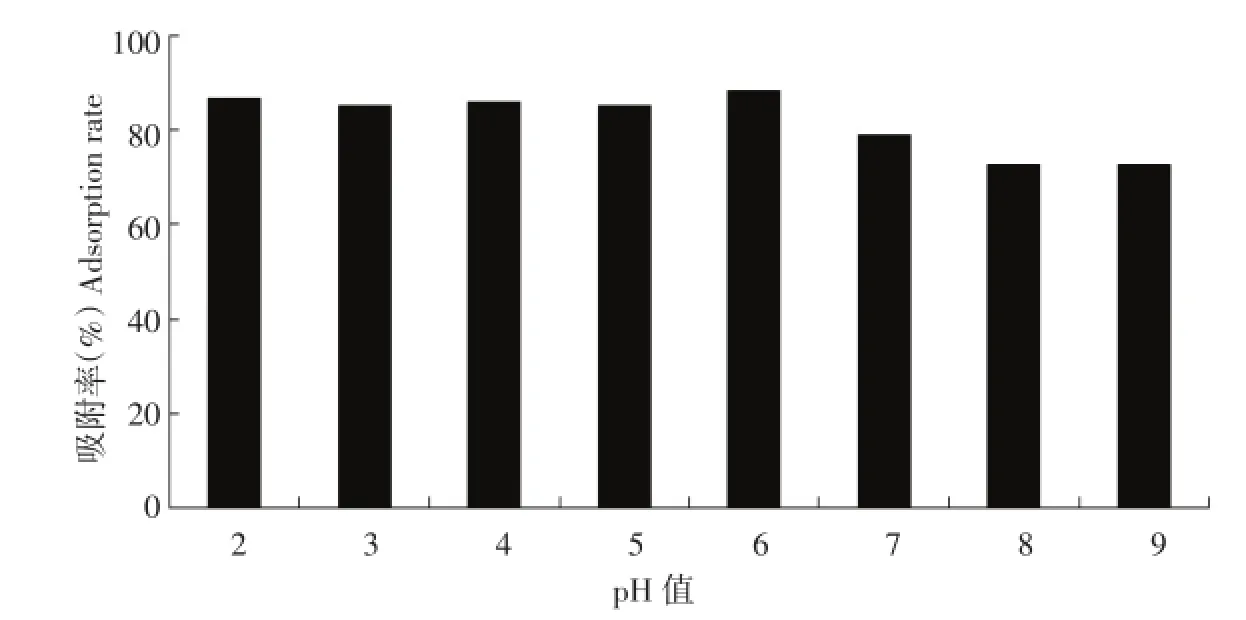
图2 不同pH对树脂吸附率的影响Figure 2Effect of pH on adsorption rate of resin
解吸是衡量聚酰胺树脂分离天然产物的又一大重要参数。由图4可看出,不同的乙醇浓度对树脂的洗脱率随着乙醇浓度上升而增强,虽然在95%的洗脱率最高,但考虑稳定因素与经济原因,选定70%乙醇作为最佳洗脱浓度。
2.5.2 解析时间对树脂解析率的影响
按照1.2.5.2方法,考察不同解析时间对树脂解析率的影响,结果如图5所示。
由图5可知,解析率随着震荡时间的增长先有增加的趋势,但超过4 h吸附率趋于平缓,相差不大。根据实际情况分析,选择震荡4 h作为最佳解析震荡时间条件。
2.6 动态工艺的研究
2.6.1 径高比对树脂吸附量的影响
按照1.2.6.1方法,考察不同径高比对树脂吸附率的影响,结果如表1所示。
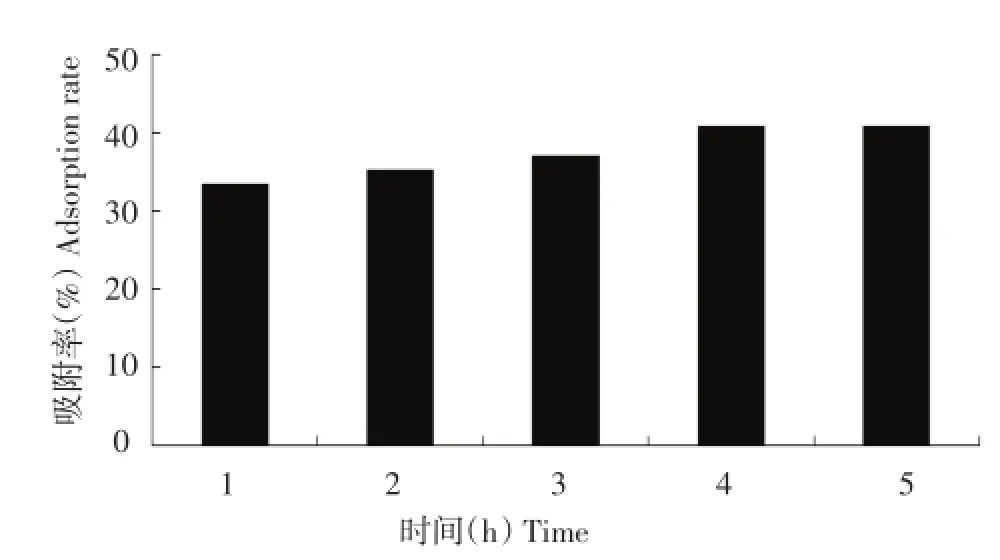
图3 不同吸附时间对树脂吸附率的影响Figure 3Effect of adsorption time on rate of resin adsorption
由表1可知,径高比越大越有利于吸附,柱高为10.0 cm时,上样时可观察到吸附过程中的稳定性好,马铃薯皮粗提物在聚酰胺树脂上呈现明显的梯度变化,同时吸附时间适宜;小于10.0 cm时,洗脱时间太短,分离效果较差;且2.0∶10.0接近于层析柱(2.0 cm×20 cm)高的2∕3,故选择2.0∶10.0的径高比条件,即使用20 g树脂装柱为最佳。
2.6.2 样品上柱水洗体积对回收率的影响
按照1.2.6.2方法,考察不同上样水洗体积对回收率的影响,结果如表2所示。
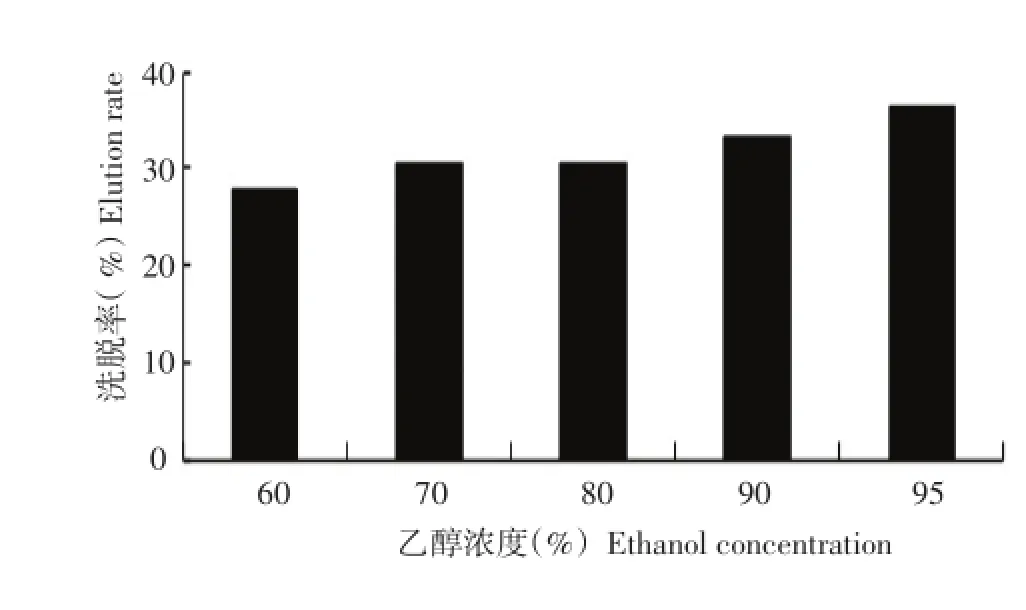
图4 乙醇浓度对洗脱率的影响Figure 4Effect of ethanol concentration on elution rate
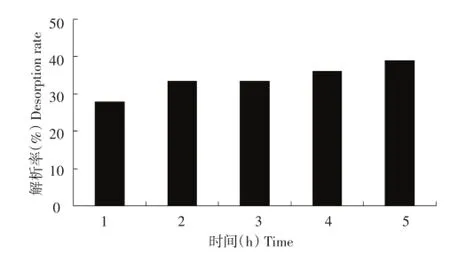
图5 解析时间对解析率的影响Figure 5Effect of desorption time on desorption rate
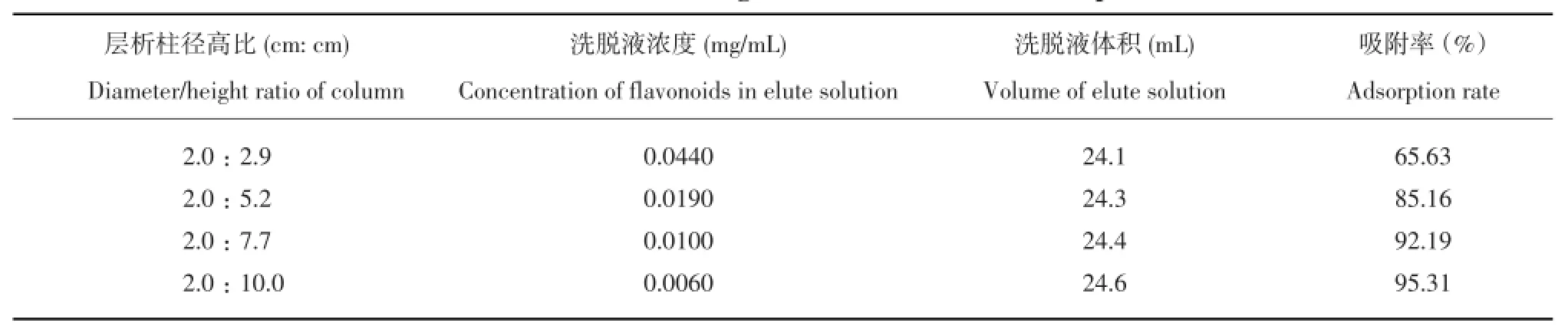
表1 层析柱径高比对树脂吸附率的影响Table 1Effect of diameter/height ratio of column on adsorption rate

表2 上样水洗体积对回收率的影响Table 2Effect of sample water volume on recovery rate
试验结果表明,随着上样后水洗体积的增加,损失浓度有所上升(此未得到一样体积),25 mL水洗虽然损失最小,但略为不够充分,而50 mL水洗相对25 mL水洗更为充分,故选择50 mL水洗作为最佳工艺条件。
2.6.3 洗脱曲线
通过1.2.6.3最佳条件下的洗脱曲线试验,结果见图6、图7。
由两组数据图可看出,呈现聚酰胺层析柱分离纯化马铃薯黄酮的洗脱曲线对称性较好,峰面积较好,在pH为6时,洗脱用量在34 mL左右与pH为3时,洗脱用量55 mL左右,有一个微小的峰,可能是黄铜类化合物中不同组分的物质被分离了。综上所述,选pH为6聚酰胺树脂分离纯化马铃薯皮黄酮具有较好的效果。
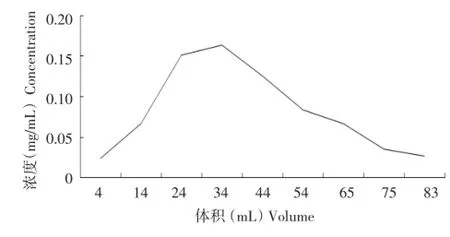
图6 pH为6的洗脱曲线Figure 6Elution curve when pH value set at 6
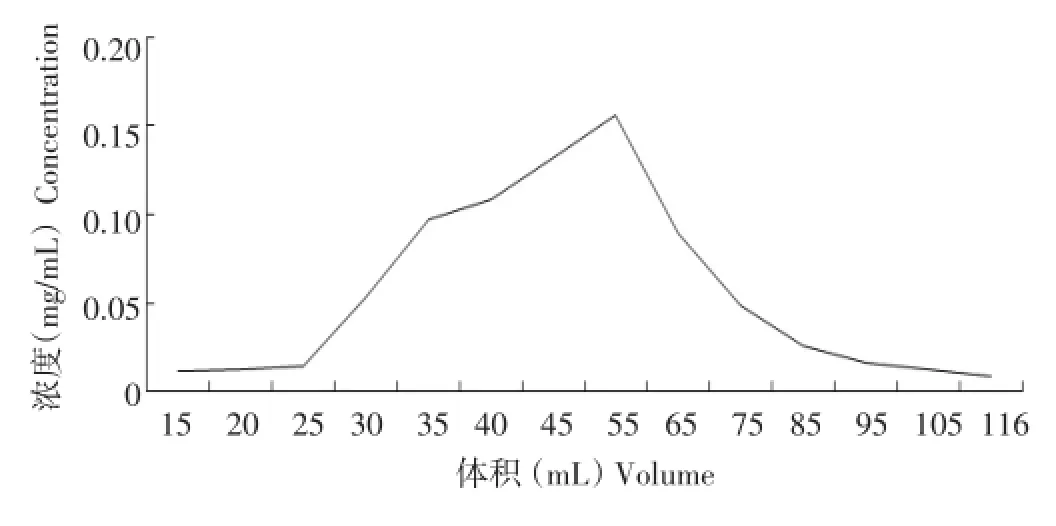
图7 pH为3的洗脱曲线Figure 7Elution curve when pH value set at 3
3 讨论
本研究以马铃薯皮黄酮提取物为研究对象,通过聚酰胺树脂对马铃薯皮提取物中黄酮类化合物的吸附及其解析性能试验,用聚酰胺树脂对马铃薯皮中提取的黄酮类化合物进行分离纯化。聚酰胺树脂对马铃薯皮提取物的分离纯化效果好[11,12],聚酰胺树脂对于黄酮的吸附率和解析率达到95.31%和30.56%。通过静态吸附和解析试验可知,马铃薯皮黄酮提取物在30℃、pH为6条件下,经过4 h吸附能达到好的吸附,以70%乙醇溶液在30℃条件下,振荡4 h可得到较好的静态洗脱效果;选用20 g聚酰胺树脂装入2.0 cm×20.0 cm规格的层析柱中,径高比为2.0:10.0,得到较好的洗脱效果。通过柱层析试验可知,聚酰胺树脂分离纯化马铃薯皮黄酮的较好条件是:马铃薯皮黄酮粗提液上样浓度为0.184 mg∕mL、pH为6左右、上样流速为2~3 mL∕min,以70%乙醇作为洗脱剂。使用内径为2.0 cm、柱高10.0 cm的聚酰胺层析柱可达到较好的分离纯化效果。
[1]李磊,王岳飞,粱燕,等.天然抗氧化物质的保健功能及抗氧化活性研究进展[J].茶叶,2008,34(2):70-74.
[2]张薇,赵杰,郭家骏,等.马铃薯中黄酮类物质测定及抗氧化性能的研究[J].中国马铃薯,2013,27(5):265-272.
[3]Lewis C E,Walker J R L,Lancaster J E,et al.Determination of anthocyanins,flavonoids and phenolic acids in potatoes.I: Coloured cultivars of Solanum tuberosum L.[J].Journal of the Science of Food and Agriculture,1998,77(1):45-57.
[4]陈丛瑾,黄克瀛,李德良,等.植物中黄酮类化合物的提取方法研究概况[J].生物质化学工程,2007,41(3):42-44.
[5]宋秋华,张磊,梁飞,等.黄酮类化合物提取和纯化工艺研究进展[J].山西化工,2007,27(4):24-27.
[6]翟梅枝,郭琪,贾彩霞,等.大孔树脂分离纯化核桃青皮总黄酮的研究[J].生物质化学工程,2008,42(3):21-25.
[7]杨武英,上官新晨,徐明生,等.聚酰胺树脂精制青钱柳黄酮的研究[J].天然产物的研究与开发,2008,20(2):320-324.
[8]田燕.黄酮类化合物在聚酰胺树脂上的层析行为[J].大连医科大学学报,2002,24(2):147-148.
[9]刘峙嵘,俞自由,方裕勋,等.微波萃取银杏叶黄酮类化合物[J].东华理工学院学报,2005,28(2):151-154.
[10]叶春,范家佑,杨根琴,等.微波辅助提取鱼腥草叶总黄酮的工艺研究[J].中国酿造,2009,28(1):134-137.
[11]李辰,袁健,邸多隆,等.5种大孔树脂对沙棘叶黄酮苷元的静态吸附、解吸附性能[J].精细化工,2007,24(7):658.
[12]陆英,李洁,邱文敏,等.大孔树脂分离纯化鼠曲草中黄酮类化合物研究[J].湖南农业大学学报(自然科学版),2009,35(5):497-500.
Separation and Purification of Flavonoids from Potato
Peel with Polyamide Resin
ZHANG Wei1*,LUO Yaqin2
(1.Hunan Agricultural University,Changsha,Hunan 410128,China;
2.Oriental Institute of Science and Technology,Changsha,Hunan 410128,China)
The effectiveness of separation and purification of total flavonoids from potato peel with polyamide resin was studied.Both static adsorption experiments and dynamic adsorption experiments were conducted to study the effects of various factors on the adsorption and desorption of flavonoids.The optimal desorption conditions for static adsorption were determined as being 70%ethanol as desorption solution,pH value at 6,temperature at 30℃,and oscillation for 4 hours following by store for 24 hours.For 20 g of polyamide resin,the optimal desorption conditions for dynamic adsorption were determined as being 70%ethanol as desorption solution,and 2.0/10.0(cm/cm)for diameter to height ratio of the chromatographiccolumn.
potato peel;flavonoid;polyamide resin;separation and purification
S532
B
1672-3635(2014)03-0138-06
2014-02-27
湖南省科学技术厅科技计划项目(2012NK3083);湖南省自然科学基金项目(11JJ3029)。
张薇(1962-),女,教授,主要从事应用化学研究。
张薇,E-mail:zhangwei6261@hotmail.com。
