不同照射野等中心的胸腹部大体积肿瘤调强计划间的剂量学差异
2014-02-11朱小杨明2浙江大学医学院附属第二医院放疗科杭州30009
朱小杨 王 明2(浙江大学医学院附属第二医院放疗科 杭州 30009)
2(河南省沧州市中心医院放疗科 沧州 061001)
不同照射野等中心的胸腹部大体积肿瘤调强计划间的剂量学差异
朱小杨1王 明21(浙江大学医学院附属第二医院放疗科 杭州 310009)
2(河南省沧州市中心医院放疗科 沧州 061001)
选取9例左侧乳腺癌根治术后患者和13例食管癌患者,所有PTV均包括锁骨上区域,分别采用不同的照射野等中心(PTV中心和卷入PTV内的肺体积情况确定的中心)制定不同的调强计划(IMRT-PTV和IMRT-肺),根据剂量体积直方图(DVH)分析两种计划中的 PTV和正常组织在剂量学上的差异。结果显示,IMRT-肺计划能显著降低左侧乳腺癌根治术后患者的左肺V20和心脏V30剂量(t=-6.154、-5.084,p=0.038、0.040),能显著减少食管癌的左肺 V20、V30、右肺 V30和心脏 V40值(t=-7.493、-8.092、-6.332、-6.945,p=0.025、0.019、0.042、0.032),但并不能降低其他正常组织的剂量。结果表明根据卷入PTV内的肺体积情况调整照射野等中心位置能降低靶区周边的部分正常组织剂量。
等中心位置,大体积肿瘤,调强,剂量学
治疗技术、射线性质与能量、小机头角度、射野方向、射野数目与大小、MLC叶片宽度及各种附件等[1-3]的使用,均影响到放疗计划的剂量分布。由于胸腹部内脏器官较多,对胸腹部大体积肿瘤而言,周围正常组织的耐受剂量往往是限制放疗处方剂量提升或影响放疗靶区适形性和均匀性的关键因素,且通过常规的调整手段往往解决不了靶区剂量提升与正常组织耐受之间的矛盾。为此,本研究选取22例胸腹部大体积肿瘤(其中9例左侧乳腺癌根治术后,13例食管癌,靶区均包含了锁骨上区域),采用调整照射野等中心位置和固定铅门技术来制定调强放疗计划,探讨照射野中心调整对大体积肿瘤分段优化计划的剂量学的影响。
1 资料与方法
1.1 临床资料
选取经组织病理学证实的22例胸腹部肿瘤,其中9例左侧乳腺癌根治术后(病理均为侵润性导管癌)和13例食管癌(病理为鳞状细胞癌或腺癌),年龄38-65岁,中位年龄48岁,男7例,女15例,所有患者靶区均含锁骨上区域。食管癌患者仰卧位于体膜板上,并用体膜固定,乳腺癌患者仰卧于碳纤维乳腺托架之上,均由大孔径 CT模拟机(GE Medical Systems, Milwaukee, U.S.) 完成CT扫描,获取患者的定位CT影像数据。扫描范围为颈、胸和上腹部,层厚 3.75 mm,图像经网络传输至Eclipse10.0治疗计划系统(美国Varian公司)。
1.2 靶区和危及器官勾画
医师在定位CT影像上按影像学和临床检查结果逐层勾画出临床靶区(CTV),其中包括锁骨上区。在CTV的基础上各个方向外扩5 mm得到计划靶区(PTV),并根据实际情况作适当修改。PTV前界不超过皮肤表面下 3 mm。邻近危及器官如脊髓、双肺、心脏和健侧乳腺(仅在乳腺癌中勾画)均在定位CT图像上逐层画出。
1.3 计划设计
1.3.1 以肺体积分段的调强计划(IMRT-肺)
从射野方向观上看,以肺体积进入照射野内最少的情况考虑,将靶区划为上下两部分:上部分为锁骨区,下部分为胸壁区(乳腺癌)或胸腔区(食管癌)。照射野等中心位置则设在上下两部分的分界线上,然后根据PTV和周围正常组织情况,选择机架角度和小机头角度,制定相应的6 MV X-射线的7野调强放疗计划。7个照射野均采用固定铅门技术,分别在锁骨区设3野和胸部区或胸腔区设4野。乳腺癌设野:锁骨区是2个切线野和1个前野,胸壁区设包绕肺体积最小的2个切线野和2个完全去除肺体积的切线野,同侧切线野角度相距 5-20º,以两肺卷入照射野内体积最小为原则。食管癌设野:锁骨区设3野和胸腔区设4野,以避开脊髓和两肺卷入照射野内体积最少为原则。乳腺癌和食管癌的大体积靶区上下分段和铅门固定方法参见图 1。处方剂量均为2 Gy/次,共25次,总剂量为50 Gy,要求95%的靶区体积达到处方剂量。左侧乳腺癌根治术后的正常组织最大照射耐受剂量限值:脊髓≤40 Gy、右侧乳腺≤5 Gy、左肺V20<28%、心脏V30<10%。食管癌的正常组织最大照射耐受剂量限值:脊髓≤45Gy、肺V20<28%、肺V30<20%、心脏V30<40%、心脏V40<30%。
1.3.2 以PTV中心分段的调强计划(IMRT-PTV)
采用乳腺癌和食管癌的 PTV中心为照射野等中心,以中心为界划为上下界,分别对PTV进行设计7野固定铅门的调强放疗计划,处方剂量与正常组织的耐受剂量要求与IMRT-肺的要求相同。
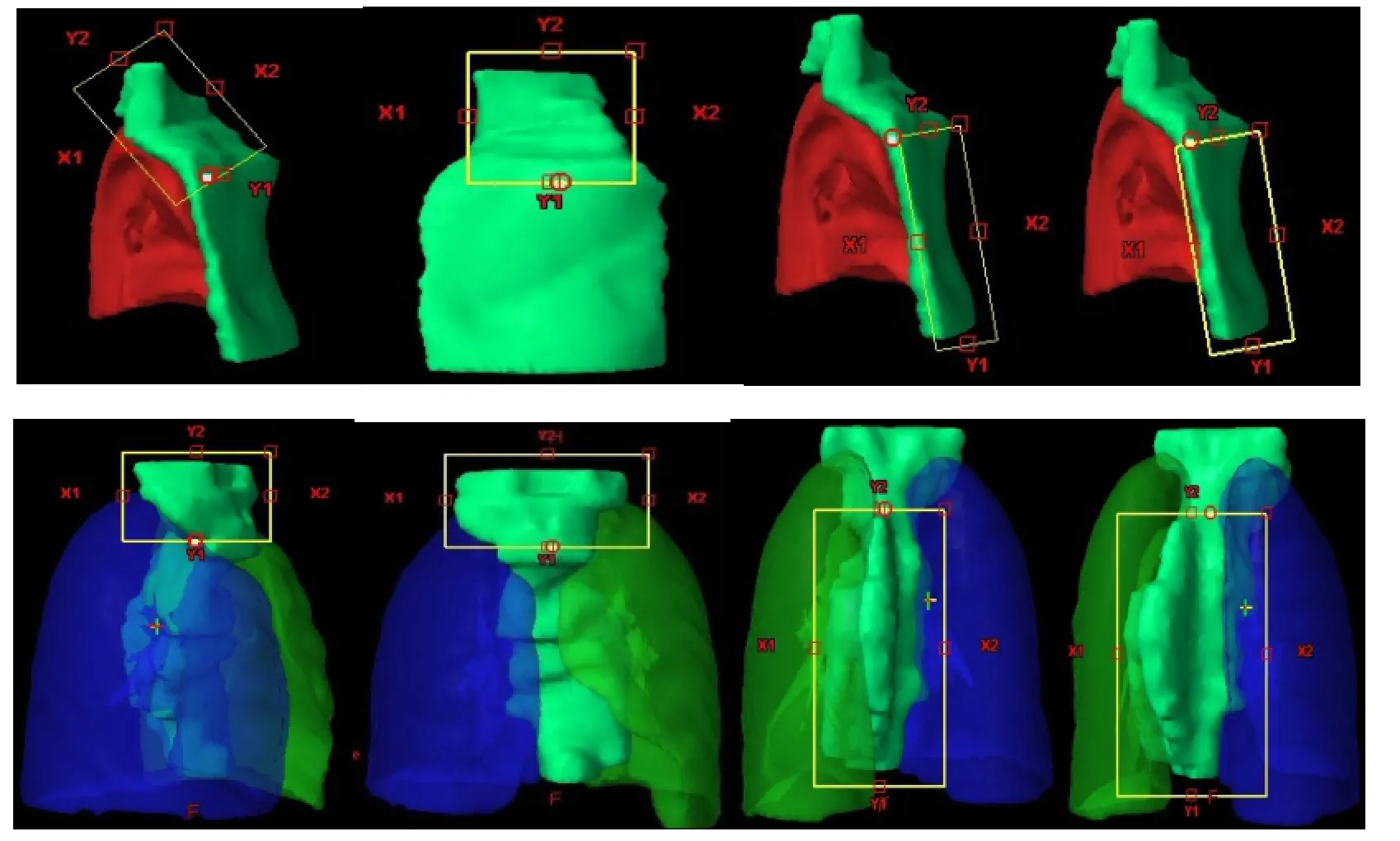
图1 靶区上下分段和铅门固定方法Fig.1 Split target volume and fixed jaw
1.4 统计学处理
采用SPSS 16.0统计软件进行统计分析,组间行配对t检验,结果以x±s表示,显著性检验水平设为0.05。
1.5 观察比较指标
使用剂量体积直方图(DVH)评估靶区和危及器官的剂量分布,评估参数包括:①靶区最小剂量、最大剂量和平均剂量;②靶区的均匀指数(HI[4]):HI=D5%/D95%,HI值越大表明不均匀性越大;③靶区适形指数(CI[5]):CI=(VT.ref/VT)×(VT.ref/Vref),适形指数值为0-1,CI值越大表示适形度越好。④双肺、心脏、右侧乳腺和脊髓等正常组织按照剂量体积直方图(DVH)来评价。
2 结果
两种大体积肿瘤的IMRT-肺与IMRT-PTV均能使靶区达到相应处方剂量,虽然整体上IMRT-肺的HI和CI在数值上稍逊于IMRT-PTV,但两种计划间的差异并无统计学意义,详见表1。
表2为根据不同照射野等中心制定的左侧乳腺癌根治术后调强计划危及器官剂量比较结果,发现IMRT-肺中的左侧肺V20和心脏V30剂量指标明显降低(t=-6.154、-5.084,p=0.038、0.040),而其他正常组织间的差异无统计学意义。
表3为根据不同照射野等中心制定的食管癌调强计划的危及器官剂量比较结果。IMRT-肺中的左肺 V20、V30、右肺 V30和心脏 V40均显著降低(t=-7.493、-8.092、-6.332、-6.945,p=0.025、0.019、0.042、0.032),而其他正常组织如左肺V5、右肺V5、右肺V20、心脏V30和脊髓Dmax间的剂量差异无统计学意义。
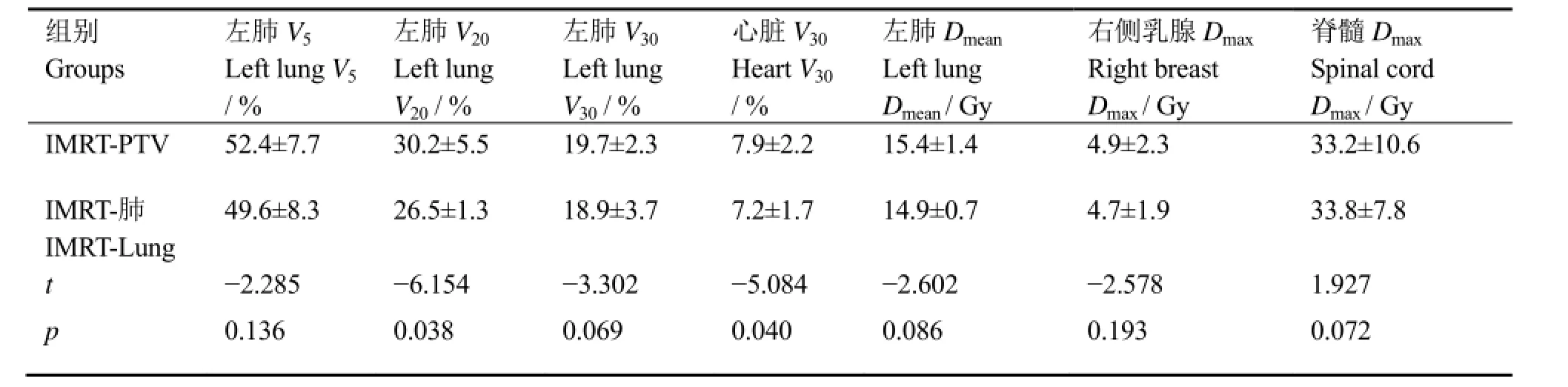
表2 9例左侧乳腺癌根治术后患者的正常组织剂量指标Table 2 Dose index of normal tissues from 9 patients with left breast cancer after radical mastectomy (x±s)
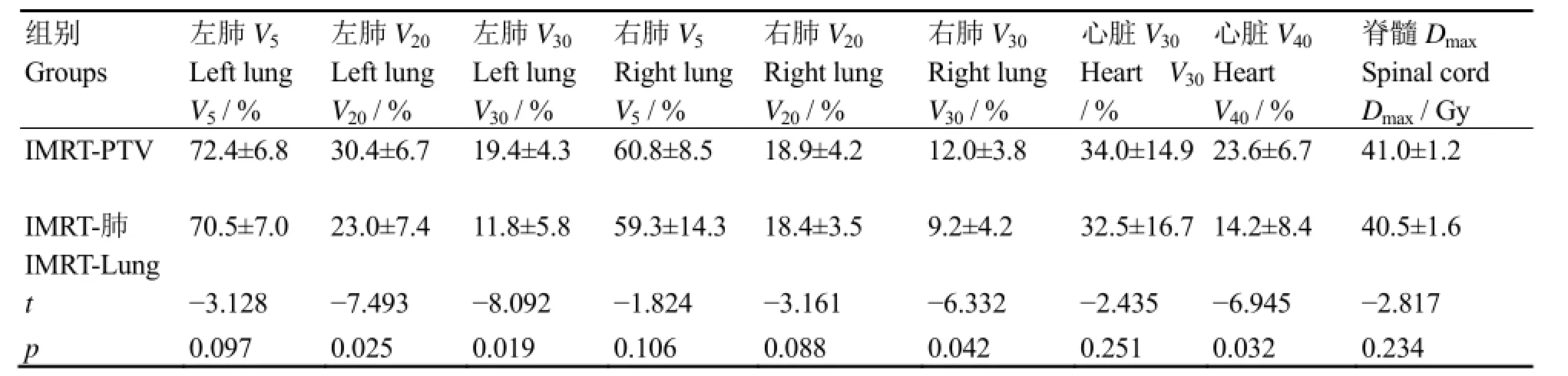
表3 13例食管癌患者的正常组织剂量指标Table 2 Dose index of normal tissues from 13 patients with esophagus cancer (x±s)
3 讨论
目前调强已是临床上使用最普及的一种放疗技术。随着技术的提高,以往一些分期较晚或者有淋巴结转移的大靶区病例也都逐渐借用调强手段来实现根治性放疗或尽可能地降低副反应。
放射性肺炎是胸腹部恶性肿瘤患者接受放疗或同步放化疗后最常见的剂量限制性毒性之一,限制了临床使用更高更有效的照射剂量以及联用其他方法治疗肿瘤,并且严重影响了患者的生活质量和生存期,严重的放射性肺炎甚至可危及生命[6-7]。肺是一个放射线相对敏感的器官,肺组织的受照剂量和受照体积是引起肺损伤的重要因素[8]。临床上对放射性肺损伤的预防主要是减少肺组织的放射剂量,尽可能缩小照射面积。食管癌由于胸廓的生理特点,病变在纵轴方向上距离体表距离变化较大,上中下靶点的水平位差(STD)可达4-11 cm,这种差值与胸廓梯度的改变及食管癌病灶的长度呈正相关,病灶越长,理想的肿瘤治疗计划越难实现[9]。而且食管癌确诊时往往已是中晚期,多数为局部晚期或已有淋巴结转移,对于病变较长、病变外侵严重的大体积患者,特别是靶区包含了锁骨区域,则要想保证靶区照射剂量的同时,又要避免严重的放射性肺损伤,大大提高了制定治疗计划的难度。武静[10]和郭莉莉等[11]指出,随着食管癌病变长度的增加,导致照射体积即靶区范围的相应加大,肺等正常组织卷入靶区中的体积也在扩大,此时大体积肺组织接受一定剂量照射,导致肺功能单位的丧失增多,致使增大了急性放射性反应和损伤的风险。患侧肺受照射体积不易控制,一直是乳腺癌改良根治术后放疗中限制靶区剂量的难题。洪卫等[12]通过 3D-CRT+ IMRT的照射技术,显示可有效降低乳腺癌患侧肺V5、V10和V20以上的受照射体积。姜庆丰等[13]采用两段小角度的 VMAT治疗弧应用于乳腺癌改良根治术后的放疗,结果发现可分别降低患侧肺平均V20、V30、V40体积 8%、10%、11%。孟慧鹏等[14]认为单弧VMAT计划与双弧VMAT计划在降低正常组织受量方面基本相当,单弧VMAT是右乳腺癌术后放疗的首选。
胸腹部的放射治疗也可引起不同程度的心脏损伤[15-16],特别是放疗技术的改进和大剂量放疗的应用,使肿瘤患者的生存期延长,迟发性心脏损伤问题更为突出,其发生率高达 20%-68%[17]。很多研究显示左侧乳腺癌放疗患者比右侧乳腺癌患者增加心血管疾病的发病率和死亡率[18],心脏受照射的剂量减少可降低放疗的损伤[19]。王晓红等[20]将心脏前壁区域作为独立的危及器官可明显降低左侧乳腺癌保乳术后放疗中心脏照射的剂量。对于腋窝淋巴结阳性的改良根治术后的高危乳腺癌患者,Overgaard等[21-23]研究结果显示,接受同侧胸壁和内乳淋巴结区域的放射治疗,能降低局部复发率,提高总生存率,但对肿瘤位于左侧的乳腺癌根治术后患者的内乳区放疗,由于存在放射性心脏损伤而受争议。因此,进一步改进放射治疗技术,减少左侧乳腺癌根治术后患者的心肺放射性损伤,增加乳腺癌患者放疗的获益仍然非常重要。
本研究选取了22例胸腹部大体积肿瘤,根据靶区和肺进入射野内体积的情况,进行上下靶区分段,利用调整射野等中心位置和固定铅门技术制定IMRT-肺计划,发现 IMRT-肺计划有如下优势:在不显著影响靶区适形度和均匀性的情况下,能显著降低左乳腺癌根治术后患者的左肺 V20和心脏 V30剂量,能明显减少食管癌的左肺V20、V30、右肺V30和心脏 V40值。对于这些正常组织的保护,主要可能从调整射野等中心位置和按照上下两部分分别旋转角度并固定铅门中获益,因为按照肺体积进入射野内的体积情况进行上下分段,可以使得上部分射野对心肺剂量贡献很少,下部分靶区因为体积变得更小且形状更规则,则有利于选择更能避开周围正常组织的照射角度,从而使得整个大靶区能更好地避开心肺组织,解决了靶区剂量提升与正常组织耐受限制的问题。食管癌中左肺的V20、V30和右肺V30均有明显下降,但靠右侧的右肺V5、V20和心脏V30均未有显著下降,这可能与选择的食管癌靶区位置倾向性有关,而未能从等中心调整和固定铅门技术中获益。
因此,对锁骨上区域已受侵的胸腹部大体积肿瘤且对心肺有严格限制的复杂病例进行计划设计时,可尝试根据肺进入射野的体积情况选择合适的射野等中心位置并进行上下分段固定铅门,使射野的边缘最优地避开危及器官,则能使周围部分正常组织受量得到有效下降。本研究仅从剂量学方面阐述了将调整等中心位置和固定铅门应用于胸腹部大体积肿瘤调强放疗中的技术优势,能解决部分常规射野所解决不了的靶区剂量提升与正常组织耐受之间的矛盾,但患者能否真正从临床疗效中得到获益,还需进一步地观察与随访。由于VMAT技术涉及到高昂的软硬件配备,国内医疗单位还远未普及,因此该研究结果也为没有 VMAT技术的医院提供新的计划设计思路。
1 曹征, 李红霞, 鲍杨漪. 前列腺癌调强计划改变多叶准直器角度对直肠和膀胱剂量的影响 [J]. 中国医学物理学杂志, 2010, 279(3): 1844-1847. CAO Zheng, LI Hongxia, BAO Yangyi. The impact ofchange angle of muli-leaf collimator on the dose distribution of the intensity-modulated radiation therapy plan for prostate cancer [J]. Chinese Journal of Medical Physics, 2010, 279(3): 1844-1847.
2 常熙, 徐志勇, 周莉钧, 等. 鼻咽癌逆向调强计划中照射野方向和照射野数目对剂量分布的影响 [J]. 中国癌症杂志, 2007, 17(4): 324-328. CHANG Xi, XU Zhiyong, ZHOU Lijun, et al. Influence on dose distribution by beam direction and beam number in inverse intensity-modulated for nasopharyngeal carcinoma [J]. China Oncology, 2007, 17(4): 324-328.
3 袁太泽, 李健, 沈国辉, 等. 鼻咽癌逆向调强计划中射野方向对剂量分布的影响 [J]. 实用医学杂志, 2010, 26(15): 2758-2760. YUAN Taize, LI Jian, SHEN Guohui, et al. Influence on dose distribution by beam direction in inverse intensity-modulated for nasopharyngeal carcinoma [J]. Journal of Practical Medicine, 2010, 26(15): 2758-2760.
4 胡逸民. 肿瘤放射物理学 [M]. 北京: 原子能出版社, 1999: 325-326. HU Yimin. Radiation oncology physics [M]. Beijing: Atomic Energy Press, 1999: 325-326.
5 Van’t Riet A, Mak A C, Moerland M A, et al. A conformation number to quantify the degree of conformality in brachytherapy and external beam radiation: application to the prostate [J]. International Journal of Radiation Oncology, Biology, Physics, 1997, 37(3): 731-736.
6 张瑾熔, 刘珊珊, 吕茵, 等. 血浆中TNF-α、IL-6、ACE水平及DVH参数与放射性肺炎发生的相关性研究 [J].中国癌症杂志, 2010, 20(6): 440-445. ZHANG Jinrong, LIU Shanshan, LV yin, et al. A study of correlation between tnf-α、il-6、ace levels in plasma, dose-volume-histogram parameters and radiation pneumonitis [J]. China Oncology, 2010, 20(6): 440-445.
7 邢晓波, 张美莲, 王宗站, 等. 局部晚期非小细胞肺癌适形调强放疗联合多西他赛同步化疗的临床观察 [J].中华肿瘤防治杂志, 2011, 18(16): 1280-1282. XING Xiaobo, ZHANG Meilian, WANG Zongzhan, et al. Intensity modulated radiation therapy combined with docetaxi chemotherapy for locally late stage non-small cell lung cancer [J]. Chinese Journal of Cancer Prevention and Treatment, 2011, 18(16): 1280-1282.
8 殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学 [M].北京: 中国协和医科大学出版社, 2008: 636-656. YIN Weibo, YU Zihao, XU Guozhen, et al. Radiation oncology [M]. Beijing: China Xie-he Medical University Publishing House, 2008: 636-656.
9 孔令玲, 唐虹, 吴黎明, 等. 胸上段食管癌放射治疗计划与射野优化的探讨 [J]. 现代肿瘤医学, 2006, 14(7): 829-831. KONG Lingling, TANG Hong, WU Liming, et al. Study of optimum radiation therapy planning and fields for advanced upper-thoracic esophageal cancer [J]. Journal of Modern Oncology, 2006, 14(7): 829-831.
10 武静. 食管癌三维适形放疗所致肺损伤相关因素分析[J]. 临床医药实践杂志, 2008, 17(11): 923-924. WU Jing. Predictors of radiation-induced lung toxicities in patients with esophageal cancer treated with three-dimensional conformal radiotherapy [J]. Proceeding of Clinical Medicine, 2008, 17(11): 923-924.
11 郭莉莉, 徐凯. 放射性肺损伤的研究进展[J]. 徐州医学院学报, 2007, 27(3): 198-200. GUO Lili, XU Kai. The Progress of Radiation-induced Lung Toxicities [J]. Acta Academiae Medicinae Xuzhou, 2007, 27(3): 198-200.
12 洪卫, 冉立, 卢冰, 等. 乳腺癌改良根治术后放疗降低患侧肺受量的剂量学研究 [J]. 中华放射医学与防护杂志, 2011, 31(6): 684-687. HONG Wei, RAN Li, LU Bing, et al. Dosimetry of different techniques in postmastectomy radiation therapy on the ipsilateral lung [J]. Chinese Journal of Radiological Medicine and Protection, 2011, 31(6): 684-687.
13 姜庆丰, 柏森, 傅玉川, 等. 容积旋转调强技术在乳腺癌根治术后放射治疗中的应用 [J].川北医学院学报, 2012, 27(2):102-108. JIANG Qingfeng, BAI Sen, FU Yuchuan, et al. Feasibility of volumetric modulated arc therapy applied to breast cancer radiotherapy after radical surgery [J]. Journal of North Sichuan Medical College, 2012, 27(2): 102-108.
14 孟慧鹏, 孙小喆, 孙劲松, 等. 右乳腺癌术后放疗中VMAT和 dIMRT的剂量学比较 [J]. 中国医学物理学杂志, 2013, 30(5): 4387-4391. MENG Huipeng, SUN Xiaozhe, SUN Jinsong, et al. Dosimetric comparison between VMAT and dIMRT for right breast carcinoma postoperation radiotherapy [J]. Chinese Journal of Medical Physics, 2013, 30(5): 4387-4391.
15 Gustavsson A, Osterman B, Cavallin-sta hl E. A systematic overview of radiation therapy effects innon-hodgkin’s lymphoma [J]. Acta Oncologica, 2003, 42(5-6): 605-619.
16 Giraud P, Cosset J M. Radiation toxicity to the heart: physiopathology and clinical data [J]. Bull Cancer, 2004, 91(Suppl 3): 147-153.
17 Soloviev A I, Tishkin S M, Parshikov A V, et al. Mechanisms of endothelial dysfunction after ionized radiation: selective impairment of the nitric oxide component of endothelium-dependent vasodilation [J]. British Jornal of Pharmacology, 2003, 138(5): 837-844.
18 Correa C R, Litt H I, Hwang W T, et al. Coronary artery findings after left-side compared with right-sided radiation treatment for early-stage breast cancer [J]. Journal of Clinical Oncology, 2007, 25(21): 3031-3037.
19 Prosnitz R G, Hubbs J L, Evans E S, et al. Prospective assessment of radiotherapy-associated cardiac toxicity in breast cancer patients: analysis of data 3 to 6 years after treatment [J]. Cancer, 2007, 110(8): 1840-1850.
20 王晓红, 谭文勇, 柳栋, 等. 乳腺癌术后放疗降低心脏照射剂量的新方法——心脏前壁区域作为独立的危及器官 [J]. 中国医疗前沿, 2013, 8(11): 6-8. WANG Xiaohong, TAN Wenyong, LIU dong, et al. A method to reduce the heart dose for breast carcinoma postoperation radiotherapy-the anterior wall of the heart as an independent organ at risk [J]. Frontier Health China, 2013, 8(11): 6-8.
21 Overgaard M, Hansen P S, Overgaard J, et al. Postoperative radiotherapy in high risk premenopausal women with breast cancer who receive adjuvant chemotherapy. Danish breast cancer cooperative group 82b trial [J]. New England Journal of Medicine, 1997, 337(14): 949-955.
22 Ragaz J, Jackson S M, Ire N, et al. Adjuvant radiotherapy and chemotherapy in node positive premenopausal women with breast cancer [J]. New England Journal of Medicine, 1997, 337: 956-962.
23 Overagarrd M, Jensen M B, Overgraard J, et al. Postoperative radiotherapy in high risk postmenopausal breast cancer patients given adjuvant tamoxifen: Danish breast cancer cooperative group dbcg 82c randomized trial [J]. Laneet, 1999, 353: 1641-1648.
The dosimetric difference in IMRT treatment planning based on
different isocenter positions for the thoracic and abdominal large target volume
ZHU Xiaoyang1WANG Ming21(Department of Radiation Oncology, the Second Affiliated Hospital, School of Medicine,
Zhejiang University, Hangzhou 310009, China)
2(Department of Radiation Oncology, Changzhou Hospital, Changzhou 061001, China)
Nine patients suffering with left breast cancer after radical mastectomy and thirteen patients suffering with esophagus cancer were selected. All plan target volumes (PTV) included supraclavicular areas. Two IMRT plans(IMRT-PTV and IMRT-lung) for 22 patients were developed according to different isocenter positions (PTV center and the center determined by the lung volume in PTV). The dosimetric differences of PTV and normal tissues were analyzed using dose-volume histogram (DVH) for the two IMRT plans. The results showed that left lung V20and heart V30of the left breast cancer after radical mastectomy IMRT-lung plans dropped significantly(t=-6.154, -5.084; p=0.038, 0.040), and left lung V20, V30, right lung V30and heart V40of the Esophagus cancer IMRT-Lung plans were also significantly lower(t=-7.493, -8.092, -6.332, -6.945; p=0.025, 0.019, 0.042, 0.032), but not for other normal tissues. These findings indicate that changing isocenter position based on the lung volume involved in PTV can obtain the fewer dose of some normal tissues around the target volume.
Isocenter position, Large target volume, Intensity modulated radiationtherapy, Dosimetry
R73.55,TL72DOI: 10.11889/j.1000-3436.2014.rrj.32.040203
朱小杨,女,1979年9月出生,2004年于浙江大学获硕士学位,放疗物理师,E-mail: zxy2609@sohu.com
初稿2014-4-17;修回2014-5-19
CLCR73.55, TL72
