盐酸右美托咪定对老年患者术后早期认知功能的影响
2014-02-08张旭宋延军张锦
张旭 宋延军 张锦
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是指术前无精神异常的患者受围手术期各种因素的影响,出现术后大脑功能活动紊乱,是手术后常见并发症之一。其临床特点为认知能力减退、焦虑、记忆受损、语言能力和社会融合能力减退[1]。轻度仅表现为认知异常,中度为较严重的记忆缺损或健忘综合征,重度者可出现精神错乱、人格改变、焦虑、躁狂、谵妄、痴呆等明显的精神症状,丧失判断和语言概括能力。不仅给患者带来各种困扰,降低患者生活质量,还可增加死亡率、延长住院时间和加重医疗费用。近年来,国外已有研究表明镇静药右美托咪定(dexmedetomidine,DEX)具有改善患者术后认知功能的作用[2-3]。国内也有报道应用DEX全麻中持续输注能使老年患者术后早期认知功能障碍发生率有所降低[4]。本文旨在研究全身麻醉诱导前预输注DEX对老年病人术后早期POCD的影响。
1 资料与方法
1.1 一般资料选择择期全麻下手术的老年患者60例,年龄65~75岁,ASAⅠ~Ⅱ级,腹部、泌尿、骨科手术,手术时间≤3 h。随机分为观察组(D组)和对照组(C组),每组30例。本研究经本院医学伦理委员会批准,患者及家属签署知情同意书。D组:全麻诱导静脉微泵预输注DEX;C组以相同方法输注等量0.9%氯化钠溶液。排除条件:神经或精神疾病病史,严重视觉或听觉障碍,严重心动过缓,重度心脏传导阻滞,不能完成术前认知功能测试。其中2例患者手术时间过长,2例患者术后转到重症监护病房,还有1例持续心动过缓,实际纳入研究人数D组为27例,C组为28例。
1.2 麻醉方法所有患者均无术前用药,入室后开放上肢静脉通路,常规检测心电图(ECG),血压(BP),心率(HR),脉搏氧饱和度(SpO2)。D组给予DEX(浓度4 μg/ml)0.4 μg/kg,10 min泵完,C组以相同方法输注等量0.9%氯化钠溶液。输注完毕5 min后,2组患者均采用同样的麻醉方法和药物进行诱导,舒芬太尼0.3 μg/kg、依托咪酯0.2 mg/kg和顺苯磺酸阿曲库铵0.15 mg/kg,气管插管后接麻醉机行机械通气,氧流量2 L/min,潮气量8~10 ml/kg,呼吸频率12~16次/min,吸入氧浓度50%,N2O 50%。吸呼比1∶2,保持呼气末二氧化碳分压(PetCO2)35~40 mmHg;2组麻醉维持均采用七氟烷吸入,瑞芬太尼0.1~0.3 μg/(kg·min)持续静脉输注及并静脉间断注射顺式阿曲库铵,术中根据麻醉中循环指标调节七氟烷及瑞芬太尼的用量,手术结束前30 min静脉注射盐酸曲马多(1 mg/kg)术后镇痛。术毕停用七氟烷和瑞芬太尼,将氧流量调至6 L/min,静脉注入甲硫酸新斯的明(30 μg/kg)和硫酸阿托品(15 μg/kg)。待患者自主呼吸潮气量>6 ml/kg,呼吸频率<20次/min,呼气末二氧化碳波形显示吸气平台良好,PetCO2保持在35~45 mm-Hg,呼之睁眼,握拳有力时拔除气管导管,然后给予面罩吸氧。当收缩压(SBP)上升≥基础值的20%或SBP>180 mmHg时给予利喜定10 mg处理;SBP下降≤基础值的30%或SBP<80 mmHg时,应用麻黄碱6 mg处理;HR<45次/min时应用阿托品处理。记录应用血管活性药物的病例。
1.3 观察指标入室监测ECG,BP,HR,SpO2,Pet-CO2。记录指标:2组分别记录药物输注前(T0)、输注后5min(T1)、插管时(T2)、插管后1 min(T3)、插管后5 min(T4)的SBP、舒张压(DBP)及HR。
1.4 POCD的诊断标准选择术前1 d、术后1 d和术后3 d完成对2组患者的简易精神状态量表(mini mental state examination,MMSE)的测试并记录评分。MMSE评分包含定向力、即刻记忆力、注意力、计算、回忆、语言水平的测试。该项测试最高分为30分,正常人>27分,24~27分为轻度POCD,19~23分为中度POCD,0~18分为重度POCD,术后得分<术前2分为认知功能下降;若患者于评定时出现澹妄、躁动、治疗不配合、记忆障碍等不能进行认知功能评分者直接记为POCD[5]。为将试验误差降到最低,所有评分测试由同一测试者完成,采用2个平行版本。
1.5 统计分析应用SPSS 17.0软件进行统计分析,计量资料以¯x±s表示,2组间比较采用t检验,多组间比较采用方差分析;计数资料比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料2组患者的术前一般资料无统计学差异(P>0.05)(表1)。
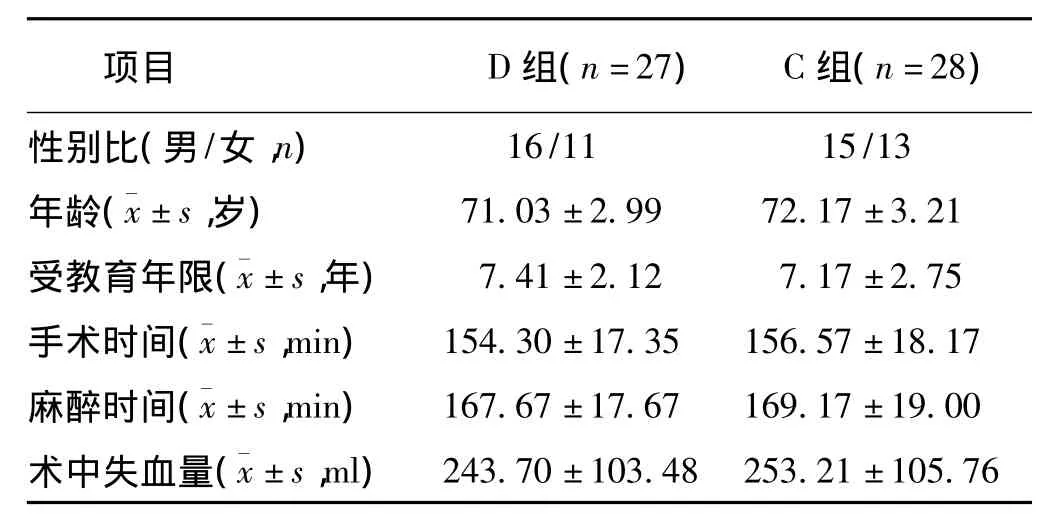
表1 2组患者一般资料的比较
2.2 2组认知功能的比较2组患者术前1 d MMSE评分情况无统计学差异(P>0.05)。D组和C组在术后1 d和3 d认知功能均有所下降,与术前比较差异均有统计学意义(P<0.05)(表2)。D组和C组术后第1天分别有7例(25.9%)和11例(35.7%)发生认知功能下降,差异有统计学意义(P<0.05);术后第3天分别有3例(11.1%)和5例(17.6%)发生认知功能下降,差异无统计学意义(P>0.05)。
表2 2组患者MMSE评分情况比较(±s,分)

表2 2组患者MMSE评分情况比较(±s,分)
注:与术前比较,*P<0.05;与C组比较,△P<0.05
3 d D组(n=27)28.07±0.9126.44±1.34*△26.89±1.05组别术前1 d术后1 d术后*C组(n=28)28.25±0.9225.46±1.99*26.46±1.31*
2.3 2组血流动力学指标变化在T1、T3、T4时间点D组SBP、DBP、HR低于C组,差异有统计学意义(P<0.05),在T2时间点D组HR低于C组,差异有统计学意义(P<0.05)(表3)。
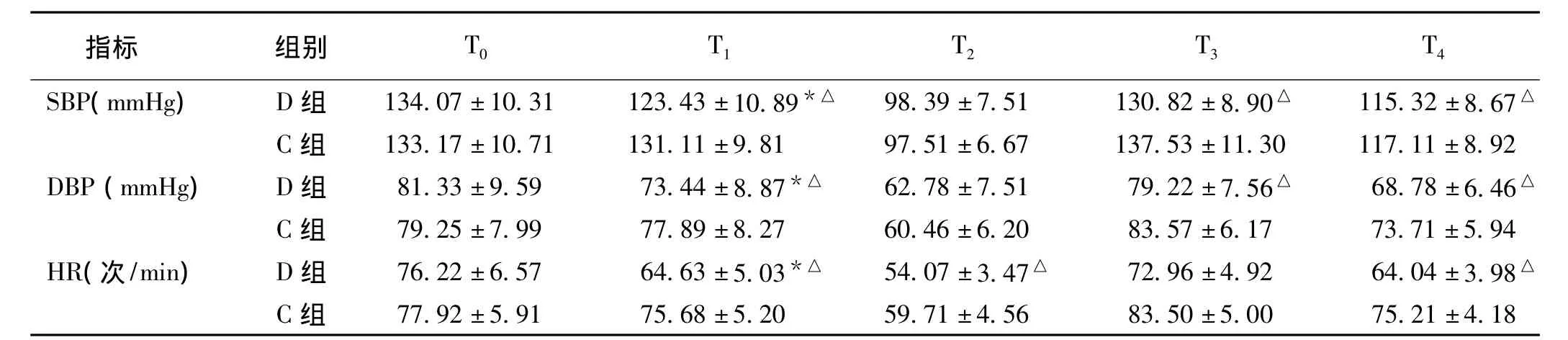
表3 2组患者诱导期血流动力学指标变化(?±s)
3 讨论
老年人出现认知功能障碍的影响因素很多,其病因及发病机制目前仍不很清楚,目前一般认为POCD是患者在中枢神经系统退变、老化的基础上,由麻醉、手术等外在因素诱发或加重的中枢神经系统退行性改变,是多种因素综合作用的结果。有研究表明炎症因子释放是脑损伤的最主要病理机制,而后者被认定为各类认知功能障碍的基本病变[6]。手术创伤的侵袭以及麻醉药物大剂量和长时间对机体生理功能的影响,激活了各种介质,造成过度激活,使血管内皮、基底膜及各器官功能受到损害;外周免疫系统激活、炎症因子的增高通过多种途径导致脑功能损害,从而影响认知功能[7]。Kang等[8]的研究显示,DEX有利于稳定患者围术期的血流动力学水平,减少麻醉及手术对神经系统的损伤,提高脑氧摄取率。
DEX作为一种新型的高选择性α2肾上腺素受体激动剂,其分布半衰期约为5 min,消除半衰期约2 h。通过激动α2受体GABAa抑制突触前去甲肾上腺素的释放产生作用,具有镇静、镇痛、抗焦虑、抑制交感神经活性、稳定血流动力学、减少麻醉用药量、呼吸抑制作用的特点,此外,还具有止涎、抗寒颤和利尿等作用。
本研究结果显示,2组患者术后MMSE评分与术前比较均有不同程度的下降,D组与C组比较,在术后1 d MMSE评分较高、术后认知功能下降例数较低,提示在全身麻醉诱导前输注DEX对老年患者术后早期认知功能下降有一定的预防作用,并且能降低早期POCD的发生率;但在2组术后3 d MMSE评分和术后认知功能下降例数无统计学意义,这可能与MMSE评分量表很难辨别术后微弱的认知能力下降有关[9],而且DEX是否有远期的保护作用不得而知。DEX的预防作用可能与其具有良好的脑保护作用有关[10]。在一项体内实验中,DEX具有剂量依赖性地抑制异氟醚诱导对海马,丘脑和皮层的大脑发育引起的损伤,为神经认知功能提供了保障[11]。这也在其他一些先前的研究有报道[12-13]。如果异氟醚诱导的神经细胞凋亡被证明是一个临床问题,DEX的应用可能会成为阻止异氟醚诱导引起的的神经毒性的重要辅助手段。
在本研究中,观察组和对照组术后第1天POCD的发生率分别是14.8%和42.9%,术后第3天分别是11.1%和17.6%,术后第3天几乎均恢复至术前水平。POCD的发病高峰在术后第1~2天,出现POCD的患者术后3 d MMSE评分恢复近麻醉前水平,多数仅出现短时间认知功能下降,与文献报道一致[14]。MMSE评分受很多因素影响,最重要是年龄,其次是受教育程度,再加上由于诊断方法、评估工具和评估时间的差异,POCD的发生率报道不一。Moller等[15]研究显示非心脏手术后7 d POCD的发生率为25.8%,术后3月POCD发生率为9.9%,张璐璐等[16]研究显示非心脏手术后7 d POCD发生率约为21.2%。
本研究结果显示:D组与C组比较,麻醉诱导前输注DEX对全麻诱导期的血流动力学没有不利影响,并未引起明显的心动过缓和严重的低血压,2组阿托品和麻黄碱使用没有统计学差异。因此,全麻诱导前输注DEX可以维持较稳定的血流动力学。虽然导致MMSE评分下降的原因尚不清楚,血流动力学的改变可能是其中一个显著的因素,这也可能是DEX保护作用的另一个原因[17]。其主要机制可能是DEX降低交感神经活性,从而抑制去甲肾上腺素的释放,降低血浆中儿茶酚胺的浓度,继而产生降低血压、减慢心率的作用;另外通过激动位于动脉血管壁平滑肌细胞上的α2肾上腺素受体,产生血管收缩作用预防血压下降,从而保证了血流动力学的相对平稳。有报道该药物降低POCD具有剂量依赖性[18],达到最大保护作用又不致引起严重不良反应的剂量,但在本研究中,所采用的剂量为该药物在老年患者中的推荐剂量范围,故未对其剂量的半数有效量(ED50)进行研究。
研究中关于DEX剂量的选择,在DEX临床应用指导意见(中华医学会麻醉学分会专家组)麻醉诱导前静脉持续泵注推荐剂量为0.5~1 μg/kg,老年人应减少负荷剂量,建议以0.5 μg/kg,输注>10 min。Kunisawa等[19]全麻诱导前静脉泵注1 μg/kg DEX,时间15 min,发现右美托咪定抑制麻醉诱导期间的血压下降;袁莉等[20]的研究表明全麻诱导前静脉泵注0.8 μg/kg的DEX对老年人具有良好的安全性;王育明[21]研究全麻诱导前静脉泵注0.5 μg/kg DEX,维持量为0.2 μg/(kg·h),手术结束前30 min泵注停止,可有效防止老年人术后认知功能下降。本研究考虑到研究对象年龄大、手术时间短,所以采用单次全麻诱导前静脉泵注0.4 μg/kg的方法。
本研究有许多限制:(1)研究对象例数偏少;(2)老年患者具有较高的平均MMSE评分,可能产生封顶效应等其他干扰;(3)选择的研究人群较窄;(4)可能存在其他药物术后用药不规范,例如术后阿片类药物应用,对认知功能障碍有一定影响。根据以上因素,在本研究中所选择的人群可能产生手术之后的D组和C组患者的MMSE评分偏移。因此,应该进行更大规模的研究,扩大本研究为更广泛的人群。
本研究证实,DEX对老年患者术后认知功能下降有一定的预防作用,并且降低POCD的发生率,保护老年患者术后早期认知功能。但本试验尚未进一步研究DEX预防老年患者POCD的最佳有效剂量和对老年患者远期认知功能的影响,有待进一步研究。
[1]刘璇,刘存明.老年人术后认知功能障碍[J].实用老年医学,2012,26(1):14-17.
[2]Pandharipande PP,Pun BT,Herr DL,et al.Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients:the MENDS randomized controlled trial[J].JAMA,2007,298(22):2644-2653.
[3]Shukry M,Clyde MC,Kalarickal PL,et al.Does dexmedetomidine prevent emergence delirium in children after sevoflurane-based general anesthesia?[J].Paediatr Anaesth,2005,15(12):1098-1104.
[4]张奕文,何忠承,石世坚,等.右美托咪定复合七氟烷全麻对老年患者术后早期认知功能的影响[J].广东医学,2012,33(14):2172-2174.
[5]Guerrero-Berroa E,Luo X,Schmeidler J,et al.The MMSE orientation for time domain is a strong predictor of subsequent cognitive decline in the elderly[J].Int J Geriatr Psychiatry,2009,24(12):1429-1437.
[6]葛叶盈,万燕杰,曾因明.术后认知功能障碍发病机制的研究进展[J].河北医学,2009,15(1):113-117.
[7]Funder KS,Steinmetz J.Post-operative cognitive dysfunction—Lessons from the ISPOCD studies[J].Trends in Anaesthesia and Critical Care,2012,2(3):94-97.
[8]Kang WS,Kim SY,Son JC,et al.The effect of dexmedetomidine on the adjuvant propofol requirement and intraoperative hemodynamics during remifentanil-based anesthesia[J].Korean J Anesthesiol,2012,62(2):113-118.
[9]郭安梅.不同神经心理学测验评估术后认知功能变化的重测信度分析[J].中国现代医学杂志,2010,20(15):2315-2317.
[10]斯妍娜,张媛,鲍红光.α2A肾上腺素受体对术后认知功能的影响及机制研究进展[J].实用老年医学,2013,27(10):869-871.
[11]Sanders RD,Xu J,Shu Y,et al.Dexmedetomidine attenuates isoflurane-induced neurocognitive impairment in neonatalrats[J].Anesthesiology,2009,110(5):1077-1085.
[12]Goyagi T,Nishikawa T,Tobe Y,et al.The combined neuroprotective effects of lidocaine and dexmedetomidine after transient forebrain ischemia in rats[J].Acta Anaesthesiol Scand,2009,53(9):1176-1183.
[13]Kuhmonen J,Haapalinna A,Sivenius J.Effects of dexmedetomidine after transient and permanent occlusion of the middle cerebral artery in the rat[J].J Neural Transm,2001,108(3):261-271.
[14]Rohan D,Buggy D J,Crowley S,et al.Increased incidence of postoperative cognitive dysfunction 24 hr after minor surgery in the elderly[J].Can J Anaesth,2005,52(2):137-142.
[15]Moller JT,Cluitmans P,Rasmussen LS,et al.Long-term postoperative cognitive dysfunction in the elderly ISPOCD1 study.ISPOCD investigators.International Study of Post-Operative Cognitive Dysfunction[J].Lancet,1998,351(9106):857-861.
[16]张璐璐,叶铁虎.老年患者术后认知功能障碍的流行病学研究[D].中国协和医科大学,2008.
[17]Chen J,Yan J,Han X.Dexmedetomidine may benefit cognitive function after laparoscopic cholecystectomy in elderly patients[J].Exp Ther Med,2013,5(2):489-494.
[18]van Oostrom H,Stienen PJ,Doornenbal A,et al.The alpha(2)-adrenoceptor agonist dexmedetomidine suppresses memory formation only at doses attenuating the perception of sensory input[J].Eur J Pharmacol,2010,629(1):58-62.
[19]Kunisawa T,Nagata O,Iwasaki H.Pharmacokinetic simulation of high-dose administration of dexmedetomidine for decubitus treatment[J].Masui,2006,55(8):995-998.
[20]袁莉,王世端,阎玮,等.右美托咪啶对高血压患者麻醉诱导期间血流动力学稳定性的影响[J].中华临床医师杂志:电子版,2011,5(23):7092-7095.
[21]王育明.盐酸右美托咪定对老年乳腺癌患者术后认知功能的影响[J].中国老年学杂志,2013,33(13):3167-3168.
