儿童肺炎链球菌性脑膜炎临床特征及预后影响因素分析
2014-02-08刘玉明
刘玉明,耿 荣
肺炎链球菌可定植于正常人(尤其是儿童)的鼻咽部,侵入血液、胸腔、腹腔、骨髓、脑组织等原本无菌的部位和组织,从而导致侵袭性肺炎链球菌性疾病,严重时可以引发儿童细菌性脑膜炎。WHO数据显示,每年有17万人死于化脓性脑膜炎[1]。肺炎链球菌是导致婴幼儿脑膜炎、菌血症、肺炎等严重疾病的首位病原菌[2]。不发达国家细菌性脑膜炎患儿的病死率为12%~15%,存活者中也有25%~50%留有后遗症[3-6]。对于>5岁的儿童来说,在引起细菌性脑膜炎的主要致病菌(即流感嗜血杆菌、肺炎链球菌和脑膜炎奈瑟菌)中,肺炎链球菌和脑膜炎奈瑟菌目前仍是其最主要的病原菌[7];对于婴幼儿来说,大部分学者认为其病原菌也是以肺炎链球菌为主[7],故肺炎链球菌是目前引起儿童细菌性脑膜炎的主要病原菌。肺炎链球菌性脑膜炎患儿幸存者中常可见到造成终身残疾的后遗症,其发生率高于流感嗜血杆菌和脑膜炎双球菌引起的后遗症。检索国内医学期刊发现目前国内对儿童肺炎链球菌性脑膜炎的研究大多集中在其流行病学、分子生物学、炎症活化等病理生理机制及动物模型等方面,关于临床方面的研究较少。本研究通过对98例经脑脊液培养和菌体抗原检测证实为肺炎链球菌感染的细菌性脑膜炎患儿的临床特征与治疗转归进行回顾性分析,并探讨其预后不良的影响因素,以进一步认识该病的临床特点,提高对本病的认识和防治水平,减少其严重并发症的发生。
1 对象与方法
1.1 研究对象 选择2002年1月—2012年4月首都医科大学附属北京儿童医院(作者读研期间)内科收治的98例细菌性脑膜炎患儿为研究对象,均符合《诸福棠实用儿科学》中细菌性脑膜炎的诊断标准[8],临床具有发热、头痛、呕吐、精神改变、脑膜刺激征和脑脊液改变,均经脑脊液培养及菌体抗原检测证实为肺炎链球菌感染。
1.2 方法 回顾性收集患儿的临床资料,包括年龄、性别、临床表现、实验室检查、颅脑影像学检查、脑电图、并发症、治疗及转归。按照患儿的年龄分为3组:<1岁组、1~5岁组、>5岁组,对比分析不同年龄组患儿的临床特征。
按照患儿出院时的Glasgow预后评分进行预后分组[9]。Glasgow预后评分标准,5分:治愈或明显好转,治愈指脑膜炎的临床症状及体征完全消失,脑脊液连续2次检查正常,末梢血白细胞计数及分类恢复正常,无并发症与后遗症;好转指脑膜炎的临床症状及体征明显缓解,脑脊液检查接近正常,各种并发症明显好转,无神经系统后遗症;4分:中枢神经系统功能障碍,出现频繁抽搐、肢体活动障碍等症状和体征,脑脊液检查无改变,各种并发症未见好转;3分:留有严重的神经系统功能障碍;2分:植物人状态;1分:死亡。将Glasgow预后评分5分者归入预后良好组,1~4分者纳入预后不良组。对各组患儿的发病年龄、性别、临床表现、实验室检查、颅脑影像检查、脑电图、治疗、并发症及预后进行分析比较,探讨其预后的影响因素。
1.3 统计学方法 采用SPSS 18.0软件进行统计学分析,计数资料的比较采用χ2检验;对预后不良的影响因素行多元Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况及起病 发病时间为出生后1.5个月~13岁7个月,其中<1岁64例(65.3%),1~5岁18例(18.4%),>5岁16例(16.3%)。≤5岁的患儿共占83.7(82例)。性别:男67例、女31例,男∶女为2.16∶1。发病季节:冬季(12、1、2月)35例(35.7%),春季(3、4、5月)36例(36.7%),夏季(6、7、8月)15例(15.3%),秋季(9、10、11月)12例(12.2%)。
本组患者就诊时间为发病后23 h~50 d,其中首次就诊在病程3 d以内者89例(90.8%),在病程3 d内来本院就诊者24例。患儿住院时间1~54 d,平均21.9 d。52例(53.1%)有前驱感染,其中28例以呼吸系统症状起病,9例发病前有明确的颅脑创伤及相关手术史,9例有脑脊液耳漏、耳鼻漏及双内耳畸形、皮毛窦等神经系统缺陷,6例以腹泻等消化系统症状起病;8例(8.2%)有免疫缺陷,其中细胞免疫缺陷4例,体液免疫缺陷3例(选择性IgA缺乏2例、IgG亚类缺陷1例),联合免疫缺陷1例;接种麻疹疫苗后发生1例。
2.2 症状与体征 不同年龄组患儿均有发热。<1岁组囟门张力高和惊厥的发生率高于其他两组;1~5组昏迷、意识模糊发生率高于其他两组;>5岁组头痛、呕吐发生率高于<1岁组和1~5岁组(P<0.05,见表1)。

表1 不同年龄组患儿临床资料比较〔n(%)〕
注:与>5岁组比较,*P<0.05;与1~5岁组比较,△P<0.05;与<1岁组比较,▲P<0.05
2.3 实验室检查 98例患儿血常规(以患儿来我院后首次血常规检查结果为标准)白细胞计数(0.7~48.6)×109/L,其中<4.0×109/L者11例(11.2%),4.0×109~/L者21例(21.4%),10.0×109~/L者34例(34.7%),≥20.0×109/L者32例(32.7%)。中性粒细胞分数>0.50者68例(69.4%)。脑脊液(以患儿来我院后首次脑脊液检查结果为标准)白细胞 <10.0×106/L者13例(13.3%), 10.0×106~/L者17例(17.3%),100.0×106~/L者22例(22.4%),500.0×106~/L者15例(15.3%),(1 000.0~4 685.0)×106/L者31例(31.6%);脑脊液中糖<2.8 mmol/L者62例(63.3%),其中<1.5 mmol/L者53例(54.1%);脑脊液蛋白<1 000 mg/L者36例(36.7%),≥1 000 mg/L者62例(63.3%),最高4 830 mg/L。
98例患儿中共57例行颅脑CT检查,其中异常53例(93.0%),包括硬膜下积液37例、脑积水12例、硬膜下积液合并脑积水4例。共30例患儿行颅脑MRI检查,其中异常者29例(96.7%),包括脑部异常信号影20例、硬膜下积液5例、脑积水4例。共58例行脑电图检查,其中异常者32例(55.2%)。
45例脑脊液培养致病菌为肺炎链球菌,其中39例有明确的青霉素药敏试验结果(26例有完整的药敏试验结果、13例有部分药敏试验结果)、6例无药敏试验结果。药敏试验结果详见表2。
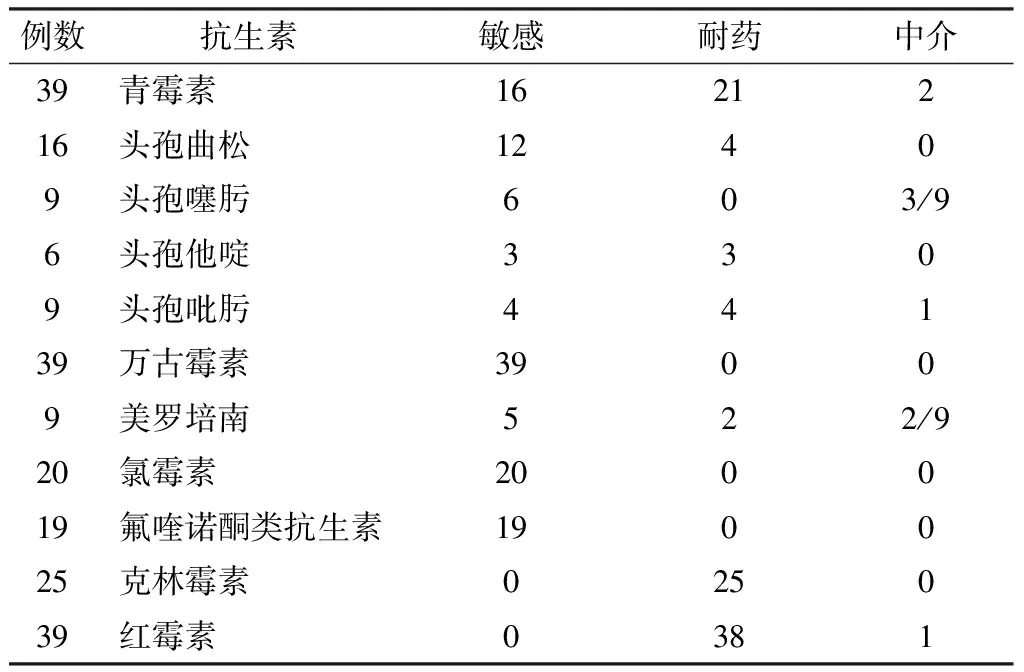
表2 肺炎链球菌药敏试验结果(例)
2.4 治疗 98例患儿中8例入院前未给予抗生素治疗,3例于入院前给予口服抗生素治疗,87例于入院前经静脉给予抗生素治疗。本组患儿入院当天多经验性应用青霉素或强力阿莫仙联合三代头孢抗感染治疗,同时完善脑脊液病原学检测。若治疗无效或根据药敏结果换用其他抗生素,有15例换用万古霉素+三代头孢菌素,18例直接美罗培南+万古霉素治疗;共有33例应用万古霉素,22例应用美罗培南,12例换用利萘唑胺。90例于外院或我院在治疗初期使用抗生素的同时使用激素地塞米松或甲波尼龙治疗;8例患儿在外院激素使用情况不详,来我院时因病程已超过2周而未使用地塞米松治疗。
2.5 主要并发症 共75例(76.5%)患儿治疗过程中发生1种或1种以上并发症,包括硬膜下积液、听力损害、脑积水、低钠血症、惊厥持续状态、嗜血细胞综合征、颅内出血、侧脑室扩张、脑疝、消化道出血、严重脓毒症及多器官衰竭、感染性休克及中枢性呼吸衰竭。<1岁组并发症发生率为90.1%(58/64),高于1~5岁组〔66.7%(12/18)〕和>5岁组〔31.3%(5/16),χ2分别为6.455、26.966,P<0.05〕。
发生硬膜下积液者41例(41.8%),发生时间为发病后1~91 d,中位时间为15 d;听力损害18例(18.4%);脑积水17例(17.3%),发生时间为发病后3~34 d,中位时间17 d;合并低钠血症33例(33.7%)。
2.6 预后 预后良好组中治愈5例(男4例,女1例;2例为颅脑创伤术后,2例为重症肺炎败血症,1例为中耳炎。患儿均于神经系统症状出现24 h内行脑脊液检测和及时抗感染治疗,疗程均达4周以上。治疗过程中2例出现听力损害,1例出现硬膜下积液,均治愈);好转64例。预后不良组29例,其中7例病情未愈因经济原因要求出院,21例因严重并发症(脑疝、惊厥持续状态、嗜血细胞综合征、中枢性呼吸衰竭等)家属放弃治疗而自动离院,1例死亡。
两组年龄<1岁、C反应蛋白>100 mg/L、血钠<135 mmol/L、血钙<2.2 mmol/L发生率间差异均有统计学意义(P<0.05,见表3)。
将上述有统计学意义的变量纳入多元Logistic回归分析,结果显示,年龄<1岁、C反应蛋白>100 mg/L、血钠<135 mmol/L、血钙<2.2 mmol/L是肺炎链球菌性脑膜炎患儿预后的影响因素(P<0.05,见表4)。
表4 肺炎链球菌性脑膜炎患儿预后影响因素的多元Logistic回归分析
Table4 Multivariate Logistic regression analysis of influencing factors for pneumococcal meningitis patients

回归系数Waldχ2值P值OR值C反应蛋白>100mg/L245814047000111681年龄<1岁1204 4408 00433333血钠<135mmol/L1287 7544 00083622血钙<22mmol/L1874 4154 0006514

表3 不同预后组临床指标比较(例)
2.7 再发细菌性脑膜炎 98例患儿中5例为再发细菌性脑膜炎(其中3例既往曾患过肺炎链球菌性脑膜炎,2例既往病原学检测阴性),其中男2例、女3例;年龄6岁~13岁7个月,平均发病年龄8.5岁。5例均有发病诱因,其中1例有脑脊液鼻漏,1例有脑脊液耳鼻漏、1例为中耳乳突炎,2例有免疫缺陷。
3 讨论
3.1 临床流行病学 目前,细菌性脑膜炎仍然是小儿最常见的中枢神经系统严重感染性疾病,且病原菌仍以最常见的3种致病菌(流感嗜血杆菌、脑膜炎球菌和肺炎链球菌)为主。随着B型流感嗜血杆菌疫苗在发达国家的广泛应用,细菌性脑膜炎的流行特点已经有了变化,但肺炎链球菌目前仍是引起婴幼儿及5岁以上儿童脑膜炎的主要病原菌之一[10]。有文献报道全球>2个月的细菌性脑膜炎患儿致病菌中90%为肺炎链球菌、B型流感嗜血杆菌和脑膜炎奈瑟菌[11],肺炎链球菌性脑膜炎是我国常见细菌性脑膜炎之一,也是导致神经系统后遗症的主要病原菌[12]。虽然目前细菌性脑膜炎患儿的整体预后有了明显改善,但肺炎链球菌引起的脑膜炎仍有着较高的发病率(20%~30%)和病死率(10%)[13]。细菌性脑膜炎中80%发生在5岁以下[12]。本组98例肺炎链球菌性脑膜炎患儿均<15岁,其中≤5岁者占83.7%,<1岁者占65.3%,男女之比为2.16∶1,故≤5岁的婴幼儿为肺炎链球菌性脑膜炎的高发年龄段,且多见于男孩。这与Ortqvist等[14]研究显示的年龄和性别是肺炎链球菌性脑膜炎等肺炎链球菌侵袭性疾病的重要危险因素相符。本组患儿冬春季发病率为72.4%,与Madhi等[15]临床研究显示其高发季节为冬季相符。本组患儿首次就诊时间在病程3 d以内者占90.8%,可见肺炎链球菌性脑膜炎绝大多数起病较急。本组98例肺炎链球菌性脑膜炎患儿中有明确前驱感染者52例,其中呼吸道感染28例、颅脑创伤9例、消化道感染6例,因存在脑脊液耳漏、耳鼻漏及皮毛窦等先天神经系统畸形而导致脑膜直接感染9例。本组98例患儿中有22例血培养亦为肺炎链球菌感染,这与国内一般细菌性脑膜炎的相关报道一致[16-18]。本组>5岁的患儿中8例存在免疫缺陷、2例存在脑脊液鼻漏及耳鼻漏;本组5例再发细菌性脑膜炎患儿均为>5岁,均有3次复发,均存在自身异常(3例存在颅脑解剖结构异常,2例存在免疫缺陷)。因此在临床工作中,对于有呼吸道、消化道感染表现及中耳炎、颅脑创伤患儿应在疾病早期进行有效的治疗或预防,以防止细菌播散或蔓延至颅内引起感染。同时,对于年长儿的颅内感染,除积极治疗外还应尽可能地寻找病因并进行治疗,以避免再发。
3.2 早期诊断 本组患儿的主要临床表现为发热、抽搐、昏迷、脑膜刺激征及呕吐,与国内报道的一般细菌性脑膜炎的临床表现基本一致[16-17,19]。但不同年龄组的患儿表现有所差异,<1岁组囟门张力高和惊厥的发生率较高,1~5岁组昏迷和意识模糊发生率较高,>5岁组头痛、呕吐发生率较高。婴幼儿由于中枢神经系统发育不完善,早期可能仅表现为发热、精神差、嗜睡,但发病不久即可出现昏迷和惊厥。本组5例治愈患儿均于感染早期及时行脑脊液病原学检测并及时给予足疗程的抗感染治疗。因此,对于以感染表现发病的患儿,尤其是婴幼儿应进行全面观察和综合分析,同时结合临床及时行脑脊液检查及病原学检测,以早期诊断和及时治疗,防止并发症和后遗症的发生。
3.3 病原学检测及脑脊液检查 在临床工作中,脑脊液检查是确诊细菌性脑膜炎的依据,而脑脊液病原学检查则是诊断的金标准。本组病原学诊断明确,绝大多数患儿符合典型细菌性脑膜炎的脑脊液改变[20],脑脊液白细胞>500×106/L者占46.9%(46/98),脑脊液蛋白≥1 000 mg/L者占63.3%,脑脊液糖<1.5 mmol/L者占54.1%;外周血白细胞升高或降低者占72.4%(71/98)。血培养阳性率为22.4%,与国内报道的一般细菌性脑膜炎的相关文献一致[16-17,19]。本组中尚有35例(35.7%)患儿虽然脑脊液病原学检测证实为肺炎链球菌性脑膜炎,但脑脊液改变不典型,考虑与患儿来院就诊时病程差异较大有关,部分患儿就诊早而脑脊液在发病24~48 d后才可能出现炎性反应;部分患儿来我院就诊时病程较长,大部分患儿已在院外行抗感染治疗,留取脑脊液时已受到不同程度的影响,致使脑脊液改变不典型。这提示在临床工作中如怀疑有细菌性脑膜炎尤其是肺炎链球菌性脑膜炎的患儿应该在抗生素使用之前及同时行脑脊液检查,而对脑脊液表现不典型者应结合临床资料进行全面、综合的分析,以免漏诊和误诊。
3.4 治疗策略 肺炎链球菌性脑膜炎亦遵循一般细菌性脑膜炎的治疗原则。根据美国感染性疾病协会(IDSA)2004年制定的细菌性脑膜炎治疗指南[20],对疑为急性细菌性脑膜炎的患者,初始处理措施包括对脑膜炎症状的尽早识别、快速诊断以及及时的抗感染治疗和辅助治疗;对疑似肺炎链球菌性脑膜炎或其他细菌性脑膜炎者(包括新生儿),初始经验治疗应使用万古霉素联合头孢噻肟或头孢曲松。对β内酰胺类(青霉素和头孢菌素)过敏者可考虑万古霉素和利福平联合给药[21];对青霉素、头孢噻肟或头孢曲松敏感时则应停用万古霉素,只有当肺炎链球菌对青霉素和头孢噻肟或头孢曲松不敏感时才可继续使用万古霉素。由于美罗培南体外抗菌谱广,较少引起惊厥,因此亦可作为3个月以上细菌性脑膜炎(包括肺炎链球菌性脑膜炎)患儿的替代治疗药物[20]。同时可供选择治疗肺炎链球菌性脑膜炎的其他抗菌药物还包括需谨慎使用的氯霉素。本组98例患儿入院后均采用青霉素或强力阿莫仙联合三代头孢或美罗培南联合万古霉素的经验治疗,后根据药敏试验结果或疗效而予调整。
自从Hansman和Bullen于1967年首次分离到青霉素不敏感肺炎链球菌(PNSP)以来,耐药性肺炎链球菌的相关报道逐渐增加,肺炎链球菌的耐药性已变为全球问题。全球有25%~40%的肺炎链球菌菌株对青霉素耐药[5],而在肺炎链球菌耐药最严重的东亚和东南亚地区,PNSP感染率高达52.4%[22]。本组39例有明确青霉素药敏试验结果的患儿中,青霉素耐药率达53.8%(21/39),亦与此相符。本研究药敏试验结果显示,肺炎链球菌性脑膜炎对万古霉素的敏感率为100.0%(39/39),对红霉素除1例中介外其余均耐药,而对克林霉素的耐药率为100.0%(25/25)。但由于万古霉素渗透至脑脊液中的浓度个体差异较大,且万古霉素联合地塞米松时还可协同影响其渗透性,使脑脊液中药物浓度更低,从而影响临床预后,故即使是对青霉素和头孢菌素高度耐药的菌株,也应再联合使用一种三代头孢类药物,而不单独应用万古霉素[16]。本研究药敏试验结果显示目前肺炎链球菌对氟喹诺酮类抗菌药物及氯霉素的敏感率均为100.0%,但美国食品药物管理局还未批准氟喹诺酮类抗菌药物用于儿童脑膜炎的治疗,目前其仅限于不能使用其他抗生素或其他抗生素治疗无效的成年患者。氯霉素虽为抑菌剂,但其具有良好的血-脑脊液屏障通过性,因此对耐药肺炎链球菌是较好的选择,但其具有明显的骨髓抑制且对多数革兰阴性杆菌仅能起抑制作用,故在我国儿童肺炎链球菌性疾病防治技术指南(2009年版)中,氯霉素被列为在肺炎链球菌性脑膜炎的治疗中需谨慎使用的抗生素[23]。
在一般细菌性脑膜炎的治疗中对于地塞米松的使用是否有益尚有争议。Fan等[24]采用循证医学的方法,对皮质激素在小儿细菌性脑膜炎中的辅助疗效进行了系统科学的研究:皮质激素对降低严重听力损害的效果明显,且能降低流感嗜血杆菌、肺炎链球菌及其他病原菌引起的脑膜炎的病死率,而在病原菌为脑膜炎双球菌的脑膜炎中其病死率下降无统计意义。发达国家主张在小儿细菌性脑膜炎中尽早使用皮质激素辅助治疗[25]。美国儿科学会感染性疾病委员会建议B型流感嗜血杆菌性脑膜炎儿童可以用皮质激素治疗,>6周龄的肺炎链球菌性脑膜炎患儿也可以使用[26]。目前国内主张对确诊或疑似为肺炎链球菌相关性急性脑膜炎者,在使用抗感染药物前10~20 min或至少在其同时应予以糖皮质激素(地塞米松0.15 mg/kg,1次/d,用药2~4 d[27])以减少听力损害的发生。本组98例患儿中90例均于外院或我院在病程初期治疗过程中与抗生素同时或在其之前使用糖皮质激素地塞米松或甲泼尼龙,另有8例外院激素使用情况不详且来我院时病程已超过2周,而未再应用地塞米松;其中治愈及明显好转者达69例,故推荐肺炎链球菌性脑膜炎的治疗方案为万古霉素+三代头孢或美罗培南,同时给予糖皮质激素治疗。
3.5 并发症及预后不良相关因素分析 在孟加拉国进行的关于肺炎链球菌性脑膜炎神经系统后遗症的研究显示,听力损害、视力损害、意识状态和精神运动缺陷在短期随访中的发生率分别为33%、8%、41%、49%,而在长期随访中的发生率分别为18%、4%、41%、35%[28]。肺炎链球菌性脑膜炎的幸存者中常可见到造成终身残疾的后遗症,其发生率高于流感嗜血杆菌和脑膜炎双球菌导致的后遗症发生率[29]。本组患儿虽经积极治疗,但在治疗过程中仍发生较多的并发症,共75例患儿至少发生1种及以上神经系统或其他系统的较严重并发症,如听力损害、硬膜下积液、脑疝、惊厥持续状态、中枢性呼吸衰竭等,且<1岁患儿并发症发生率高于1~5岁组和>5岁组。提示肺炎链球菌性脑膜炎尤其是<1岁的婴幼儿有较高的并发症发生率,且预后不乐观。
本组预后不良发生率为29.6%,与Dolores[30]报道结果相符。Biesheuvel等[31]报道男性患儿也是细菌性脑膜炎预后不良的因素之一。在本研究中男性明显多于女性,其比例为2.16∶1,但未发现性别对预后有影响价值。本研究中年龄、C反应蛋白>100 mg/L、血钠<135 mmol/L、血钙<2.2 mmol/L在单变量分析及多元Logistic回归分析中均有统计学意义,提示其可作为肺炎链球菌性脑膜炎预后不良的指标。既往也有文献报道白细胞计数升高或降低可作为细菌性脑膜炎预后不良指标[32],但本研究显示白细胞计数升高或降低不能作为肺炎链球菌性脑膜炎患儿预后不良的影响因素。考虑与患儿来院就诊时病程差异较大且大部分已应用过抗生素从而影响白细胞计数有关。有研究显示C反应蛋白在临床上与疾病的病情进展及预后密切相关[33]。本研究显示C反应蛋白>100 mg/L可作为肺炎链球菌性脑膜炎患儿预后的影响因素之一,与王靖等[34]报道的单独检测血清C反应蛋白水平可作为脑损伤的重要生化指标一致。
有文献报道低钠血症与小儿细菌性脑膜炎预后不良有关[35]。本研究提示血钠降低是肺炎链球菌性脑膜炎患儿预后的影响因素,与之相符。岳少杰等[36]对颅高压患儿的降颅压治疗进行回顾性分析发现,在常规应用甘露醇的基础上合用高渗含钠液治疗小儿感染性脑水肿,其疗效优于甘露醇常规治疗,也证明了防治低钠血症对改善小儿中枢神经系统感染性疾病的预后至关重要。
本研究显示血钙<2.2 mmol/L亦可作为肺炎链球菌性脑膜炎患儿预后的影响因素。钙离子在神经兴奋性的维持、神经递质的合成和分泌等生命活动中起重要作用,且细胞内很多酶受钙离子的调节[37],有研究表明细胞损伤与细胞内钙离子浓度过高有关[38]。细胞内钙超载和脑组织钙离子积聚可以加速神经元膜磷脂降解,破坏血-脑脊液屏障,影响酶活性,改变细胞膜对离子的通透性,造成神经元破坏甚至死亡。在中枢神经系统感染早期出现血钙浓度降低往往提示机体存在严重应激反应,可加重细胞损伤,故在肺炎链球菌性脑膜炎的临床治疗中应定期监测血钙变化并及早控制过度应激反应,以改善预后。
肺炎链球菌性疾病现已成为全球一个重要的公共卫生问题,肺炎链球菌也是严重威胁我国儿童健康的主要病原菌之一。其沉重的疾病负担使得WHO将预防肺炎链球菌性疾病作为发达国家和发展中国家的重点工作[39]。而接种肺炎链球菌疫苗是特异性的预防措施。全球<5岁的儿童,通过接种疫苗可预防死亡的疾病中肺炎链球菌感染占28%,排名首位[39]。美国自2000年批准对婴儿常规使用一种7价的肺炎链球菌结合疫苗后,其国内侵袭性肺炎链球菌感染性疾病减少了90%[5],故WHO将肺炎链球菌性疾病列为优先使用疫苗预防的感染性疾病[26]。目前肺炎链球菌感染引发的疾病尤其是肺炎链球菌性脑膜炎是可控可防的,但要求临床高度重视,及早发现并及时进行预防接种。
1 Yogev R,Guzman-Cottrill J.Bacterial meningitis in children:Critical review of current concepts[J].Drugs,2005,65(8):1097-1112.
2 Yao KH,Yang YH.Streptococcus pneumoniae disease in Chinese children:Past,present and future[J].Vaccine,2008,26(35):4425-4433.
3 Mathers CD,Lopez AD,Murray CJL.The burden of disease and mortality by condition :Data, methods and results for 2001[M]//Lopez AD,Mathers CD,Ezzati M,et al.Global burden of disease and risk factors.Oxford University Press and The World Bank,2006:45-270.
4 Peltola H.Burden of meningitis and other severe bacterial infections of children in Africa:Implications for prevention[J].Clin Infect Dis,2001,32(1):64-75.
5 Saez-Llorens X,McCracken Jr GH.Bacterial meningitis in child[J].Lancet,2003,361(9375):2139-2148.
6 Molyneux E,Riordan FA,Walsh A.Acute bacterial meningitis in children presenting to the Royal Liverpool Children′s Hospital,Liverpool,UK and the Queen Elizabeth Central Hospital in the Blantyre,Malawi:A world of difference[J].Ann Trop Paediatr,2006,26(1):29-37.
7 余佳,蔡方成.化脓性脑膜炎的临床研究进展[J].儿科药学杂志,2006,12(3):61-63.
8 樊寻梅,周永涛.化脓性脑膜炎[M]//胡亚美,江载芳.诸福棠实用儿科学(上册).7版.北京:人民卫生出版社,2002:912-926.
9 Kastenbauer S,Pfister HW.Pneumococcal meningitis in adults:Spectrum of complications and prognostic factors in a series of 87 cases[J].Brain,2003,126(Pt 5):1015-1025.
10 廉荣镇,肖能.脑膜炎患儿脑脊液中肺炎链球菌的耐药性初步分析[J].当代医学,2011,17(3):138-139.
11 董柏青,唐振柱,林枚,等.广西地区5岁以下儿童细菌性脑膜炎流行病学监测[J].中华流行病学杂志,2004,25(5):422-425.
12 刘心洁,孙若鹏.大鼠肺炎链球菌性脑膜炎病理机制及干预措施的初步研究[J].中华儿科杂志,2005,43(4):294-296.
13 Brautest LV,Heiby EA,Syvenrsen G,et al.Invasive pneumoccal disease in children in Oslo 1998-2004[J].Tidsskr Nor Laegeforen,2008,128(12):1380-1383.
14 Ortqvist A,Hedlund J,Kalin M,Streptococcus pneumoniae epidemiology,risk factors,and clinical features[J].Semin Respir Crit Care Med,2005,26(6):563-574.
15 Madhi SA,Klugman KP,Vaccine Trialist Group.A role for Streptococcus pneumoniae in virus-associated pneumonia[J].Nat Med,2004,10(8):811-813.
16 陶陈娟.儿童化脓性脑膜炎108例临床分析[J].临床儿科杂志,2010,28(1):51-54.
17 张丽丽,袁宝强,程华,等.216例化脓性脑膜炎临床分析[J].实用诊断与治疗杂志,2008,22(5):330-331,334.
18 吴保敏,张伟,王华.先天性皮毛窦12例报告[J].中国实用儿科杂志,2006,21(6):465.
19 李鸿,张玉琴.不同年龄化脓性脑膜炎临床特点及致病菌分析[J].中国实用儿科杂志,2009,24(3):206-208.
20 Tunkel AR,Hartnan BJ,Kaplan SL,et al.Practice guidelines for the management of bacterial meningitis[J].Clin Infect Dis,2004,39(9):1267-1284.
21 MacGowan AP,on behalf of the BSAC Working Parties on Resistance Surveillance.Clinical implications of antimicrobial resistance for therapy[J].J Antimicrob Chemother,2008,62(Suppl 2):105-114.
22 Song JH,Jung SI,Ko KS,et al.High prevalence of antimicrobial resistance among clinical streptococcus pneumoniae isolates in Asia(an ANSORP Study)[J].Antimicrob Agents Chemother,2004,48(6):2101-2107.
23 中华医学会儿科学分会,中华预防医学会.儿童肺炎链球菌性疾病防治技术指南(2009年版)[J].中华儿科杂志,2010,48(2):104-111.
24 Fan J,Zhu Y,Chen GH,et al.Evidengce of probiotics in curing gastro in testinal diseases in children[J].J Chin Pediatr,2005,23(5):328-330.
25 EI Bashir H,Laundy M,Booy R.Diagnosis and treatment of bacterical meningitis[J].Arch Dis Child,2003,88(7):615-620.
26 Pickering LK.Red Book:2003 report of the committee on infections diseaaes[M].26th ed.Amercan Academy of Pediatrics,2003:293-493.
27 张友智.肺炎球菌性疾病防治近况[J].抗感染药学,2011,8(2):88-91.
28 Saha SK,Khan NZ,Ahmed AS,et al.Neurodevelopmental sequelae in Pneumococcal meningitis cases in Bangladesh:A comprehensive follow-up study[J].Clin Infect Dis,2009,48(Suppl 2):S90-S96.
29 Baraff LJ,Lee SI,Schriger DL.Outcomes of bacterial meningitis in children:a meta-analysis[J].Pediatr Infect Dis J,1993,12(5):389-394.
30 Dolores L.Risk factors for mortality in Paraguayan children with pneumococcal bacterial meningitis[J].Tropical Medicine and International Health,2005,10(12):1235-1241.
31 Biesheuvel CJ,Koomen I,Vergouwe Y,et al.Validating and updating a prediction rule for neurological sequelae after childhood bacterial meningitis[J].Scand J Infect Dis,2006,38(1):19-26.
32 Chang CJ,Chang WN,Huang LT,et al.Cerebral infarction in perinatal and childhood bacterial meningitis[J].QJM,2003,96(10):755-762.
33 贾金广,刘艳红,于洪涛.前白蛋白、C反应蛋白和D-二聚体在肺炎并感染性休克患者中的动态变化[J].河北医药,2010,32(1):52
34 王靖,谷野.C反应蛋白检测对小儿中枢神经系统感染的临床意义[J].中国实验诊断学,2011,4(15):698-699.
35 Chao YN,Chin NC,Huang FY.Clinical features and prognostic factors in childhood pneumococcal meningitis[J].J Microbiol Immunol Infect,2008,41(1):48-53.
36 岳少杰,虞佩兰.小儿急性细菌性脑膜炎液体疗法新进展[J].中国实用儿科杂志,2004,19(11):693-695.
37 沈茂星,林慈.细胞内钙稳态失调与缺氧缺血性细胞损害[J].国际儿科学杂志,1991,18(1):13.
38 李海波,张波,惠晓梅,等.小儿病毒性脑膜炎血钙浓度变化及临床意义探讨[J].小儿急救医学,2004,11(1):45.
39 Center for Disease Control and Prevention(CDC).Vaccine preventable deaths and global immunization vision and strategy,2006-2015[J].MMWR Morb VVkly Rep,2006,55(18):511-515.
