负载卵清蛋白的树突细胞体内回输对过敏性哮喘的影响
2014-02-08蔺丽慧刘亚楠戴慧蓉王玉萍
李 飞,蔺丽慧,王 娟,李 佳,彭 霞,肖 辉,刘亚楠,戴慧蓉,王玉萍,李 莉
过敏性哮喘是一种以肺部嗜酸粒细胞浸润、黏液分泌增加和气道高反应性为特征的慢性气道性疾病,发病机制复杂,其中Ⅰ型超敏反应被认为是其主要机制,现已发现多种细胞参与此过程,如树突细胞、T细胞、B细胞以及肥大细胞[1]。树突细胞是来自骨髓的一群异质细胞,分布于大多数外周组织中。位于鼻、气管、支气管、肺泡和脏层胸膜在内的整个肺组织的树突细胞能主动捕获、加工处理外来抗原,并由主要组织相容性复合体Ⅱ类分子(MHCⅡ)完成抗原提呈,一旦其进入发育成熟阶段即失去这种捕获能力;与此同时进入成熟阶段的树突细胞在形态和功能方面发生巨大变化,其表面MHC、协同刺激分子和黏附分子表达增多,导致树突细胞激活T细胞的能力增强,进而引起免疫应答[2]。树突细胞作为目前已知的体内功能最强的专职抗原递呈细胞在此过程中占据关键地位[3]。
此前对于哮喘的研究多集中在Th1/Th2平衡和肥大细胞脱颗粒等方面[4],但对于树突细胞在过敏性哮喘发病中所发挥的作用却少有报道。有研究表明哮喘患者外周血中树突细胞的比例和绝对数量均有不同程度的升高[5]。本实验拟通过尾静脉注射树突细胞,然后致敏和激发,观察小鼠的生命状态、脾脏的增生情况、肺泡灌洗液中的组胺水平、肺组织炎性反应情况,进一步揭示树突细胞在哮喘发病中发挥的作用,为哮喘的预防和治疗提供理论依据。
1 材料与方法
1.1 实验动物、试剂及仪器 雄性BALB/c(H-2d)小鼠30只,6~8周龄,体质量20~25 g,购自上海必凯实验动物中心,饲养在SPF级实验动物饲养设施中。RPMI 1640全培养液〔含RPMI 1640培养基(GIBCO公司)、10%胎牛血清(GIBCO公司)、100 U/ml青霉素、100 U/ml链霉素及50 μmol/L 2-巯基乙醇(Amerco公司)〕。红细胞裂解液由本室配制。重组小鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)及重组白介素4(rmIL-4,Peprotech公司),脂多糖(LPS)和二甲基亚砜(DMSO,Sigma公司),CCK-8试剂盒(Cell Counting Kit-8,Dojindo公司)。荧光抗体:抗小鼠CD11c抗体,抗小鼠MHC Ⅱ抗体,抗小鼠CD86抗体(Biolegend公司)。流式细胞仪FC500(Beckman Coulter公司),倒置显微镜(Olympus公司)。恒温培养箱(SANYO MCO-175),酶标仪(Thermo MK-3)。
1.2 骨髓源性树突细胞(BMDC)的培养 无菌取出骨髓细胞,裂解红细胞,用RPMI 1640全培养液配成1×106cell/ml的单细胞悬液。接种于6孔培养板,每孔5 ml,加入rmGM-CSF(终浓度10 ng/ml)及rmIL-4(终浓度10 ng/ml),置于37 ℃、5%CO2培养箱中培养。第4天时吸弃全部培养基,并沿培养板壁缓慢加入3 ml RPMI 1640,缓慢均匀摇晃培养板30 s,吸去培养基,重复洗涤1次,尽可能清除悬浮细胞。然后加入等量RPMI 1640全培养液和rmGM-CSF及rmIL-4,第7天轻轻吹打后收获悬浮细胞[6]。部分实验于第6天加入1 μg/ml LPS或者10 μg/ml OVA。
1.3 树突细胞形态学观察 于倒置显微镜下观察树突细胞的形态。
1.4 树突细胞表面标志物检测 收集培养的细胞约5×105个悬于100 μl磷酸盐缓冲液(PBS),加入荧光素标记的各种单克隆抗体1 μl,4 ℃避光孵育30 min,离心去上清液,加入2 ml PBS清洗细胞1次,然后将细胞重悬于0.5 ml PBS,上流式细胞仪检测细胞表面CD11c、CD86及MHCⅡ表达情况。
1.5 树突细胞回输及哮喘模型的建立 小鼠采用随机数字表法分为3组,每组10只。健康对照组不做任何处理;哮喘组给予PBS,然后致敏和激发;OVA-DC干预组尾静脉注射负载OVA的树突细胞 1×106个,然后致敏和激发。哮喘组和OVA-DC干预组第1天给予干预,第7天、第14天分别腹腔注射0.2 ml OVA和氢氧化铝〔Al(OH)3〕混悬液〔含20 mg OVA和2 mg Al(OH)3〕,第27、28、29天连续给予1% OVA混悬液雾化吸入,30 min/次。
1.6 观察生存状态 在进行实验过程中密切观察小鼠的呼吸情况、体力活动以及生命状态。
1.7 混合淋巴细胞反应(MLR) 颈椎脱臼法处死小鼠,无菌条件下取出脾脏,制备脾脏单细胞悬液。裂解红细胞,获得同种异体脾脏细胞作为反应细胞。培养获得的树突细胞作为刺激细胞,用RPMI 1640培养液悬浮,调整密度为5×106cell/ml,加入终质量浓度为25 ng/ml的丝裂霉素C,37 ℃孵育45 min。PBS清洗后用RPMI 1640培养液重悬,分别以1.25×103/孔、2.50×103/孔、5.00×103/孔、10.00×104/孔96孔培养板,每组设3个复孔,每孔再加入1×105个同种异体T细胞,终体积为200 μl,设单纯T细胞组为对照组,另设空白组。于37 ℃、5%CO2条件下培养72 h。各孔加入CCK-8 10 μl,置培养箱4 h,用酶标仪测A450值,取3孔的平均值作为结果,计算刺激指数(SI),SI=(实验组A值-空白组A值)/(对照组A值-空白组A值)。
1.8 测定脾脏质量 取出小鼠脾脏,观察脾脏大小,并用计量器准确称量其质量。
1.9 肺泡灌洗液组胺水平检测 雾化后24 h麻醉小鼠,暴露气管,气管插管并固定,结扎右侧主支气管,用1 ml注射器吸取0.3 ml PBS,接入气管针,来回反复抽吸5次,收集灌洗液。重复灌洗两次。每只小鼠共用0.9 ml PBS,回收灌洗液置于1只EP管中,混匀,-20 ℃保存备用。
1.10 肺组织苏木素-伊红(HE)染色 取右侧未行肺泡灌洗的肺组织,置于甲醛固定液中固定24 h以上,脱水,石蜡包埋,切片后行HE染色,镜下观察并摄影。
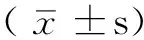
2 结果
2.1 树突细胞的形态 每只小鼠的股骨和胫骨共可分离(1.5~2.0)×107个骨髓细胞,培养2 d后,倒置显微镜下可见部分细胞贴壁生长,分布均匀,有细胞聚集现象,细胞大小比较一致,呈圆形。第3天时,可见大量细胞集落,紧密贴壁,极少数细胞从集落周边脱落,细胞呈圆形,但可见少数棘突样结构突出于细胞表面,细胞体积有所增大(见图1A)。培养第4、5天,细胞集落继续变大,细胞形态不规则,周边棘突增多。第6、7天,细胞不断从集落上脱落下来,细胞集落变小,多数细胞呈悬浮状态,大小不均匀,形态亦不规则,周边布满指状突起(见图1B)。

注:A第3天大量细胞集落贴壁生长,细胞呈圆形,大小一致(×100);B 第6天细胞集落呈悬浮状态,表面可见指状的细胞突起(×200),右下角为树突细胞表面情况,可见明显的树突状结构(×400)
图1 树突细胞培养
Figure1 Culture of DCs
2.2 树突细胞的免疫表型检测 流式细胞术分析显示,细胞中CD11c的阳性率大于80%,所获得的树突细胞的纯度很好,可以用于体内回输。对未经处理的树突细胞、负载OVA的树突细胞和LPS刺激后的树突细胞分别检测MHCⅡ和CD86表达情况,结果显示未经处理的树突细胞和负载OVA的树突细胞表达MHCⅡ和CD86的阳性率低,且表达水平低;而LPS刺激后的树突细胞两种分子的阳性率增高,且表达水平提高(见图2)。
2.3 树突细胞刺激MLR检测 CCK-8检测MLR显示,未经处理的树突细胞和负载OVA的树突细胞刺激淋巴细胞增殖能力一样,仅在树突细胞:淋巴细胞为1∶10时才能刺激淋巴细胞增殖,但LPS刺激后的树突细胞却能极大地促进淋巴细胞的增殖(见图3)。

图2 树突细胞表面膜分子的表达
注:SI=刺激指数
图3 混合淋巴细胞增殖试验
Figure3 Mixed lymphocyte proliferation test
2.4 树突细胞回输后实验小鼠的生存状态 在实验过程中,密切观察小鼠的生存状态。第1天,健康对照组、哮喘组、OVA-DC干预组小鼠未见任何异常。第7天腹腔注射OVA后,哮喘组和OVA-DC干预组小鼠行为稍显迟缓,5~6 h后恢复正常。第14天腹腔注射OVA后,哮喘组小鼠行为迟缓,但对外界干扰有反应,6 h后恢复正常;OVA-DC干预组小鼠趴伏不动,对外界干扰无反应,且在2 h内可见大部分小鼠死亡,余下活鼠24 h后恢复正常。第27、28、29天连续雾化吸入1% OVA,雾化过程中可见哮喘组和OVA-DC干预组小鼠打喷嚏。
2.5 树突细胞回输后小鼠脾脏质量变化 第14天腹腔注射OVA后,解剖小鼠取出脾脏,3组小鼠脾脏质量比较,差异有统计学意义(P<0.05),OVA-DC干预组较健康对照组和哮喘组升高,哮喘组较健康对照组升高,差异均有统计学意义(P<0.05,见图4、表1)。
2.6 肺泡灌洗液组胺水平检测 通过气管插管收集肺泡灌洗液,回收率约为80%。ELISA法检测结果显示,3组肺泡灌洗液组胺水平比较,差异有统计学意义(F=613.00,P=0.000),OVA-DC干预组较健康对照组和哮喘组升高,哮喘组较健康对照组升高,差异均有统计学意义(P<0.05,见图5)。

表1 3组脾脏质量比较
注:与OVA-DC干预组比较,*P<0.05;与哮喘组比较,△P<0.05
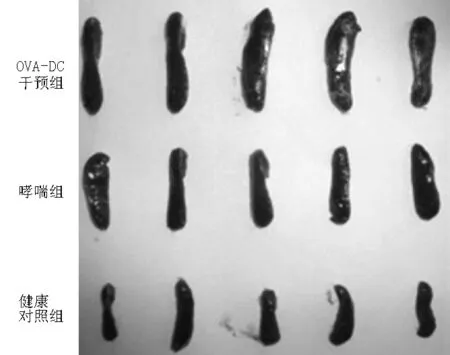
图4 各组小鼠脾脏大体形态

图5 3组组胺水平比较
2.7 肺组织HE染色 HE染色显示OVA-DC干预组小鼠肺组织气道管壁增厚,周围有大量炎性细胞浸润;哮喘组小鼠炎性反应较轻;健康对照组小鼠未发现炎性反应的特征(见图6)。
3 讨论
树突细胞作为机体最强大的抗原提呈细胞,可以摄取、加工和提呈抗原,激活初始T淋巴细胞,能介导强烈的免疫系统对异物进行识别和清除,是免疫系统的“卫士”[7]。此外,树突细胞还可以介导免疫耐受,在免疫自稳、移植物耐受中发挥重要作用[8-11]。树突细胞与过敏性疾病发生密切相关,参与过敏反应的始动环节[12],因此,其在过敏性疾病中的研究应用已受到人们的关注。
过敏性哮喘的发病机制主要是Ⅰ型超敏反应,目前有越来越多的研究表明,过敏性哮喘患者体内树突细胞在功能上存在一定异常,有偏向Th2反应的趋势[4]。哮喘患者肺组织和外周血中树突细胞的数目也明显增加,且在过敏性哮喘患者急性发病期,其外周血CD86、MHCⅡ表达明显增高[5]。这些研究均表明树突细胞在过敏性哮喘的发病机制中发挥重要作用。

注:A为健康对照组,B为哮喘组,C为OVA-DC干预组
图6 肺组织HE染色(×40)
Figure6 HE staining of lung tissues
本实验诱导小鼠骨髓细胞分化为树突细胞并负载OVA,流式细胞术检测结果显示负载OVA的树突细胞和未处理的树突细胞相比,MHCⅡ分子和CD86的表达量均处于低水平,且平均荧光强度很低,而用LPS刺激后的树突细胞MHCⅡ分子和CD86的表达出现爆发式的升高,表明树突细胞在负载OVA后仍处于未成熟状态,该结果与吴卫疆等[13]报道的情况一致。MLR也表明负载OVA的树突细胞仍处于未成熟状态,其刺激淋巴细胞增殖的能力与未成熟树突细胞相当,仅当树突细胞与淋巴细胞的比例在1∶10时能微弱地刺激淋巴细胞增殖,而LPS刺激后的树突细胞能强烈地刺激淋巴细胞增殖。尾静脉注射负载OVA的树突细胞后经过致敏和激发,肺组织HE染色显示,OVA-DC干预组小鼠肺组织支气管黏膜水肿、增厚,周围有大量炎性细胞浸润,其炎症表现明显强于哮喘组小鼠。肺泡灌洗液中的组胺水平与肺组织HE结果一致。此外,本研究还通过腹腔注射OVA-DC,其实验结果与尾静脉注射相同。这一发现与之前的报道完全相反,负载OVA的树突细胞经腹腔注射给小鼠后可以在一定程度上抑制过敏性哮喘[12]。本实验中,OVA-DC干预组小鼠在第二次给予腹腔注射OVA后,小鼠活动显著减少,对外界干扰无反应,生命状态极差,2 h内一半以上的小鼠死亡,尸检发现脾脏极度增大,其体积是正常小鼠的3倍以上,也显著大于哮喘组小鼠的脾脏,其余组织未发现异常。对于OVA-DC干预组小鼠的死亡,可能是因为强烈的免疫反应所致,但具体原因未能明确。本实验结果进一步表明,将负载OVA的树突细胞尾静脉注射或腹腔注射给小鼠会加重小鼠的过敏性哮喘反应,并可能导致小鼠死亡。可能是因为负载OVA的树突细胞在进入小鼠体内后进一步成熟,高表达MHCⅡ、CD86以及其他和抗原提呈相关的分子,然后激活T细胞发挥免疫反应。相关的文献报道,过敏性哮喘患者外周血中树突细胞高表达MHCⅡ、CD80、CD86等与抗原提呈相关的分子[5,14]。此外,哮喘小鼠模型肺组织中树突细胞也高表达MHCⅡ和CD80等共刺激分子[15-17]。并且在有过敏原刺激时,血液中的树突细胞可以被募集到肺组织[18-19]。这些发现都说明树突细胞在过敏性哮喘中发挥重要作用。
本研究发现将负载抗原的树突细胞回输至小鼠体内可以诱导小鼠产生强烈的免疫反应,能加重过敏性哮喘反应的严重程度,并能引起小鼠死亡。表明树突细胞在血液和肺组织中数量的增加和抗原提呈相关分子的高表达都能促进哮喘的发生。进一步说明树突细胞在过敏性哮喘的发病机制中发挥重要作用,为哮喘的预防和治疗提供新的理论依据。对于负载抗原的树突细胞回输至体内能增强机体的免疫反应这一作用,还可能为其他疾病,如感染性疾病、肿瘤等疾病的预防和治疗提供新思路。
1 Murphy DM,O′Byme PM.Recent advances in the pathophysiology of asthma[J].Chest,2010,137(6):1417-1426.
2 Sousa RC,Sher A,Kaye P.The role of dendritic cells in the induction and regulation of immunity to microbial infection[J].Curr Opin Immunol,1999,11(4):392-399.
3 Lambrecht BN.The dendritic cell in allergic airway diseases:a new player to the game[J].Clin Exp Allergy,2001,31(2):206-218.
4 Hammad H,Charbonier AS,Duez C,et al.Th2 polarization by Der p 1——pulsed monocyte-derived dendritic cells is due to the allergic status of the donors[J].Blood,2001,98(4):1135-1141.
5 Spears M,McSharry C,Donnelly I,et al.Peripheral blood dendritic cell subtypes are significantly elevated in subjects with asthma[J].Clin Exp Allergy,2011,41(5):665-672.
6 Inaba K,Inaba M,Romani N.Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor[J].J Exp Med,1992,176(6):1693-1702.
7 Steinman RM.Decisions about dendritic cells:past,prisent,and future[J].Annual Review of Immunology,2011,30:1-22.
8 Steinman RM.Dendriticcells:understanding immunogenicity[J].European Journal of Immunology,2007,37(1):53-60.
9 Xin H,Yang W,Wang Q,et al.Immune tolerance of skin allograft transplantation induced by immature dendritic cells of a third party carrying donor antigens in mice[J].Transplantation Proceedings,2013,45(2):552-557.
10 Sela U,Olds P,Park A,et al.Dendritic cells induce antigen-specific regulatory T cells that prevent graft versus host disease and persist in mice[J].The Journal of Experimental Medicine,2011,208(12):2489-2496.
11 Steinman RM,Hawiger D,Nussenzweig MC.Tolerogenic dendritic cells[J].Annual Review of Immunology,2003,21:685-711.
12 Galli SJ,Tsai M,Piliponsky AM.The development of allergic inflammation[J].Nature,2008,454(7203):445-454.
13 吴卫疆,珪建,夏大静,等.耐受性树突状细胞对哮喘小鼠气道变应性炎症反应的抑制作用[J].江苏大学学报:医学版,2007,17(4):285-289.
14 黄建安,张腊娣,於葛华,等.共刺激分子B7-CD28/CD152在过敏性哮喘中的作用[J].江苏医药杂志,2003,29(11):806-807.
15 李俊,杨炯,郭卫,等.过敏性哮喘患者树突状细胞接触变应原前后的表型变化[J].中国临床康复,2006,10(4):85-88.
16 王耀丽,钱桂生,程晓明.肺脏树突状细胞表面共刺激分子在小鼠哮喘模型中的表达[J].免疫学杂志,2006,23(2):195-198.
17 刘焕星,曹平.调节性树突状细胞对哮喘小鼠气道炎症及白介素12和IgE表达的影响[J].中国全科医学,2012,15(6):2063.
18 Vassalo R.The pulmonary dendritic/langerhans cell immunity and disease[J].Clin Pulm Med,2005,12(2):84-89.
19 Master BJ.Initiation of lung immmunity:the afferent limb and the role of dendritic cells[J].Semin Respir Crit Care Med,2004,25(1):11-20.
