HCCR mRNA在原发性肝细胞癌患者中的表达及临床意义
2014-02-07张华钟白云张秋焕
张华,钟白云,张秋焕
(1、益阳市中心医院检验科,湖南益阳413000;2、中南大学湘雅医院检验科,湖南长沙410008)
·论著·
HCCR mRNA在原发性肝细胞癌患者中的表达及临床意义
张华1,钟白云2,张秋焕2
(1、益阳市中心医院检验科,湖南益阳413000;2、中南大学湘雅医院检验科,湖南长沙410008)
目的探讨人宫颈癌基因(human cervical cancer oncogene,HCCR)mRNA在原发性肝细胞癌(primary hepatocellular carcinoma,PHC)患者中的表达及其临床意义。方法采用RT-PCR检测PHC癌组织、癌旁肝组织和肝硬化组织及各组外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中的HCCR mRNA表达水平,并进行分析。结果HCCR mRNA在PHC组织中的相对表达强度为0.83±0.10,癌旁肝组织中的相对表达强度为0.12±0.07,肝硬化组织中的相对表达强度为0.57±0.12,三组均数间两两比较,差异均有统计学意义(P<0.05)。PBMC中,肝癌患者HCCR mRNA的表达强度为0.55±0.06,肝硬化患者HCCR mRNA的表达强度为0.34±0.04,而正常人未检测出,差异均有统计学意义(P<0.05)。结论PHC和肝硬化患者的组织和PBMC中HCCR表达明显增高,HCCR基因可能参与了PHC的发生与发展,其与PHC的恶变演进有一定的相关性。
人宫颈癌基因;原发性肝细胞癌;肝硬化;mRNA
原发性肝细胞癌(primary hepatocellular carcinoma,PHC)是常见的消化道肿瘤之一,其一般起病隐匿,早期症状不明显,确诊时多属晚期,治疗效果差,预后恶劣,因此开展早期检测、诊断和治疗,对PHC患者尤为重要[1]。有研究表明,由Ko J等用差异RT-PCR法从宫颈癌癌组织筛选得到的差异表达基因人宫颈癌基因(Human cervical cancer oncogene,HCCR)与PHC关系密切,可能在PHC早期发生中起“主导”作用[2,3]。笔者在本研究的前期工作中应用ELISA对HBV相关性肝脏疾病患者的血清HCCR水平进行检测,发现HCCR随着HBsAg的升高而升高。本研究应用逆转录PCR (RT-PCR)和琼脂糖凝胶电泳分析组织和外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中HCCR的水平,旨在探讨HCCR基因是否参与了肝细胞癌的发生与发展,及其与PHC的恶变演进是否有一定的相关性。
1 材料与方法
1.1 研究对象40份肝细胞癌标本来自益阳市中心医院2013年1月至2014年3月住院病人手术切除标本,男24例,女16例,平均年龄43±12岁,均经病理检查证实为原发性肝细胞癌(PHC),所有标本手术前未经过放疗、化疗、微波刀、介入等针对肿瘤的任何治疗,有手术前后完整的病案资料;每例病人分别取肿瘤组织和远端癌旁组织(距肿瘤边2~5cm,病理学证实为正常组织),组织均冻于液氮备用。40例肝硬化标本来自肝穿刺活检标本,经病理检查证实为肝硬化,其中男22例,女18例,平均年龄40±15岁;对照组40例来自肝功能正常及其它肝炎病毒标志物均为阴性的本院健康体检者。所有研究对象排除脑、肺、肾、胰等器官疾病及女性宫颈癌疾病。
1.2 主要试剂Trizol RNA提取试剂盒系AMV TaKaRa生物公司产品,Ficoll分离液、Hank’s液系上海研卉生物科技有限公司产品,Tris碱、逆转录酶(M-MLV)、5×定量PCR Buffer、dNTPs、引物、探针、TaqDNA聚合酶、5×逆转录Buffer、Rnase抑制剂购自北京达安基因股份有限公司,氯仿、异丙醇、溴化乙锭、二甲苯青FF、DEPC水、琼脂糖购自国药集团化学试剂有限公司,100bp DNA Marker购自百川开泰生物技术有限公司。
1.3 方法
1.3.1 PBMC中提取总RNA采用Ficoll分离液得到其PBMC,-80℃超低温冰箱冻存备用。然后参照Trizol RNA提取试剂盒说明书进行操作。
1.3.2 组织中RNA的提取将存于液氮中的组织取出50mg,迅速移于预冷的研钵中,用研杵研磨组织,其间不断加入液氮,成粉末状后,同样参照Trizol RNA提取试剂盒说明书进行操作。最后用移液管加入DEPC水,使RNA完全溶解。
1.3.3 总RNA纯度、浓度及完整性测定在200μl PCR管中加入1.0μl RNA原液,加DEPC水至100μl,移液枪反复吹打混匀。采用紫外分光光度计测定A260、A280值,计算A260/A280比值。比值≥1.8满足要求。RNA原液浓度=A260×稀释倍数×100(ng/ μl)。电泳检测结果出现明显的5S、18S和28S的三个条带者视为RNA结构完整(图1),符合RT-PCR实验要求。

图1 RNA凝胶电泳(M:Marker)
1.3.4 引物设计、合成用软件Premier5.0设计引物,HCCR序列如下,上游S1:5'ACCCC^AAACAACAAACTG3';下游S2:5'ATGGTTCATlll2AGCGCCTr-3',相应的RT-PCR产物大小为579bp。内参设为GAPDH:上游S1∶5'-GGAGCGAGATCCCTCCAAAA-3';下游S2:5'GGCTGTTGTCATACTTCTCATGG-3',产物大小为197bp,引物由Invintrogen公司合成。
1.3.5 cDNA的合成25μl逆转录体系:根据A260算出RNA的浓度,取2.0μgRNA,随机引物2.0μl,5×RT缓冲液4.0μl,10 U/μl Rnase抑制剂1.0μl,25 mmol/L Mg2+l.0μl,10mmol/L dNTP 2.0μl,100 U/μl M-MLV逆转录酶1.0μl,DEPC水补足体系,37℃水浴60 min,94℃灭活逆转录酶,4℃微离心,获取的cDNA于-20℃保存备用。
1.3.6 逆转录-聚合酶链扩增反应(RT-PCR)反应体系为25μl,包括cDNA 1.0μl,Taq缓冲液2.5μl,10mmol/l dNTP1.0μl,25 mmol/L Mg2+1.5μl,2.5U/ μl Taq酶0.4μl,10μmol/L待测HCCR上、下游引物及GAPDH各1.0μl,用DEPC水补至25μl。反应条件:95℃预变性3min,然后95℃变性30s,60℃退火20s,72℃延伸30s,40次循环结束。每一样本的检测均做3个平行管以保证其结果的准确性。
1.3.7 2%琼脂糖凝胶电泳检测RT-PCR产物取10μl PCR产物,加入2μl上样缓冲液,混匀后加样,同时滴加5μl DNA Marker,在80V电压下电泳(根据示踪剂溴酚蓝的迁移距离)。在凝胶电泳成像系统(Image master VDS)下观察、照相。
1.3.8 统计学处理采用SPSS16.0软件进行数据分析,所有计量资料采用x±s表示,多个样本均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 肝细胞癌组织、肝硬化组织和正常肝组织的HCCR基因表达的比较在凝胶电泳成像系统(Image master VDS)下拍照,通过Image master VDS分析软件对照片进行去噪、增强等处理,利用已知浓度内参GAPDH进行定量分析,如图2所示。分析各组的HCCR mRNA表达水平,比较三组HCCR mRNA表达水平,差异具有统计学意义(P<0.05)。各组两两比较发现,肝细胞癌组织中的HCCR mRNA表达水平明显高于肝硬化及癌旁肝组织(P<0.05),其增高次序为:癌旁肝组织<肝硬化<肝细胞癌,如表1所示。
2.2 PHC、肝硬化患者和正常人PBMC中HCCR基因表达的比较PHC与肝硬化患者PBMC的HCCR基因表达水平比较,差异有统计学意义(P= 0.00),而正常人PBMC的HCCR mRNA无表达,三者相比,差异具有统计学意义(P<0.05),如图3,表2所示。
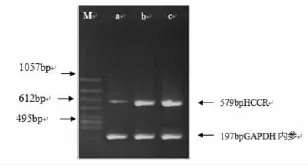
图2 肝细胞癌组织、肝硬化组织和癌旁正常肝组织的HCCR mRNA的含量

表1 肝细胞癌、肝硬化和癌旁正常肝组织中HCCR mRNA的表达情况
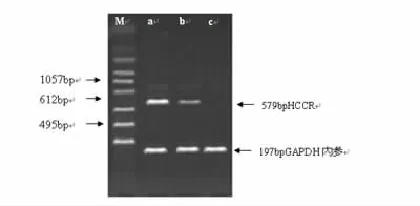
图3 肝细胞癌患者、肝硬化患者和正常人PBMC中HCCR mRNA的含量
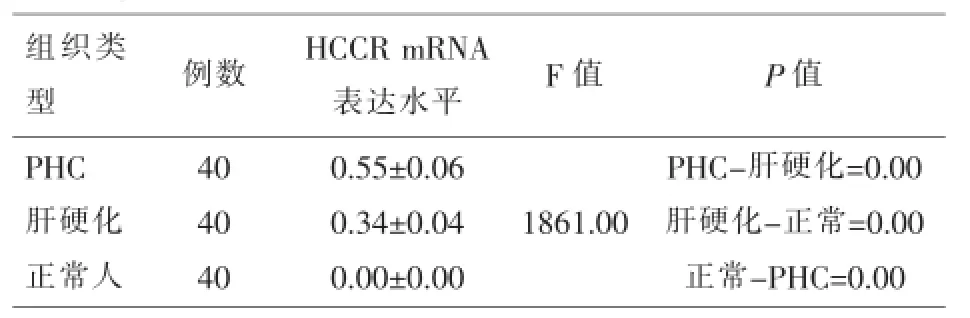
表2 PHC、肝硬化患者和正常人PBMC中HCCR mRNA的表达情况
3 讨论
人宫颈癌基因(human cervical cancer oncogene,HCCR)是近年发现的与人类多种肿瘤有关的基因,系由Ko J等用差异RT-PCR法从宫颈癌癌组织筛选得到的差异表达基因,其定位于人的染色体的12q,编码HCCR-1和HCCR-2两种单跨膜蛋白,分子量分别为42kDa和36kDa[2]。HCCR不仅在宫颈癌组织中表达,而且在许多其他肿瘤(如乳腺、肾、淋巴、胃、结肠、卵巢等)中也可见其呈过量表达,尤其在肿瘤早期就可检测出HCCR过量表达[3]。
本研究结果显示PHC患者的肝细胞癌组织中的HCCR mRNA的相对表达强度为0.83±0.10,而其对应的癌旁正常肝组织为0.12±0.07,肝硬化组织HCCR mRNA的相对表达强度为0.57±0.12,三者相比,差异具有统计学意义(F=539.34,P<0.05)。其增高次序为:癌旁正常肝组织<肝硬化<肝细胞癌,随着临床表现逐步加重逐步升高(P<0.05)。通过对琼脂糖凝胶电泳结果进行分析,HCCR mRNA在PHC组织中的含量明显高于肝硬化及远端癌旁正常肝组织,提示HCCR可用于评价和监测从肝硬化到肝细胞癌的进展过程,HCCR的异常表达与PHC的发生、发展密切相关。有研究使用HCCR的反义核酸转染肝细胞癌细胞系HepG2细胞,结果显示HepG2细胞中的HCCR的表达受抑制,细胞停滞于G1期,通过抑制细胞的增殖从而促进细胞凋亡,提示癌基因HCCR可能在肝细胞癌的病变早期就开始起作用,与PHC的发生发展密切相关[4]。本研究结果与上述观点一致。但HCCR异常表达参与PHC的发生发展机制有待进一步研究。目前认为HCCR参与PHC早期发生的机制可能有:(1)被称为“基因组卫士”的肿瘤抑制基因p53,在机体组织细胞的生长、发育与分化等过程中起重要作用,p53编码序列发生改变是人类肿瘤中普遍的基因改变[5,6]。p53基因是许多恶性肿瘤十分常见的共同基因损伤靶位,它的结构改变与表达异常可能是这些肿瘤发生的中心环节。研究发现包括pHC在内的人类恶性肿瘤中至少有50%发生了p53基因改变,失去了有功能的p53蛋白,野生型p53基因为抑癌基因,突变或其他原因导致其功能失活使p53基因失去抑癌基因作用,这是研究癌基因与抑癌基因相互作用导致肿瘤发生机制的热点之一[7,8]。有研究发现HCCR是肿瘤抑制因子p53的调节因子,通过诱导p53翻译后修饰,抑制泛素依赖性蛋白酶体途径对p53的降解、引起p53转录物活性负性调节等机制使p53功能发生缺陷,从而抑制p53功能来促进癌变[9]。预示其可以作为PHC重要的早期诊断标记物以及基因治疗的作用靶点,因此,深入研究HCCR在肝细胞癌早期诊断中的价值以及其生物学功能具有重要的临床意义。(2)HCCR的致癌作用是通过磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/Akt)途径实现的,PI3K的过量表达能激活HCCR的启动子,即PI3K/Akt途径活化可以促进HCCR表达,HBV编码HBx可以通过PI3K/Akt途径上调HCCR的表达,传递细胞存活的信号,说明在PHC发生和发展过程中,HCCR和HBV可能起着协同作用[10-12]。HCCR在PHC组织中高表达,而在正常肝组织中低表达或不表达,故可以将HCCR作为诊断PHC的一种新的标志物,用于PHC的早期诊断。本研究还发现PHC患者外周血单个核细胞中HCCR mRNA水平高于肝硬化患者,而正常人外周血单个核细胞HCCR mRNA无表达,这意味着血清HCCR蛋白可作为PHC诊断及鉴别诊断的生物学标志物。现已制备了HCCR的多克隆抗体,建立了检测血清HCCR水平的间接ELISA方法,发现PHC患者血清中HCCR水平显著高于脂肪肝(非酒精性)、肝硬化、慢性活动性肝炎等患者,提示血液中HCCR mRNA的水平高低可能与肝病患者的病情发展有关,可用于诊断PHC,与本研究结果一致。
综上所述,HCCR在肝细胞癌肿瘤组织PBMC中有较强表达,提示HCCR可能在PHC的发生发展中起重要作用,HCCR有望成为PHC病情发生、发展及预后评估的重要标志物,在诊断早期PHC及小肝细胞癌等方面具有很好的应用前景。
[1]王颖,姜菲菲,王蕊,等.联合检测血清AFP,HCY和GGT对原发性肝细胞癌的诊断价值[J].现代检验医学杂志,2014,29(1)∶90-93.
[2]KoJ,LeeYH,HwangSY,eta1.Identificationanddifferential expression of novel human cervical cancer oncogene HCCR-2 in humancancersanditsinvolvementinp53stabilization[J]. Oncogene,2003,22(30)∶4679-4689.
[3]Jirun P,Zhang G,Ha SA,et al.HCCR-1 for detecting small hepatocellular carcinoma latent in a cirrhotic live∶a prospective cohort study[J].Gut,2012,61(10)∶1514-1515.
[4]Qiao SS,Cui ZQ,Gong L,et al.Simultaneous measurements of serum AFP,GPC-3 and HCCR for diagnosing hepatocellular carcinoma[J].Hepatogastroenterology,2011,58(110)∶1718-1724.
[5]Liu J,Zhang C,Feng Z.Tumor suppressor p53 and its gain-of-function mutants in cancer[J].Acta Biochim Biophys Sin,2014,46(3)∶170-179.
[6]陈青,邬黎青.p53基因和乳腺癌的相关性研究进展[J].实验与检验医学,2011,29(1)∶57-59.
[7]Kirstein MM,Vogel A.The pathogenesis of hepatocellular carcinoma [J].Dig Dis,2014,32(5)∶545-553.
[8]张佳娜,邬黎青.p53诱导细胞老化的研究进展[J].实验与检验医学,2013,31(1)∶43-45.
[9]Kang GH,Lee BS,Lee ES,et al.Prognostic significance of p53, mTOR,c-Met,IGF-1R,and HSP70 overexpression after the resection of hepatocellular carcinoma[J].Gut Liver,2014,8(1)∶79-87.
[10]Liu H,Xu L,He H,et al.Hepatitis B virus X protein promotes hepatoma cell invasion and metastasis by stabilizing snail protein [J].Cancer Sci,2012,103(12)∶2072-2081.
[11]Xu Z,Zhang Y,Jiang J,et al.Epidermal growth factor induces HCCR expression via PI3K/Akt/mTOR signaling in PANC-1 pancreatic cancer cells[J].BMC Cancer,2010,10∶161.
[12]HCCR-1、P53在宫颈癌及其癌前病变中的表达及其临床意义[J].医学临床研究,2014,31(1)∶133-136.
Relationship between HCCR mRNA and primary hepatocellular carcinoma
ZHANG Hua,ZHONG Baiyun,ZHANG Qiuhuan.Department of Clinical Laboratory,the Central Hospital of Yiyang City,Yiyang Hunan 413000,China
Objective To detect the expression level of HCCR mRNA in primary hepatocellular carcinoma(PHC)and explore its clinical significance.Methods Reverse transcription polymerase chain reaction was used to detect the expression of HCCR mRNA in PHC tissues,surrounding non-tumor tissues,hepatocirrhosis tissues and peripheral blood mononuclear cells.Results The relative expression level of HCCR mRNA in PHC tissues was 0.83±0.10,and which in surrounding non-tumor tissues and the hepatocirrhosis tissues were 0.12±0.07 and 0.57±0.12,respectively.The differences in the three groups had statistical significance (P<0.05).The relative mRNA level of HCCR in the PBMC of PHC patients were 0.55±0.06 and which in the hepatocirrhosis patients were 0.34±0.04,while HCCR expression in the normal ones could not detected.The differences had statistical significance (P<0.05).Conclusion The mRNA levels of HCCR in PHC tissues,hepatocirrhosis tissues and their PBMC are up-regulated significantly,which suggests that HCCR maybe involved in the occurrence and development of PHC,and maybe related to the malignant change of PHC.
Human cervical cancer oncogene;Primary hepatocellular carcinoma;Hepatocirrhosis;mRNA
R735.7,R446.62
A
1674-1129(2014)06-0654-04DOI∶10.3969/j.issn.1674-1129.2014.06.002
2014-09-02;
2014-10-08)
湖南省自然科学基金项目(NO.12JJ3089)
张华,男,出生于1981年,硕士,主管检验师,主要从事分子生物和生物化学的实验研究。
