BD Influx流式细胞分选仪参数调试和最佳条件的设定*
2014-02-07梁昊岳杨晚竹程雪莲王金宏
梁昊岳 杨晚竹 程雪莲 纪 庆 张 岘 王金宏*
BD Influx流式细胞分选仪参数调试和最佳条件的设定*
梁昊岳① 杨晚竹① 程雪莲① 纪 庆① 张 岘① 王金宏①*

目的:探索BD Influx流式细胞仪分选细胞亚群的调试参数和最佳设定条件。方法:使用两种质控试剂Rainbow Beads和Accudrop Beads作为实验材料,对BD Influx流式细胞仪的针孔、液流、荧光通道、前向角散射光信号、液滴频率、振幅和液滴延迟等参数进行优化。结果:使用型号为100 μm的喷嘴,在液流聚焦清楚、液柱打入废液收集管的正中央、荧光光斑进入针孔中央且最亮、前向角散射(FSC)光光斑进入针孔中央且最亮、断点最高、液流分叉呈稳定的亮点、振幅为5.20±1.00以及液滴延迟为35.20±2.00等最佳设定条件下,其细胞样本分选纯度可达99%,工作效率可达95%。结论:流式细胞仪分选参数条件的设定,可为获得高纯度、高活性的细胞提供快速调试方法。
流式细胞术;细胞分选;分选参数;最佳条件
[First-author’s address] State Key Laboratory of Experimental Hematology, Institute of Hematology & Blood Disease Hospital, Chinese Academy of Medical Sciences & Peking Union Medical College, Tianjin 300020, China.
流式细胞术在免疫学、肿瘤学及血液学等方面的应用已获得广泛认可和关注[1-4]。在药物高通量筛选方面,流式细胞仪发挥着重要作用[5]。因其具有准确、灵活、快速、灵敏、高通量和多参数同时分析等优点,已成为细胞生物学研究的重要手段。20世纪80年代初最先研制出了稳定性能良好的流式细胞仪,近年来,随着流式细胞仪的功能不断地进步,其分析软件的功能更加强大,为服务于临床和基础研究提供了有力的保证[6]。
BD Influx分选型流式细胞仪是目前高端流式细胞仪之一,Influx具有模块化结构,强大的检测能力和高性能的分选功能。该型号仪器可多荧光、多参数定量分析及无菌高速分选,具有消耗鞘液量少、分选速度快及分选后细胞活性高等特点,并采用空气中激发和分选,使分析分选的全过程始终处于同一空气介质中,确保液流的稳定性和检测的准确性。与其他型号细胞分选仪相比,Influx在设计上提供了更多的调试空间。使用流式细胞仪进行分选前,仪器最佳条件的设定和参数的调试直接关系到分选的成败,且高质量地完成仪器参数的调试直接关系到分选的效率、纯度及回收率等结果,尤其是微孔板单细胞分选[7]。
1 材料与方法
1.1 设备与材料
BD Influx分选型流式细胞仪;Heraeus labofuge 400R离心机;Accudrop beads、Rainbow beads均为美国Becton Dickinson公司出品;PerCP-Cy5.5标记的抗人CD4抗体(美国Becton Dickinson公司);磷酸盐缓冲液(PBS),1×PBS鞘液,牛血清白蛋白(BSA)的磷酸盐缓冲液(pH值为7.4,含1%牛血清白蛋白)。
1.2 方法
(1)样品制备。将Rainbow beads和Accudrop beads用无菌鞘液稀释备用,取从EDTA抗凝血中分离的外周血单个核细胞,使用PerCP-Cy5.5标记的抗人CD4抗体染色(每106外周血单个核细胞加抗体2 μl),避光30 min后用2 ml磷酸缓冲液洗涤细胞,400 g/min离心5 min(1800 r/min),重悬于0.4 ml的PBS/BSA溶液,2 h内上机分析和分选。
(2)系统启动。倒空废液桶、盖好鞘液桶和废液桶盖后依次打开主电源、真空泵、空气压缩机以及流式细胞仪的电子系统、计算机、激光开关、加压阀和FACS软件,关闭放气阀。
(3)液流启动。①鞘液充满液路:取下喷嘴在其孔下放置冲洗槽,按Rinse键打开液流,30 s后关闭液流,反复开关数次使鞘液充满液路;②清洗及安装喷嘴:将喷嘴放于装有去离子水的超声波清洗机中超声1~2 min,使用装有0.22 μm无菌滤器的注射器沿液流相反方向冲洗喷嘴,然后沿液流相同方向冲洗喷嘴,若注射器打出的液流呈直线状,则喷嘴清洗完成,将喷嘴重新安装到机器上并拧紧,确保O型圈密封好;③反冲及排气泡:将排气泡贮水匙放置在冲洗槽上,匙中装满去离子水使喷嘴的底部尖端没入液面以下。按Purge键使气泡随液流而流走,当贮水匙中充满水时反复按Purge数次。也可在不放置贮水匙的条件下,先按Purge键产生一段气泡,再放置贮水匙,用水将气泡排走。排气泡结束后按Run键打开液流,检查液流是否垂直,如不垂直,需重新清洗喷嘴和排气泡。打开液流后移开进样针位置处流式管,按Backflush键反冲30 s。
(4)校准针孔和液流。打开液流,调节旋钮使鞘液压力为0.118 MPa,样品压力为0.125 MPa。调节喷嘴上方有3个互相垂直的银色旋钮,经针孔显示屏观察,调节X轴旋钮使液流聚焦清楚,调节Y轴旋钮使液流移至针孔中央,Z轴不调。调节喷嘴上方的两个互相垂直的黑色旋钮,经Stream显示屏观察,调节前后旋钮使喷嘴前后摆动,调节左右旋钮使喷嘴左右摆动。调节后使液柱打入废液收集管的正中央,且Stream显示屏中圆球状亮点达到小且亮为宜。反复调节上述两套旋钮使条件为最优。
(5)优化488 nm激光荧光通道。打开FACS软件,将所有参数选择为线性,画一个散点图,横坐标为530/40[488],纵坐标为580/30[488],阈值探测器选择530/40[488],打开机器左侧的488 nm激光shutter,同时关闭其他激光的shutter。关闭喷嘴小室门用手指点击小室门右上方的探测器后可观察到488 nm激光已打开。样品上机Rainbow beads,按Sample键开始进样品,开始数秒如上样速度慢可按Boost键加速进样,最终流速保持在100~200个/s细胞样品。观察针孔显示屏,调节488 nm激光的Z轴和喷嘴上方的Y轴银色旋钮,使光斑进入第1个针孔中央,调节488 nm激光的Y轴和喷嘴上方Y轴银色旋钮,使针孔中的光斑最亮,同时散点图中信号达到最强,变异系数(coefficient of variation,CV)值最小。
恶性淋巴瘤是血液科的常见疾病,在淋巴瘤的治疗过程中,发热是比较常见的现象,发热的原因有很多,如癌性发热、感染性发热、免疫因素引起的发热等,每一种发热的处理方法不一样,能否及时有效地处理淋巴瘤患者的发热问题,直接关系到了淋巴瘤患者的生存预后。中西医学在处理淋巴瘤发热问题上各有其独特的方法,笔者长期从事于恶性血液病的中西医结合治疗,对淋巴瘤发热问题的中西医学认识谈谈自己的一点体会。
(6)优化前向角散射光信号。画1个散点图,横坐标为FSC,纵坐标为SSC,将针孔显示器转换为Video2,上样过程参照步骤(5),调节前向角散射光检测器的Z轴和Y轴,使光斑进入FSC针孔中央,调节Y轴和X轴使针孔中的亮斑至最亮、散点图中信号最强以及CV值最小。
(7)液滴频率优化。在100 μm的喷嘴和17.1 psi(0.118 MPa)的鞘液压力条件下,在Sorting Settings窗口中输入初始液滴的频率值为36 kHz,观察Drop显示屏,调节监视器位置找到断点后调节液滴频率使断点最高,若断点超出显示范围可调节监视器的位置。
(8)振幅优化。合上电偏转板,在Sort Layout窗口中Sort Mode选择1.0 Drop Pure,在Sorting Settings窗口中点击Test Streams,则可在Stream显示屏中见到测试液流分叉。若液流分叉不可见或呈线状闪动,可通过调节振幅使液流分叉呈稳定的亮点。若液流打在偏转板上或不能通过废液收集器,可调节Maximum Drop Charge值使液流分叉适宜。若在Test Streams条件下测试液流分叉正常,可再单击Flash Charge,同以上过程优化振幅。
(9)液滴延迟优化。画一个散点图,横坐标为FSC,纵坐标为SSC,右上方画一个尽可能小的门,标为P1,在Gate Hierarchy中生成NOT P1门。同时阈值探测器选择FSC,再将含有Accudrop beads的样品上样,调节流速稳定在每秒1000~3000个细胞,且P1门内尽可能无细胞。在Sort Layout窗口中Sort Device选择Accudrop Setup,Sort Mode选择1.0Drop Pure,分选门选择NOT P1。将滤光片调至遮挡位置,并按下针孔显示屏下方的红色加压按钮,点击Sort Layout窗口中的Sort Ready和Start,观察Stream显示屏,调节Sort Settings窗口中的Calculate值,使显示屏中的亮点从右调至左,液滴延迟优化完成。
(10)细胞分选。确定收集管位置后开始细胞分选。
2 结果
2.1 针孔显示屏中液流聚焦清楚
如图1所示,液流位置在针孔中央且液流聚焦清楚即为最佳位置(图1-A),液流聚焦不清为调试不佳,无法正常分选(图1-B)。
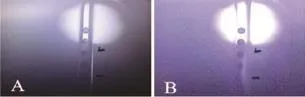
图1 针孔显示屏显示液流聚焦图
如图2所示,液柱打入废液收集管正中央,如图2-A中箭头所示,圆球状亮点小且亮即为最佳位置;图2-B为调适不佳,液柱偏左,无法正常分选。
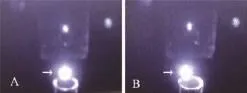
图2 Stream显示屏显示液柱打入废液收集管
2.3 优化488 nm激光荧光通道
如图3所示,图3-A中光斑进入第1个针孔中央且光斑最亮即为最佳位置,图3-B中光斑未进入针孔中央为调适不佳,无法正常分选。可调节488 nm激光的Z轴和喷嘴上方的银色旋钮Y轴使光斑进入针孔中央。

图3 针孔显示屏显示优化荧光通道后信号图
2.4 优化前向角散射光
如图4所示,图4-A中光斑进入FSC针孔中央且最亮即为最佳位置,图4-B中光斑未进入针孔中央或未达到最亮,为调适不佳,需继续调试。

图4 针孔显示屏显示优化前向角散射光后信号图
2.5 液滴频率优化结果
如图5所示,图5-A中断点最高的液滴频率为最佳频率,图5-B中断点非最高、最佳频率。

图5 优化液滴频率后断点位置图
2.6 振幅优化
如图6所示,图6-A中液流分叉呈稳定的亮点即为最佳振幅。若液流分叉不可见或呈线状闪动(图6-B),需继续调节振幅。
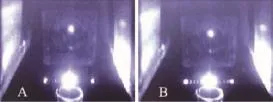
图6 振幅优化后液滴形状图
2.7 液滴延迟调试结果
如图7所示,屏中的亮点从右方调到左方即完成液滴延迟优化。右侧的亮点表示分选至废液中drop delay不正确;左侧的亮点表示分选至收集管中drop delay为正确。若显示屏中仍存在两个亮点,则液滴延迟未达到最佳状态需继续调节;若发现屏中的亮点连成一条线,需重新优化振幅使液流分叉呈稳定的亮点再调液滴延迟。如果屏中始终只有右方一个亮点,可能因为偏转电压过大使信号超出范围,可减小Maximum Drop Charge值,再调节液滴延迟。

图7 Stream显示屏显示液滴延迟优化后信号图
2.8 CD4+T淋巴细胞亚群分选结果
如图8所示,使用以上调试方法,经流式细胞仪分选后得到CD4+T淋巴细胞亚群分选结果,分选纯度为99%、效率达到95%则说明仪器的分选参数调试正确,仪器分选处于最佳使用状态。
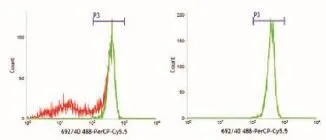
图8 CD4+T-PerCP-Cy5.5淋巴细胞亚群分选前后结果
3 讨论
近年来,流式细胞术在分选如肝癌、卵巢癌、宫颈癌、胃癌和血液肿瘤等侧群细胞中有着广泛的应用[8-12]。同时在脂肪干细胞、血液肿瘤干细胞、头颈部肿瘤干细胞及蜡样芽胞杆菌等的分选中也发挥着重要的作用[13-15]。细胞的分选是通过分离含有单细胞的液滴来实现的。在流动室的喷口上安装有超高频电晶体,充电后可以振动将喷出的液流断裂为均匀的液滴,这时待测定细胞就分散在这些液滴中间。将液滴充以不同的正负电荷后,当液滴流经偏转板的高压静电场时向左或向右偏转落入各自的收集容器之中,未充电的液滴落入中间的废液容器中从而完成了细胞的分离[16]。对仪器参数进行精确的调试和设定以达到设备最佳的分选状态是决定分选水平的重要环节。
实验中发现,开启液流后观察Drop显示屏,如果液流形状不正常则说明可能管路中有气泡或喷嘴不洁净,可将液流断开后重新排气泡或超声喷嘴,使液流形状正常后再调试其他参数。当短时间关闭液流后重新开启时,需重新微调仪器各参数方可继续使用。在长时间未关闭液流情况下,使用前需重新优化振幅和液滴延迟后再进行分选。使用仪器时如断点发生移动需重新优化振幅和液滴延迟后再继续使用。断点越向上移动则液滴延迟时间越向下调。如果分选过程中样本吸空,未及时关闭上样键则会造成吸入气泡和液流不稳定,必要时需重新排气泡、调试参数后再继续分选。
流式细胞分选的成功不仅仅取决于流式细胞仪本身,还与荧光素的选择、样本的制备及分选模式的选择等因素密切相关。选择荧光素要尽量降低光谱叠加的可能,使用强荧光素标记的抗体去结合低表达的抗原,并尽量避免偶联染料的降解,考虑其是否会影响结果;流式分析样本固定后需严格依照说明书在短时间内完成检测[17];需要分选获得活细胞的样本在制备时不能加入固定液;使用Influx进行单细胞分选时应选择1.0 drop single模式。先富集再分选可获得更高的纯度和回收率[18]。
综上所述,本研究的参数调试和条件设定方法可快速、准确地调试BD Influx分选型流式细胞仪的各项参数,用于标准分选、微孔板分选等模式对免疫细胞、干细胞和重组蛋白阳性表达克隆进行筛选和富集。未来,BD Influx分选型流式细胞仪在临床和科研领域的应用范围会更加广阔、深入,为人类对疾病的认识和治疗提供有益的帮助和支持。
[1]张琰,温浩,张朝霞.流式细胞仪在医学中的应用[J].新疆医科大学学报,2005,28(1):92-93.
[2]刘涛,张巍,王凤阳,等.流式细胞仪在免疫学研究中的应用[J].动物医学进展,2008,29(3):102-105.
[3]张学艳,王军.流式细胞仪在血液学检验中的应用[J].中国医学装备,2008,5(5):8-11.
[4]李娟,王静.流式细胞仪在医学检验中的应用[J].中国实用医药,2010,5(36):101-102.
[5]陈阳,徐榕,司书毅,等.流式细胞仪高通量药物筛选技术的建立和应用[J].齐鲁药事,2011,30(1):1-2.
[6]李超,韩金路,王玉刚,等.流式细胞仪的工作原理及应用[J].中国实用医药,2009,4(20):235-236.
[7]刘锡娟,丁慧荣,张宏.FACSAria流式细胞仪96孔微孔板单个细胞分选方法的优化和应用[J].生物学通报,2010,45(3):51-55.
[8]黄涛,周奇,宫东伟,等.肝癌SMMC-7721细胞中侧群细胞分选及其生物学特性的研究[J].中国病理生理杂志,2011,27(3):523-527.
[9]孟泳圳,李力,钟艳平,等.卵巢癌侧群细胞流式分选方法的建立及探讨[J].广西医科大学学报,2013,30(2):175-180.
[10]宋菁华,王克芳,李斌,等.人宫颈癌侧群细胞的分选及其生物学特性的研究[J].首都医科大学学报,2012,33(1):5-10.
[11]俞薇,吴婷,司今,等.人胃癌细胞株MGC-803侧群细胞的分选与生物学特征[J].山东医药,2012,52(1):4-6.
[12]范瑞华,李惠民,李晓进,等.血液肿瘤细胞株中侧群细胞的检测和分选[J].中国组织工程研究与临床康复,2010,14(10):1821-1824.
[13]李俊宪,孙恒赟,袁捷,等.流式细胞仪分选纯化人脂肪干细胞体外成骨活性的实验研究[J].组织工程与重建外科,2010,6(6):311-314.
[14]徐晓蓉,贾俊,张文峰.头颈部肿瘤干细胞的表面标志物及其分选[J].国际口腔医学杂志,2012,39(5):604-607.
[15]Want A,Hancocks H,Thomas CR,et al.Multiparameter flow cytometry and cell sorting reveal extensive physiological heterogeneity in Bacillus cereus batch cultures[J].Biotechnology letters,2011,33(7):1395-1405.
[16]曹云新,胡金涛,杨安钢.FACS-Aria流式细胞分选调试参数和最佳条件的设定[J].第四军医大学学报,2007,28(19):1813-1815.
[17]陈源清,邱晓丹.流式细胞仪检测样品保存时间的探讨[J].检验医学与临床,2011,8(21):2652-2653,2663.
[18]张晖,周春保.FACS Aria流式细胞分选仪质量控制体系的优化[J].中国医疗器械杂志,2009,33(3):225-227.
Research on the setting of optimal conditions and adjustment of sorting parameters for BD Influx flow cytometer/
LIANG Hao-yue, YANG Wan-zhu, CHENG Xue-lian, et al// China Medical Equipment,2014,11(2):5-9.
Objective: To explore the optimal conditions and adjustment of sorting parameters for BD Influx flow cytometer. Methods: Using Rainbow Beads and Accudrop Beads as experimental materials, optimization of pinhole, stream, fluorescence channel, forward scatter signal, drop frequency, piezo amplitude and drop delay was conducted. Results: The optimal condition was as follows, using the 100 μm nozzle, the stream was centered on the pinholes and sharply focused, the stream was aimed at the drain, the brightest signal was in the center of the pinhole after optimizing the fluorescence channel, the brightest signal was in the center of the FSC pinhole after optimizing the forward scatter signal, the breakoff point was highest after adjusting the drop frequency, and the droplet shape remained constant. When the piezo amplitude was around 5.20±1.00 and the drop delay value was around 35.20±2.00, the adjustment efficiency achieved its optimal condition, with its purity at 99% and sorting efficiency at 95%. Conclusion: Rapid setting of optimal conditions and adjustment of sorting parameters for BD Influx flow cytometer guarantees the success of gathering cells of high purity and activity after cell sorting.
Flow cytometry; Cell sorting; Sorting parameters; Optimal conditions
10.3969/J.ISSN.1672-8270.2014.02.002
1672-8270(2014)02-0005-05
R446
A
2013-11-18
国家自然科学基金(81001377)“倍半萜内酯类活性成分的分离、衍生化及抗白血病干细胞的活性研究”
①中国医学科学院北京协和医学院血液病医院 血液学研究所 实验血液学国家重点实验室 天津 300020
*通讯作者:jyuwang@sina.com
梁昊岳,男,(1987- ),本科学历,技师。中国医学科学院北京协和医学院血液病医院 血液学研究所 实验血液学国家重点实验室,从事流式细胞测试工作。
