姜黄提取物对Na2S2O4诱导SK-N-SH细胞凋亡的保护作用
2014-01-31郝淑芹王亚辉王四平
郝淑芹,王亚辉,王四平
(1.解放军白求恩国际和平医院,河北 石家庄050082;2.河北医科大学第一医院,河北 石家庄050031;3.河北中医学院,河北石家庄050091)
姜黄素具有抗癌、抗肿瘤、抗氧化[1-3]、抗炎、降血脂[4-5]、抗微生物、抗胆结石、提高人体免疫力等作用,特别是对缺血再灌注损伤时脑线粒体的功能具有保护作用[6]。现代研究发现姜黄素对氧化应激损伤神经细胞[7]和血管内皮细胞具有保护作用[8]。抗氧化作用在姜黄提取物的药理作用中同样占有重要地位。姜黄提取物是从姜科姜黄属的多年生草本植物中药姜黄中提取有效的组分,其中姜黄素含量为66%,去甲氧基姜黄素和双脱甲氧基姜黄素含量为8%。本研究采用细胞生物学方法,观察姜黄提取物结晶体对人神经母细胞瘤(SK-N-SH)细胞凋亡的保护作用,探讨姜黄提取物治疗血管性痴呆(VD)的机制。
1 实验资料
1.1 主要试剂及仪器 SK-N-SH细胞株购自中国科学院上海细胞库;姜黄提取物由河北省药检所研制提供。二甲基亚砜(DMSO)Sigma公司,胎牛血清,马血清Hyclone公司;总超氧化物歧化酶(T-SOD)活力测定,微量丙二醛(MDA)试剂盒、乳酸脱氢酶(LDH)试剂盒均购自南京建成生物工程研究所。MK3型酶联免疫检测仪芬兰雷勃。
1.2 方法
1.2.1 SK-N-SH细胞培养方法 采用1640培养液,用NaHCO3调至pH=7.2左右。在37℃,5%CO2,饱和湿度培养箱中培养,待SK-N-SH细胞长满单层开始实验,用于实验的细胞都是处于对数生长期。
1.2.2 实验分组 取相同代的细胞,随机分为正常对照组、模型组(加连二亚硫酸钠Na2S2O4损伤,但不加姜黄提取物,其他条件同实验组)、姜黄提取物低浓度(20 μmol/L)组、姜黄提取物中浓度(40 μmol/L)组、姜黄提取物高浓度(80 μmol/L)组。取细胞铺满单层的24孔培养板,吸弃原培养液,用D-Hank's液轻轻荡洗1次,然后每孔加入1640培养液 1 mL,再分别加入 20 μmol/L 、40 μmol/L、80 μmol/L 的姜黄提取物,药物预保护1 h后加入Na2S2O4,使其终浓度为5 mmol/L,继续培养8 h、16 h、24 h。同时设模型组及正常对照组,收集细胞及其培养液,进行相应实验检测。
1.2.3 MTT法测定细胞存活力 在上述损伤发生后的不同时间结束时(8 h、16 h、24 h),培养结束前3 h加入MTT(终浓度为0.5 g/L),继续培养3 h,每组8个复孔,吸去培养液,每孔加入DMSO 200 μL,室温振荡10 min,待孔内颗粒完全溶解后,用酶标仪(λ=492 nm)测定其光密度值(OD)。正常对照组细胞存活率为100%,其余各组细胞存活率=(实验组OD/对照组OD)×100%,实验重复3次。
1.2.4 细胞培养液中SOD、MDA检测 分别提取细胞培养液100 μL,按SOD、MDA试剂盒说明书加入相应试剂,于波长550 nm处,1 cm光经比色杯,蒸馏水调零比色检测细胞培养液中SOD和MDA的吸光值并计算其活性。
1.2.5 细胞Caspase-3活性检测 采用Western blot检测法检测细胞Caspase-3蛋白的表达情况。SK-N-SH细胞被药物处理16 h后,裂解,运用超声波粉碎细胞,4℃,12 000 r/min离心5 min,采用BCA比色法进行蛋白定量。进行SDS-聚丙烯酰胺凝胶的电泳分离实验,分离的蛋白通过水浴式电印迹转移到硝酸纤维素滤膜上,后加入被封闭液稀释的兔抗鼠多克隆抗体(1∶250稀释),4℃过夜,洗一抗Tween-PBS,3遍,每次振荡10 min。二抗结合。最后在暗室内将缓冲液加入5 mg二氨基联苯胺(DAB),溶解后过滤,再加入0.1 mL 1%H2O2加于膜上,充分显色后,立即用蒸馏水洗膜,然后将膜转入PBS中观察、照相。用凝胶成像分析系统进行灰度扫描,结果用灰度比值表示。
1.2.6 SK-N-SH细胞凋亡率检测 缺氧损伤培养16 h后,按德国 Boechringer Mannheim试剂盒说明书加入相应试剂,同时做阳性和阴性对照,阳性对照为已知表达阳性的组织切片,阴性对照以PBS代替TUNEL反应液,在显微镜下,每组随机观察10个不同高倍镜视野TUNEL阳性细胞数及总细胞数,并计算凋亡指数(AI)=(阳性细胞数/细胞总数)×100%。
1.3 统计学处理 使用SPSS 19.0统计软件处理分析实验结果。数据以均数±标准差(±s)表示,各组数据间用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞存活力比较 姜黄提取物低、中、高浓度组OD值较模型组明显增高(P均<0.01),并且随着作用浓度的增高和作用时间的延长细胞活性增高,提示姜黄提取物对SKN-SH细胞有一定的剂量效应及时间效应关系,抑制了缺氧的损伤。见图1。
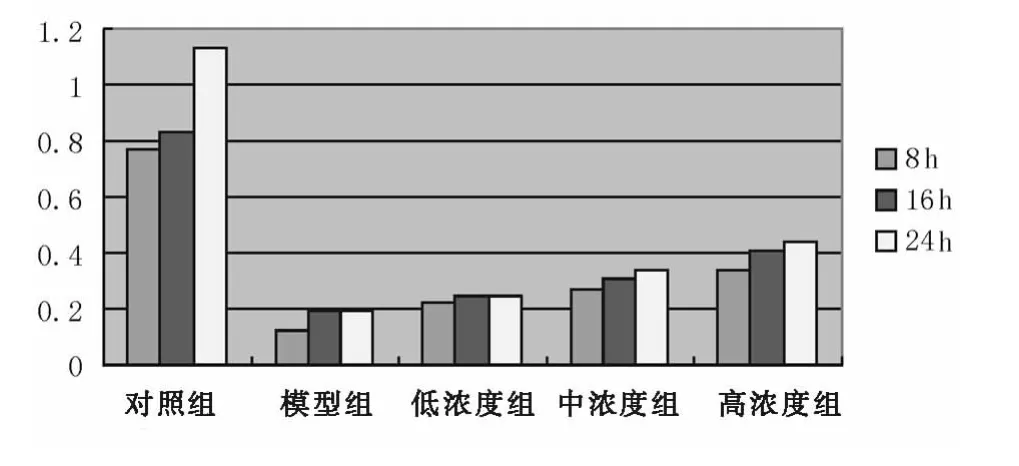
图1 不同浓度姜黄提取物对SK-N-SH细胞缺氧模型活力的影响
2.2 各组细胞培养液中SOD、MDA水平比较 与正常对照组相比,模型组细胞培养液中的MDA水平明显升高(P<0.01),而SOD水平明显下降(P<0.01);与模型组比较,姜黄提取物低、中、高浓度组细胞培养液内的MDA水平均明显降低(P均<0.01),而SOD水平均明显升高(P均<0.01)。见表1。
表1 各组细胞培养液中SOD、MDA水平比较(±s)
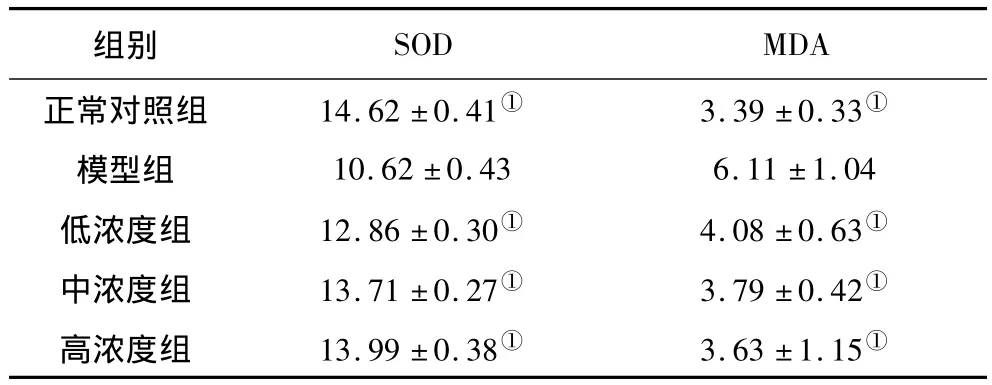
表1 各组细胞培养液中SOD、MDA水平比较(±s)
注:①与模型组比较,P <0.01。
正常对照组 14.62±0.41① 3.39±0.33①模型组 10.62 ±0.43 6.11 ±1.04低浓度组 12.86±0.30① 4.08±0.63①中浓度组 13.71±0.27① 3.79±0.42①高浓度组 13.99±0.38① 3.63±1.15①
2.3 各组细胞Caspase-3活性比较 模型组细胞Caspase-3活性与正常对照组相比升高;与模型组相比,姜黄提取物低、中、高浓度组细胞Caspase-3活性下降。见图2。
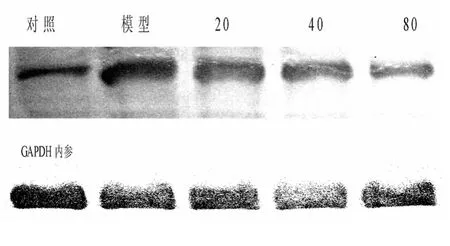
图2 姜黄提取物对SK-N-SH缺氧损伤模型细胞Caspase-3活性表达的影响
2.4 各组细胞凋亡率比较 正常对照组SK-N-SH细胞AI明显低于模型组(P<0.01),姜黄提取物低、中、高浓度组与模型组相比明显下降(P均<0.01)。见图3~5。
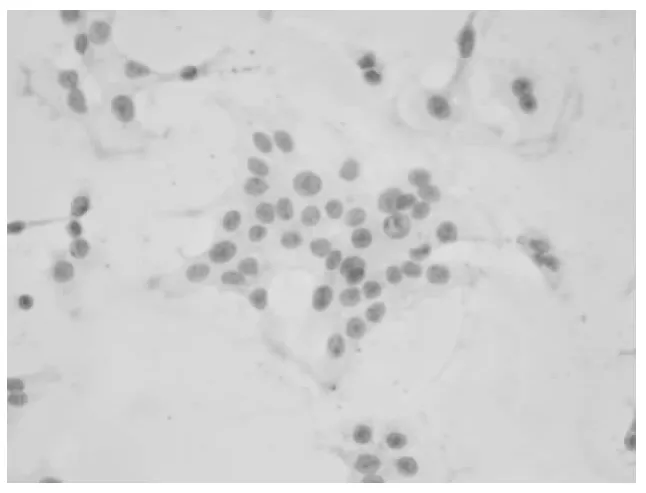
图3 正常对照组SK-N-SH细胞形态
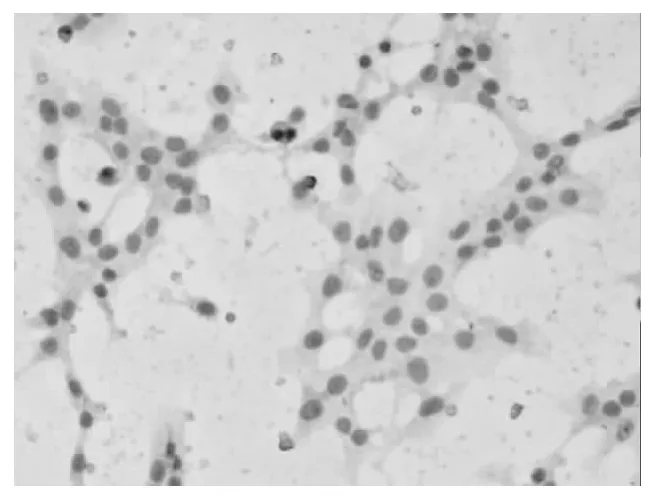
图4 模型组SK-N-SH细胞形态
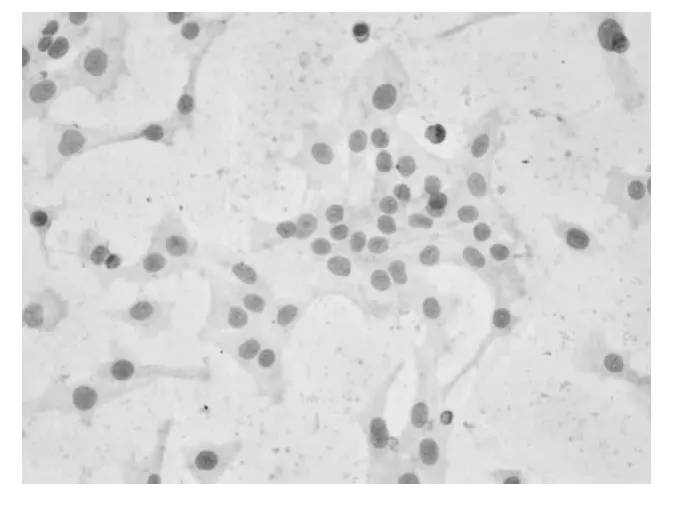
图5 加入姜黄提取药物组SK-N-SH细胞形态
3 讨 论
脑血管病指的是一组起病急骤、因脑血管病变所致的脑功能障碍,近年来随着脑血管病高发多发,导致血管性痴呆(VD)发生率较高。在我国65岁以上人群中痴呆患病率约为5%,其中阿尔茨海默病(AD)约占全部痴呆的50%,VD约占20%[9]。VD是因脑血管病变所致的认知功能及智能障碍的临床综合征,痴呆大多发生于脑卒中后3个月以内,其临床特点为痴呆可突然发生或者阶梯进展,波动性认知功能障碍,个性、人格和情绪改变等,到晚期则表现为全面性痴呆:记忆力、计算力、自知力、定向力等均发生障碍,有的人格明显改变[10]。
现代医学对VD的发病机制至今尚未完全阐明,由于种种原因引起的缺氧损伤进而引起氧化应激在其发病机制上越来越受到重视。在神经系统退行性病变的病理机制中,氧化应激损伤处于重要的地位[11]。氧化应激是指机体内的氧化与抗氧化作用之间失于平衡,并且多倾向于氧化,从而导致中性粒细胞炎性浸润,蛋白酶的分泌增加,因而产生大量氧化中间产物。氧化应激是由自由基在体内产生的一种负面作用的表现,并被认为是引起疾病和衰老发生的一个重要因素。
细胞凋亡又被称为程序性细胞死亡,是由基因控制的细胞自主的有序的死亡,其与细胞坏死有着本质的区别,它涉及一系列基因的被激活、表达以及调控等作用。近年来随着对细胞凋亡研究不断深入,一类半胱氨酸蛋白酶家族——Caspase家族,已被阐明在细胞的凋亡过程中发挥着极其重要的作用。Caspase在正常细胞状态下,以一种无活性酶原的形式存在于细胞当中,一旦细胞的凋亡被激活,将引起级联反应,便使细胞走向不可逆地凋亡。研究发现在Caspase家族中,有14个家庭成员,其中有8个成员已经被证实参与了细胞的凋亡过程,其中Caspase-3作为神经细胞凋亡的关键标志分子[12-13],是引起细胞凋亡的具体执行的一种酶,是细胞凋亡的主要效应因子。
在生物有机体内,自由基作用于脂质发生过氧化反应,氧化终产物为MDA,MDA会引起蛋白质、核酸等生命大分子的交联聚合[14],且具有细胞毒性。同时其含量的变化间接反映了组织中脂质过氧化的程度,亦反映了细胞受损伤的程度[15];SOD是一种活性物质,能消除生物体在新陈代谢过程中所产生的有害物质,是生物体内重要的抗氧化酶,其广泛分布于各种生物体内。在生物体内,SOD水平高低是机体衰老与死亡的直观指标。
本实验结果显示,姜黄提取物低、中、高浓度组均可使SKN-SH细胞培养液内的MDA水平明显降低,SOD水平明显升高,姜黄提取物能够通过提高细胞的SOD水平,降低MDA水平来抑制SK-N-SH细胞凋亡的损伤,从而起到保护作用。另外姜黄提取物低、中、高浓度组的OD值较模型组明显增高。Caspase-3活性下降,提示姜黄提取物可通过降低Caspase-3的活性从而抑制Na2S2O4所致SK-N-SH细胞凋亡,从而起到抗氧化作用。
本研究提示:姜黄提取物具有提高细胞活性、抗氧化和抑制细胞凋亡的作用。抗氧化可能与其作用后使SOD水平的升高、MDA水平明显降低相关;抑制细胞凋亡作用可能是通过降低Caspase-3的活性实现的。显示姜黄提取物在防治VD疾病中具有重要应用价值,可以扩大姜黄提取物的临床应用范围,为姜黄提取物进一步临床开发利用提供理论与实验依据。
[1]臧卫周,杨红旗,徐军,等.姜黄素对缺氧复氧损伤PC12细胞的影响[J].郑州大学学报:医学版,2009,3(44):594-596
[2]庞宝兴,金晓明,张晓燕.姜黄素对人口腔鳞癌细胞增殖及凋亡的影响[J].齐鲁医学杂志,2010,1(25):24-26
[3]Aoki H,Takada Y,Kondo S,et al.Evidence that curcumin suppresses the growth of malignant gliomas invitro and in vivo through induction of autophagy:role of Akt and extracellular signal-regulated kinase signaling pathways[J].Mol Pharmacol,2007,72(1):29 -39
[4]Sandur SK,Ichikawa H,Pandey MK,et al.Role of pro-oxidants and antioxidants in the anti-infl ammatory and apoptotic effects of curcumin(diferuloylmethane)[J].Free Radic Biol Med,2007,43(4):568-580
[5]Wang JB,Qi LL,Zheng SD,et al.Curcumin induces apoptosis through the mitochondria-mediated apoptotic pathway in HT-29 cells[J].J Zhejiang Univ Sci B,2009,10(2):93 -102
[6]石晶,陶沂,胡晋红,等.缺血再灌注损伤时脑线粒体功能的改变及姜黄素的保护作用[J].中国药理学通报,2000,16(5):537-539
[7]Motterlini R,Foresti R,Bassi R,et al.Curcum in,an antioxidant and anti-inflammatory agen,tinduces heme oxygenase-1 and protects endothelial cells againstoxdative stress[J].Free Radical Biol Med,2000,28(8):1303 -1312
[8]Chen J,Tang XQ,Zhi JL,et al.Curcum in protects PC12 cells against1-methyl-4-phenylpyridiniumion-induced apoptosis by bcl-2 - mitochondria - ROS - iNOS pathway[J].Apoptosis,2006,11(6):943-953
[9]吴江,贾建平,崔丽英,等.神经病学[M].北京:人民卫生出版社,2005:188-189
[10]王玉芬,王庆德.尼莫地平与多奈派齐治疗血管性痴呆的随机对照研究[J].山东医药,2009,49(29):61-62
[11]Ischiropoulos H,Beckman JS.Oxidative stress and nitration in neurodegeneration:cause,effect,or association[J].J Clin Invest,2003,111(2):163 -169
[12]Zhu Y,Zhao L,Liu L,et al.Beclin 1 cleavage by caspase-3 inactivates autophagy and promotes apoptosis[J].Protein Cell,2010,1(5):468-477
[13]Choi BH,Kim W,Wang QC,et al.kinetin riboside:preferen tially induces apoptosis by modulating Bcl-2 family proteins and caspase-3 in cancer cells[J].Cancer Lett,2008,261(1):37 - 45
[14]洪行球,黄燕芬,符敏敏,等.二脱甲氧基姜黄素的降血脂和抗脂质过氧化作用[J].中国天然药物,2006,4(2):121-124
[15]张玉柯,崔誉蓉,陈朋,等.异甘草素对氢过氧化枯烯所致神经母细胞瘤损伤的影响[J].时珍国医国药,2010,21(9):2159-2161
