黄金梨叶片再生过程扫描电镜观察
2014-01-22陶爱群谢深喜
陶爱群,尹 婷,谢深喜
(1.湖南环境生物职业技术学院,湖南 衡阳 421005;2.湖南农业大学 园艺园林学院,湖南 长沙 410028)
扫描电子显微镜能够直接观察样品的表面结构,从多个角度反映出样品表面的立体形貌[1-2]。在植物组织培养中常用来从形态学上了解不定器官再生的动态过程,从而得到了广泛应用,包括在体细胞胚的发生过程[3-4]、愈伤组织的形态变化[5-6]及整个组培的过程研究[7-8]等。本实验以黄金梨叶片为外植体,利用扫描电镜观察叶片再生过程中表面形态结构的变化及不定器官的发生动态,从形态学水平上研究黄金梨叶片的再生过程,寻找黄金梨叶片的最佳再生途径,以期为黄金梨的遗传转化、选择非嵌合体转化植株和诱导育种奠定理论基础。
1 材料与方法
1.1 材料
采摘3 a生黄金梨植株上的1 a生枝条置于人工气候室内水培,然后取其新萌发的叶片作试材。
1.2 方法
1.2.1 黄金梨再生
黄金梨叶片经酒精和升汞溶液消毒后,取近中脉的叶片部分切成1cm2大小后用解剖刀轻划2~3刀,以叶面朝上的方式接种于含不同浓度NAA和6-BA的MS培养基上(见表1)。50d后统计再生率。取叶片上再生的、长1cm~3cm的不定芽接种于含不同浓度IBA的1/2MS培养基上,50d后统计其生根率。每个处理100个叶片,2次重复。用SAS9.1.3软件处理数据。
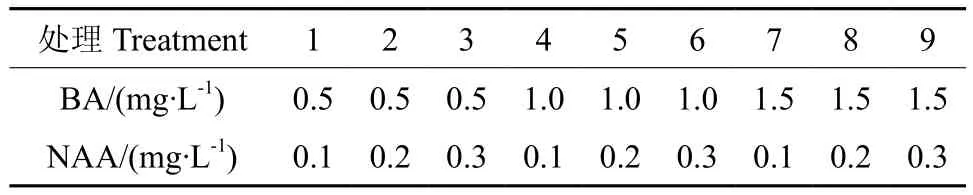
表1 培养基配方Table 1 Medium formulations
1.2.2 扫描电镜观察
将叶片接种在优化培养基上,每隔5d取样观察。再生不定芽长到1~3cm时转接到生根培养基,每隔10d取样。在进行电镜观察前,样品在2.5%戊二醛PBS缓冲液中4℃固定3d后,用PBS 缓冲洗液漂洗15min,重复3次,再用双蒸水冲洗15min,重复 2次。然后锇酸固定1h后,用4℃缓冲液漂洗15min,重复3次备用。备用样品依次用浓度为30%、50%、70%、85%、95%、100%的丙酮脱水15min,再用乙酸异戊酯置换2h后,CO2临界点干燥1h,镀金膜后在扫描电子显微镜下观察和照相[8-9]。
2 结果与分析
2.1 生长调节剂对黄金梨叶片再生的影响
2.1.1 不同配比的生长调节剂对黄金梨叶片不定芽的影响
生长素和细胞分裂素的不同配比影响叶片不定芽的产生率和平均再生芽数。从表2可知,叶片再生频率最高为54%,最低仅3%。6-BA浓度在0.5~1.5mg·L-1、NAA浓度0.1~0.3mg·L-1的不同组合诱导叶片时的再生率和再生芽数无明显规律。当培养基的NAA浓度不变,以6-BA浓度为1.0mg·L-1优于其它两个浓度6-BA的培养基。而当培养基的6-BA浓度不变时,NAA0.1~0.3mg·L-1浓度范围内变化时,浓度为0.2mg·L-1优于其它两个浓度。故选用MS+0.2mg·L-1NAA+1.0mg·L-16-BA对黄金梨叶片进行培养,可以获得相对较高的再生率,可再生出相对多的不定芽。
2.1.2 不同浓度IBA对黄金梨叶片不定根再生的影响
长度1~3cm的不定芽接种于添加不同浓度IBA的1/2 MS生根培养基上进行生根诱导,发现IBA浓度为3.5mg·L-1时,生根率和再生根数目都优于其它供试浓度(见表3)。
2.2 再生过程的扫描电镜观察
2.2.1 不定芽发生过程的扫描电镜观察
黄金梨叶片在接种5d后取样无表观变化,接种10d后,所有未污染的叶片边缘卷曲,叶面面积增大,在叶片损伤处和叶脉处产生了白色愈伤组织。接种15d后,肉眼可见部分愈伤组织开始变为淡黄色或浅绿色,质地紧密,数量明显增多,形成团状。扫描电镜观察此愈伤组织发现,其表面包被有一层膜,且随着培养时间的延长,大量凹凸不平的疣状突起突破膜的包裹;此突起细胞排列致密,内部中空,具有较强的分化能力,是分生组织形成的前体类分生组织(见图1A)。40d时,肉眼可见愈伤组织团变成深绿色,扫描电镜下发现此时的愈伤组织表面密布排列整齐的分生组织(见图1B,C,D),但只有接近叶片损伤处或叶脉附近的愈伤组织上的分生组织表面或边缘才可见不同程度发育的不定芽,这些不定芽非常小,肉眼很难看到,在显微镜下可见已具备不定芽的形态(见图1D)。到50d时,肉眼可见不定芽上叶片开始伸展。随培养时间延长,出现不定芽的叶片数增多,同一叶片上再生不定芽的数量也增多。到80d时,出现不定芽的叶片不再增加,但已产生的不定芽节间伸长,叶片增大;此时扫描电镜发现,叶片上再生出来的部分不定芽茎横切面呈蜂窝状或细胞排列紧密(见图1E,F),前者应为生长停止或接近死亡,后者生长旺盛。
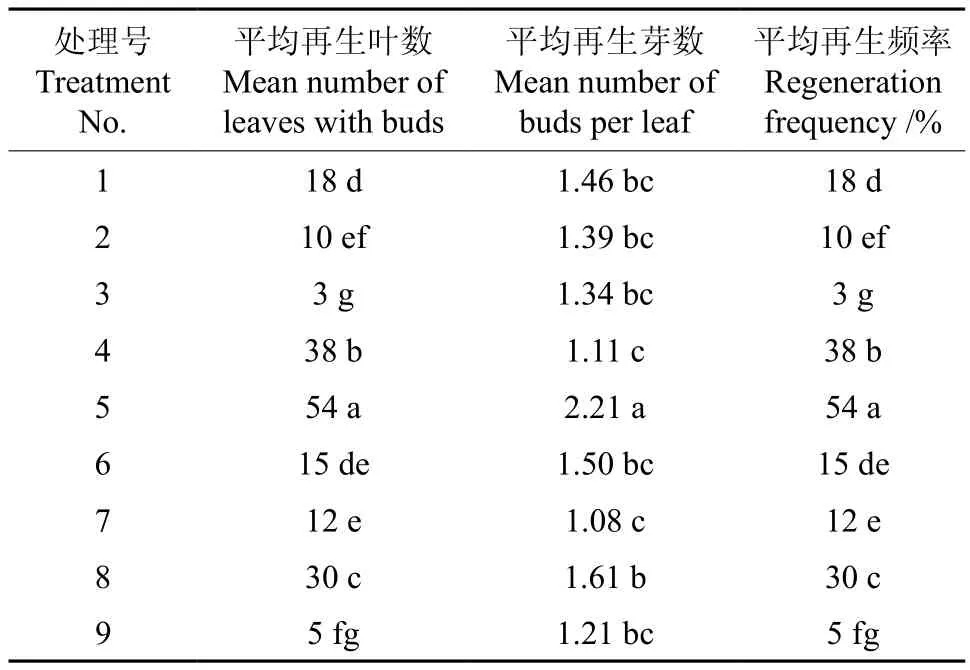
表2 不同的6-BA 和NAA 组合对黄金梨叶片再生不定芽的影响†Table 2 Effect of different combinations of 6-BA and NAA on adventitious bud regeneration from leaves
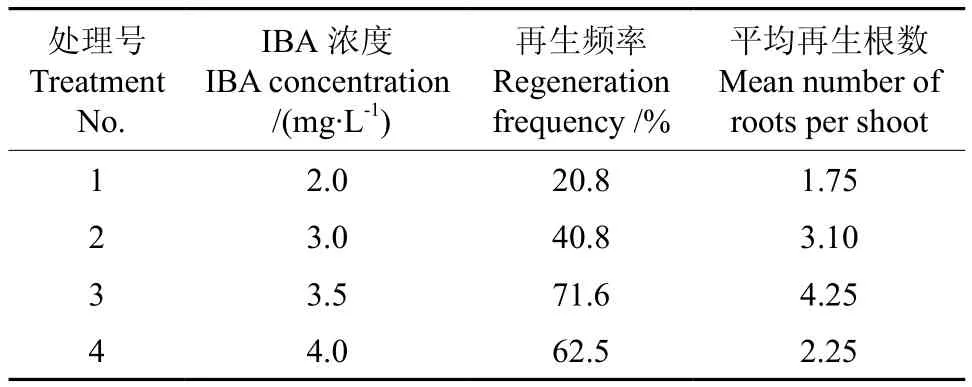
表3 不同IBA浓度对黄金梨不定梢生根的影响Table 3 Effect of different IBA concentrations on root regeneration from adventitious shoots
不定芽主要出现在愈伤组织团的边缘和细胞团的中间位置,尤其以愈伤组织边缘的居多。扫描电子显微镜的观察显示:产生愈伤组织的叶片数量>出现类分生组织的叶片数量>产生分生组织的叶片数量>出现不定芽的叶片数量;单一叶片上出现类似趋势:愈伤组织数量>类分生组织数量>分生组织数量>不定芽数量。

图1 黄金梨叶片不定芽再生过程的电镜扫描Fig.1 Observation of adventitious bud regeneration process from leaves in P.pyrifolia Nakai using scanning electron microscope
2.2.2 不定根发生过程的扫描电镜观察
由叶片再生的长1~3cm的不定芽接种于生根培养基上,10d时可见不定芽基部出现少量愈伤组织,呈小颗粒状或疣状突起,部分疣状的愈伤组织开始与周围分离并形成一个空腔,最后形成基部与愈伤组织相连的柱状结构(见图2A ),此柱状愈伤结构主要出现在不定芽基部所形成的愈伤组织中央(见图2B)。愈伤组织表面形成一层膜状结构,此时培养物转入无激素低糖培养基中继续培养。20d时柱状愈伤结构慢慢伸长,突破膜的束缚,并切断与周围愈伤组织的联系,从愈伤组织内部突出;30d时柱状愈伤组织中央开始形成肉眼可见的小突起,此小突起细胞在电镜下呈长方形,排列紧密,这些柱状细胞团(小突起)可能是根的类分生组织(见图2C)。当培养到40d,小突起继续伸长,出现肉眼可见的不定根,根的数量要远远少于突起数量,一般仅3~4根(见图2D)。电子显微镜下扫描不定根的根颈部横切面发现细胞呈蜂窝状(见图2E)。50d左右不定根长1~2cm,应已完全形成,此时电子显微镜下成形的不定根粗壮,内部形成了细胞排列紧密的圆柱状结构,根中部与根底部横切面均为蜂窝状(见图2F)。
3 结论和讨论
文中试验结果表明,黄金梨叶片培养10d出现了愈伤组织,15d左右出现了类分生组织结构,40d左右出现不定芽,50d时成型的不定芽肉眼可见。在黄金梨叶片上所产生的成型不定芽数量远少于电镜可见的不定芽数量,而电镜可见的不定芽数量也远少于所形成的分生组织数量。长1~3cm的不定芽接种10d时基部产生愈伤组织,其上出现小突起,20d时形成根的类分生组织,30d时出现不定根的分生组织,40d时肉眼可见不定根,50d根长1~2cm,不定根主要产生在愈伤组织中央,数量与形成的类分生组织的数量相差很多。
扫描电镜观察虽发现接种的黄金梨叶片上有较多的类分生组织和分生组织形成,但叶片再生的频率并不高[10]。洪维廉[11]等研究表明致密型愈伤组织处于形态发生的初级阶段,预示着分化能力的开始产生,瘤状愈伤组织细胞代谢活跃,细胞旺盛,具有较高的分化为器官的能力。黄金梨在接种15d后产生具有分化能力的致密愈伤组织,随着时间的推移,致密愈伤组织细胞的活跃度增强、代谢强度加大,可逐步演变成具有分化为器官较高可能性的瘤状愈伤组织,虽然瘤状愈伤组织具备了器官再生的内部条件,但最终产生的不定芽的数目并不多,这与Zhu等[12]在野生梨叶片再生中观察到的结果相似,Zhu等认为是培养过程中培养基之间的差异或继代次数过多出现分生组织脱分化所致。本试验继代次数不多,因继代导致分生组织脱分化的机率较小,再生频率不高极有可能是选用的培养基有利于叶片不定芽的诱导,而对不定芽的生长不利[8];有利于不定芽生长的培养基种类还有待进一步探索。温度、pH 值及光照条件[13]或外源物质如油菜素内酯[14]对叶片再生也有影响,是否对黄金梨叶片再生有影响还有待进一步证实。

图2 黄金梨不定根再生过程的电镜扫描Fig.2 Observation of adventitious root regeneration process in P.pyrifolia Nakai using scanning electron microscope
黄金梨叶片再生不定芽产生的不定根频率较高,但并不表示可能出现较高的移栽成活率。包文泉[15]等研究认为,从不定芽基部愈伤组织诱导出的不定根,因愈伤组织的存在阻滞了茎与根之间输导组织的畅通,导致养分和水分运输的困难,从而导致试管苗移栽困难、成活率降低;本试验中产生的不定根主要出现在愈伤组织中央,不定根与不定芽之间是否有维管束相连还有待进一步研究证实。
[1] 吕金阳,罗建举.扫描电镜下降香黄檀木材构造的研究[J].中南林业科技大学学报,2014,34(4):108-113.
[2] 王亚丽.利用扫描电镜研究“南澳Ⅰ号”出水古木材的降解[J].中南林业科技大学学报,2013,33(6):48-54.
[3] 陈金慧,施季森,甘习华,等.杂交鹅掌楸体细胞胚胎发生的扫描电镜观察[J].南京林业大学学报(自然科学版),2005,29(1):75-78.
[4] 顾地周,高捍东,王艳萍,等.基于均匀设计优化绶草体细胞胚胎发生发育体系及扫描电镜观察[J].华南农业大学学报,2010,31(1):60-64.
[5] Wang Ke-chen,Leng Chao,Huang Wen-gong,et al.Transmission electron microscopy Observation of different callus structures in Heiya No.14 [J].Agricultural Science&technology,2009,10(4):125-127.
[6] 曾艳玲,张 琳,谭运德,等.云实叶片愈伤组织诱导中其酶活性及显微结构变化[J].经济林研究,2012,30(3):32-35.
[7] 杜 娟,王 罡.玉米自交系芽尖诱导再生植株的研究及扫描电镜观察[J].中国农业科学,2003,36(5):599-602.
[8] 曹 霞,柴明良.砂梨叶片再生不定梢[J].果树学报,2005,22(5):557-560.
[9] 尹 婷.砂梨离体再生体系的建立及转chit42基因的研究[D].长沙:湖南农业大学图书馆,2008.
[10] 陶爱群,尹 婷,谢深喜.黄金梨叶片再生体系建立研究[J].湖南农业科学,2012,5):108-111.
[11] 洪维廉,沈明山,郭 洁,等.中国水仙花梗组织培养及脱分化的电镜观察[J].厦门大学学报(自然科学版),1993,32(S):117-122.
[12] Zhu L H,Welander M.Adventitious shoot regeneration of two dwar fi ng pear rootstocks and the development of a transformation protocol [J].Journal of Horticulture Science,2000,75(6):745-752.
[13] 孙 俊.南果梨叶片离体培养的高效再生体系[J].江苏农业科学,2014,42(3):44-46.
[14] 陈宝印,王彩虹,初庆刚,等.外源油菜素内酯对矮生梨试管苗茎、叶生长及解剖特性的影响[J].北方园艺,2014(11):7-11.
[15] 包文泉,邹薇薇,朝洛蒙,等.欧洲花楸成熟种胚组织培养技术[J].经济林研究,2013,31(2):91-95.
