膀胱移行细胞癌患者血清骨形成蛋白-2和血管内皮生长因子水平变化
2014-01-22康元上孙道冬蒙明森颜加强刘元丰封建立
康元上,孙道冬,蒙明森,颜加强,刘元丰,封建立
中国人民解放军第三二四医院泌尿外科(重庆400020)
2010年9月—2013年9月,我们检测了健康人群和膀胱移行细胞癌患者术前血清中骨形成蛋白(bone morphogenetic protein,BMP)中的BMP-2和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达情况,探讨其在膀胱移行细胞癌发生发展中的作用。
1 资料与方法
1.1 一般资料 选取膀胱移行细胞癌患者58例,均经膀胱镜和组织病理学检查确诊。男32例,女26例;年龄31~73岁,平均(62±5)岁。同期选择体检的健康人20例作为对照组。两组间性别、年龄相比无统计学差异(P>0.05)。
1.2 检测方法 抽取清晨空腹静脉血5 mL,在0.5 h内以3000 r/min的速率离心15 min,分离出血清,于-80℃条件下保存。采用ELISA检测方法测定血清BMP-2、VEGF。操作按照说明书进行。
1.3 统计方法 应用SPSS 13.0统计软件进行分析。计量资料用(±s)表示,采用t检验(方差齐用t检验,方差不齐用近似t检验),计数资料采用Fisher确切概率法比较,采用χ2检验。P<0.05为有统计学意义。
2 结果
患者组血清BMP-2和VEGF水平明显高于健康人(P<0.05,表1),并与肿瘤的浸润深度、分化程度、淋巴结转移、远处转移、临床病理分期密切相关(P<0.05),与患者的年龄、性别无相关性(P>0.05,表2)。
表1 两组人群血清BMP-2、VEGF表达水平对比(±s)

表1 两组人群血清BMP-2、VEGF表达水平对比(±s)
组别患者组健康组BMP-2(ng/mL)38.42±9.31 13.10±2.69 t值-18.761 P值<0.05 VEGF(pg/mL)410.67±86.13 119.26±21.27 t值-21.326 P值<0.05
表2 患者组术前血清BMP-2、VEGF的表达水平与临床/病理的关系(±s)
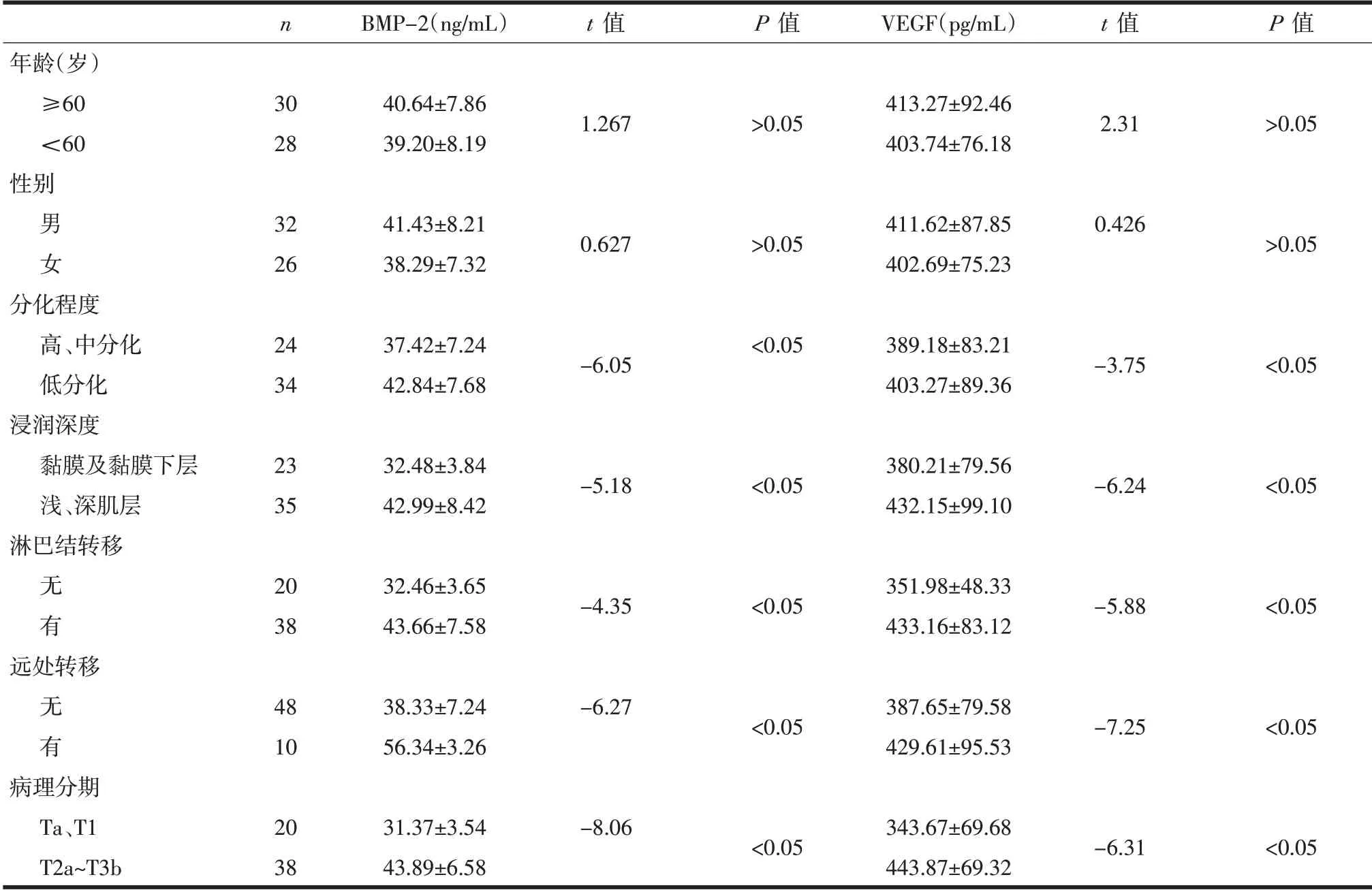
表2 患者组术前血清BMP-2、VEGF的表达水平与临床/病理的关系(±s)
n BMP-2(ng/mL)t值P值VEGF(pg/mL)t值P值年龄(岁)≥60<60性别30 28 40.64±7.86 39.20±8.19 1.267>0.05 413.27±92.46 403.74±76.18 2.31>0.05男女分化程度高、中分化低分化浸润深度黏膜及黏膜下层浅、深肌层淋巴结转移无 有32 26 24 34 23 35 20 38 41.43±8.21 38.29±7.32 37.42±7.24 42.84±7.68 32.48±3.84 42.99±8.42 32.46±3.65 43.66±7.58 0.627-6.05-5.18-4.35>0.05<0.05<0.05<0.05 411.62±87.85 402.69±75.23 389.18±83.21 403.27±89.36 380.21±79.56 432.15±99.10 351.98±48.33 433.16±83.12 0.426-3.75-6.24-5.88>0.05<0.05<0.05<0.05远处转移无 有48 10 38.33±7.24 56.34±3.26-6.27<0.05 387.65±79.58 429.61±95.53-7.25<0.05病理分期Ta、T1 T2a~T3b 20 38 31.37±3.54 43.89±6.58-8.06<0.05 343.67±69.68 443.87±69.32-6.31<0.05
3 讨论
BMP是一种分泌性多功能蛋白,是转化生长因子超家族的成员之一,不仅参与胚胎的形成、发育及组织细胞的分化、增殖,而且与某些肿瘤的发生、发展和转移密切相关[1]。BMP是一类低分子量酸性多肽,至少包括20个成员,除BMP-1外,均属于TGF-β超家族成员,它能在体内诱导未分化的间充质细胞向软骨和骨细胞分化,形成新生的软骨和骨组织,最初是作为一种可在异位诱导骨和软骨形成的蛋白质被发现。BMP-2是迄今为止已经研究过的BMP家族中骨诱导活性最强的因子。在以往的研究中,BMP-2与骨肿瘤的关系关注较多,而与膀胱移行细胞癌的关系关注较少。近40年的研究发现,BMP不仅参与胚胎的形成、发育及组织细胞的分化和增殖,而且与某些肿瘤的发生、发展及转移密切相关。BMP及其受体与相应的TGF-β配体和受体的密切关系使其与肿瘤的发生发展关系越来越受到关注。Yang ZJ等研究发现,在膀胱癌骨转移中,BMP-2和TNF-α具有关联性,即BMP-2和TNF-α的相互作用可以促进膀胱癌的局部浸润和远处转移,特别是骨转移[2]。但BMP在肿瘤中的作用机制还不是很明确[3]。
肿瘤血管生长是肿瘤发生发展、侵袭和转移的重要因素之一,VEGF是诱导血管生成的最强因子之一,直接或间接地参与了新生血管的每一个生长过程,与多种肿瘤的增殖和转移有密切关系[4]。许多介导血管生成的因子都在肿瘤中均有所表达,以介导血管的新生。1971年,Folkman提出了肿瘤生长依赖血管新生的假说。自此,关于肿瘤血管生成的研究拉开序幕。在众多促血管生成因子当中,VEGF及其受体是公认的介导新生血管形成的关键因素,它促使血管内皮细胞有丝分裂并最终形成新生血管,是刺激肿瘤血管生成的最强的细胞因子。大量临床研究显示VEGF的高表达与肿瘤微血管密度、恶性程度、患者预后不良密切相关[5]。肿瘤细胞的侵袭、转移是一个复杂的、多步骤、多环节的级联反应过程,新生血管生成、对基底膜的破坏、细胞外基质的降解都是不可或缺的。VEGF是一种强效的血管形成诱导因子和血管通透性诱导因子,能促进血管内皮细胞、淋巴管内皮增殖和促进新血管的形成,增加血管、淋巴管通透性,并能调控淋巴内皮细胞的生长,从而促进肿瘤细胞的浸润、转移[6]。有学者发现,患者血清VEGF水平与淋巴结转移、远处转移、肿瘤的浸润程度及TNM分期有关,并且发现VEGF的阳性表达与膀胱移行细胞癌的浸润深度、淋巴结转移直接相关[7-8]。
但是,VEGF和BMP-2的表达与膀胱移行细胞癌转移的关系目前尚不明确。我们检测了血清中膀胱移行细胞癌组织中这两种蛋白的表达水平,分析它们与膀胱移行细胞癌临床病理因素的相关性,为探讨VEGF和BMP表达在膀胱移行细胞癌转移发生中的意义提供实验依据。本实验表明,膀胱移行细胞癌患者血清中BMP-2、VEGF的表达与肿瘤的浸润深度、分化程度、淋巴结转移、远处转移、临床分期密切相关,有望成为判断膀胱移行细胞癌病情、预测转移、评估疗效及预后的检测指标,并可能成为抗肿瘤治疗的新靶点。
[1]Li HH,Huo LJ,Gao ZY,et al.Regulation of scleral fibroblast dif⁃ferentiation by bone morphogenetic protein-2[J].Int J Ophthal⁃mol,2014,7(1):152-156.
[2]Yang ZJ,Liu FX,Yang YS,et al.Expression of bone-morphogenet⁃ic protein 2 and tumor necrosis factor a correlates with bone metas⁃tases in bladder urothelial carcinoma[J].Ann Diagn Pathol,2013,17(1):51-53.
[3]Zhang Y,Chen X,Qiao M,et al.Bone morphogenetic protein 2 in⁃hibits the proliferation and growth of human colorectal cancer cells[J].Oncol Rep,2014,doi:10.3892.
[4]Abdel-Rahman O.Targeting vascular endothelial growth factor(VEGF)pathway in gastric cancer:Preclinical and clinical aspects[J].Crit Rev Oncol Hematol,2014,Pii:S1040-8428(14)00100-0.doi:10.1016.
[5]朱芳,李振宇,任精华,等.VEGF与肿瘤血管生成拟态关系的研究[J].临床肿瘤学杂志,2009(1):20-24.
[6]李京佳,林相国,许涛,等.VEGF家族及其在肿瘤生长中作用的研究[J].现代生物医学进展,2012(4):701,777-779.
[7]Nakanishi R,Oka N,Nakatsuji H,et al.Effect of vascular endothe⁃lial growth factor and its receptor inhibitor on proliferation and in⁃vasion in bladder cancer[J].Urol Int,2009,83(1):98-106.
[8]Kerigh BF,Bahrami A,Shamsa A,et al.Assessment of angiogenic factor,vascular endothelial growth factor,serum and urine level changes in superficial bladder tumor immunotherapy by intravesi⁃cal Bacillus Calmette-Guerin[J].Urol Ann,2010,2(3):91-95.
