10味中药对畜禽支原体敏感性及细胞毒性研究
2014-01-21陈美安甄汉深裴渭静沈永强唐旭东
陈美安,甄汉深,裴渭静,赵 欣,沈永强,唐旭东*
(1.成都中医药大学,四川成都611137;2.深圳清华大学研究院创新中药及天然药物研究重点实验室,广东深圳518057;3.广西中医药大学,广西南宁530001;4.广东高山动物药业有限公司,广东信宜525300)
近年来,我国各禽畜支原体病频繁发生,猪支原体导致的猪气喘病的感染率、发病率居高不下,有的地方已达90%;鸡毒支原体感染阳性率为50%~80%,牛支原体病及羊支原体病感染率也明显增加,给养殖业造成了巨大的经济损失。目前预防与治疗动物支原体病主要采用抗生素类药物,虽然一些抗生素药物对动物支原体有较好的治疗作用,但是所产生的耐用现象愈来愈严重,给临床治疗增加了困难。而我国中草药具有药源广、价格低、毒副作用小、不易产生耐药性的特点,近年来已得到人们的关注,其在畜禽支原体病临床治疗上具有很好的开发和应用前景。因此本研究采用微量液体稀释法[1-13]测定抗菌中药对畜禽支原体的敏感性,并结合体外细胞毒性试验,评价其抗支原体活性,为兽医临床用药提供试验依据。
1 材料与方法
1.1 材料
1.1.1 菌 株 牛支原体标准株-PG45株、鸡毒支原体标准株-BG44T 株、羊肺炎支原体标准株-Y-98株及非洲绿猴肾细胞(Vero 293细胞)均由哈尔滨兽医研究所辛九庆研究员提供。
1.1.2 试 药 两面针、广藿香、南板蓝根、黄连、黄芩、黄柏、甘草、白鲜皮、土槿皮、艾叶等10味中药饮片均购自深圳万泽医药连锁有限公司。
1.1.3 主要试剂与仪器 KM2基础培养基、PPLO基础培养基、高糖DMEM 培养基、马血清、胎牛血清、青霉素、链霉素、0.4%酚红、磷酸盐缓冲液(PBS)(均购自Gibco 公司),3-(4,5-二甲基噻唑基)-2,5-二苯基四氮唑溴盐(MTT)(Sigma公司)、二甲基亚砜(DMSO)(均购自Sigma公司),0.25%胰酶(Typsin)(Hyclone 公司)。超净工作台(ZHJH-1112C,郑州南北仪器设备有限公司)、二氧化碳恒温培养箱(DHP-9032,哈尔滨东联电子技术开发有限公司)、酶标仪(Plus 384型,美国)、倒置显微镜(CX41-32C02,OLYMPUS )、离心机(湘仪TDZ5-WS,湖南湘仪离心机仪器有限公司)、96 孔细胞培养板(购自兰州科迈公司)等。
1.2 方法
1.2.1 培养基配制 KM2培养基的配制:取KM2基础培养基,加适量马血清、0.4%酚红及青霉素等所需物,调整PH 值至7.6,0.22μm 微孔滤膜过滤除菌,即得,4 ℃保存备用。
PPLO 培养基的配制:PPLO 基础培养基,加适量胎牛血清、0.4%酚红及青霉素等所需物,调整PH 值至7.8,0.22μm 微孔滤膜过滤除菌,即得,4℃保存备用。
1.2.2 0.5% MTT 的配制 称取0.5g MTT,溶于100mL 磷酸盐缓冲液(PBS,PH 7.4)中,0.22 μm 微孔滤膜过滤除菌,用铝箔纸包住容器,置4 ℃避光保存即可。现用现配,过滤后4 ℃避光保存2周内有效。当MTT 变为灰绿色时不可再使用。
1.2.3 中药70%乙醇提取物制备 取中药饮片,粉碎,过10目筛,得中药粗粉。称取中药粗粉20g,加入10倍量70%乙醇,浸泡0.5h,回流提取3次,每次1.0h,合并3次提取液,定量过滤,浓缩并真空干燥得干浸膏。试验前用相应培养基配成浓度为每1mL 提取液中相当于含生药量2g 的中药原液,0.22μm微孔滤膜过滤,4 ℃冰箱保存,备用。(注:药敏试验前需用50%枸橼酸钠调pH 至7.6~7.8)
1.2.4 药敏试验
1.2.4.1 支原体培养及颜色变化单位(CCU)测定
将冻干标准支原体株加到相应液体培养基中,牛支原体PG45株加到PPLO 培养基中,鸡毒支原体BG44T 株及羊肺炎支原体Y-98 株均分别加到KM2培养基中,置37 ℃,5%CO2,相对湿度为80%~90%培养箱中培养约7d,使其连续传代,取第3代对数生长菌液(牛支原体PG45 株为1×108CCU/mL、鸡毒支原体BG44T 株为1×109CCU/mL、羊肺炎支原体Y-98 株为1×1010CCU/mL),用相应液体培养基稀释至1×104CCU/mL,作为工作菌液。
1.2.4.2 最小抑菌浓度(MIC)
(1)加培养基:取96孔细胞培养板,于每排第1孔加入培养基150μL,第2~11孔加入培养基100μL,第12孔加入培养基200μL。
(2)加药液:于第1孔加入药液50μL,并用微量加样器从第1孔开始2倍倍比稀释药液至第10孔,混匀后于第10孔吸出100μL弃去。
(3)加工作菌液:第1~11孔加入工作菌液100μL,使得所有孔的液体总体积为200μL,药物的终浓度从第1~10 孔依次为(单位:mg/mL)250.00、125.00、62.50、31.25、15.625、7.81、3.91、1.95、0.98、0.49,共10个稀释梯度,第11孔为阳性对照孔(即生长对照孔),第12孔为阴性对照孔。
(4)培养:滴入无菌液体石蜡密封,盖上板盖,置恒温培养箱内37℃,5%CO2,相对湿度为80%~90%孵育。当阳性对照孔发生颜色改变(即培养液中酚红指示剂由红色变为黄色或橘黄色)且无混浊,加药孔不再出现颜色变化时判定一次结果(发生颜色变化的前1 管的药物稀释浓度为最小抑菌浓度MIC);5d后,所有孔不再发生颜色变化再判定一次结果。每味中药平行重复3次试验。
1.2.4.3 判定标准 目前,国内外对中药抗支原体的最小抑菌浓度(MIC)仍无统一标准,故根据同类试验文献报道[3-5]的判断标准为依据进行判定,即MIC≤7.81mg/mL 时较为敏感,MIC 为7.81~250 mg/mL 时为中度敏感,当MIC>250 mg/mL时为不敏感。
1.2.5 体外细胞毒性试验
1.2.5.1 Vero293 细胞培养 将冻干标准Vero 293细胞加到含10%胎牛血清、1×104IU 青霉素和1×104IU 链霉素的高糖DEME 培养基中,置37℃,5%CO2培养箱中培养。
1.2.5.2 Vero293细胞传代及计数 将Vero 293细胞培养瓶内的培养液弃去,小心用适量PBS把贴壁细胞洗2~3次后,加少量0.25%胰酶,置37 ℃,5%CO2培养箱中温孵3~5 min;待细胞消化完毕后,加适量的培养基终止消化,并反复轻轻吹打细胞,制成均匀的细胞悬浮液;最后加适量培养基,并分装于新的培养瓶中,置37 ℃,5%CO2培养箱中培养2~3d,倒置显微镜下观察,并进行计数。
1.2.5.3 体外细胞毒性测定 取健康Vero 293细胞培养液,接种于无菌96 孔细胞培养板,200μL/孔,保证细胞个数为1×104个/孔,5% CO2,37 ℃孵育,培养24h,至细胞完全贴壁。加入浓度梯度的药液,每孔100μL,平行设6个复孔,于5%CO2,37 ℃孵育24h,显微镜下观察细胞情况。每孔加入0.5%MTT 溶液20μL,继续培养4h。如果药物与MTT 能够反应,可先离心后弃去培养液,小心用PBS冲洗2~3次后,再加入含MTT 的培养液。终止培养,轻轻吸去孔内培养液,每孔加入二甲基亚砜150μL,置摇床上低速振荡10 min,使结晶物充分溶解后,于酶联免疫检测仪OD490nm 处测量各孔的吸光值。同时设置调零孔即空白对照组(培养基、MTT、二甲基亚砜),细胞对照组(不含药物组)。根据半数抑制浓度(IC50)和最大安全浓度(TC0)来评价中药对Vero 293细胞的细胞毒性作用。
1.2.5.3 数据处理 用统计学软件SPSS13.0对所测OD 值的平均值±标准差()进行显著性检验,P<0.05具有显著统计学差异。取6个平行复孔的平均值,计算药物对细胞的抑制率。抑制率=(细胞对照组OD 值-加药组OD 值)/(细胞对照组OD值-空白对照组OD 值)×100%。选取细胞抑制率小于5%的药物浓度为该药的最大安全浓度(TC0)。
2 结果
2.1 药敏试验结果
10味中药中,7味中药对3种畜禽支原体均具有不同程度的体外抑制和杀灭作用,均属于中度敏感范畴,其中两面针MIC值最小,其次甘草和黄柏。另外3味中药广藿香、土槿皮和艾叶MIC 值均大于250mg/mL,即对3种畜禽支原体几乎不敏感。结果见表1。
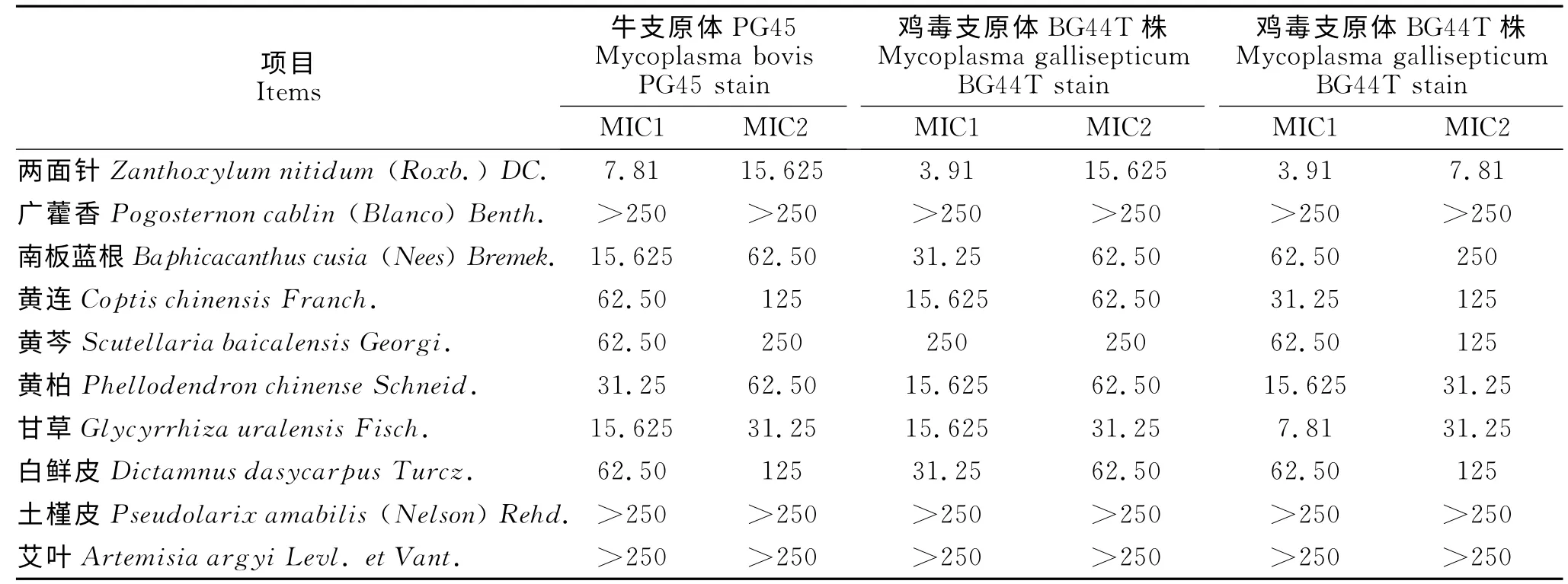
表1 10味中药70%乙醇提取物体外抗畜禽支原体MIC值(n=3)Table 1 MIC of 70%ethanol extracts of ten kinds of traditional Chinese medicine on livestock and poultry mycoplasma(n=3)mg/mL
2.2 体外细胞毒性试验结果
由表2 及图1 可知,加药组和细胞对照组的OD 值,与空白对照组比较,P<0.05,均具有显著统计学差异,表明加药组和细胞对照组均有细胞存活。经测定,两面针、广藿香、南板蓝根、黄连、黄芩、黄柏、甘草、白鲜皮、土槿皮和艾叶等10味中药的TC0(单位:mg/mL)分别为3.91、15.625、7.81、3.91、7.81、7.81、7.81、7.81、<0.49、3.91,IC50(单位:mg/mL)分别为43.62、93.27、84.99、47.20、79.34、81.94、104.55、83.79、3.12、49.68。当两面针、甘草、白鲜皮和艾叶浓度≤0.98mg/mL,广藿香浓度≤3.91mg/mL,南板蓝根、黄连、黄芩和黄柏浓度≤1.95mg/mL,土槿皮浓度<0.49 mg/mL 时,其OD 值与细胞对照组无显著性差异(P>0.05),说明10味中药在上述各浓度范围内对Vero细胞无明显的细胞毒性,且随着药物浓度的降低,OD 值增加,药物对细胞抑制率降低;当药液高于自身TC0时,OD 值则显著低于细胞对照组(P<0.05),且随着浓度增加,OD 值明显下降,抑制率也相应增加,表明在高浓度范围内中药药液对细胞具有不同程度的毒性作用,随着浓度的增加毒性显著增强。故可推断中药浓度与OD 值和抑制率之间存在显著相关性。
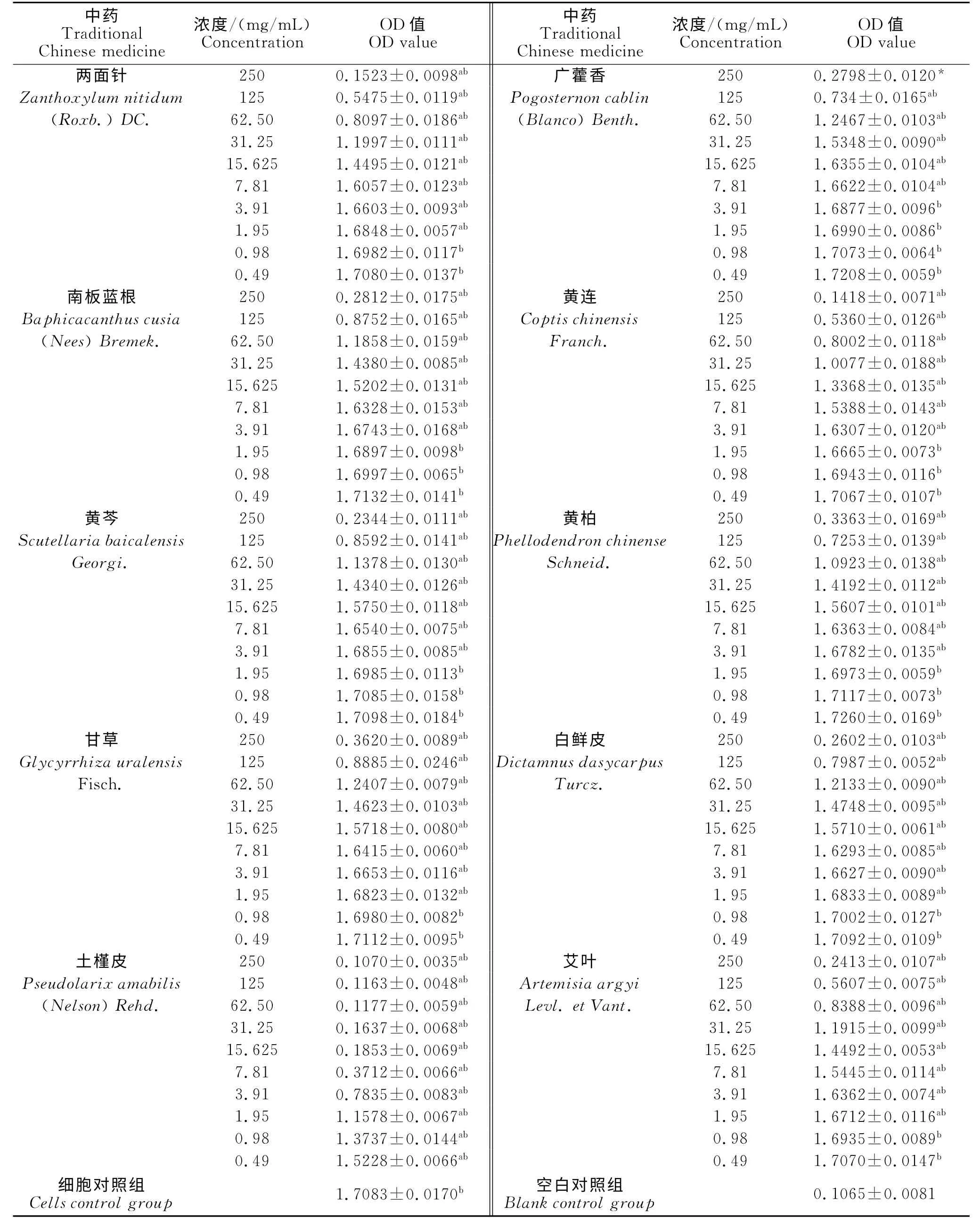
表2 10味中药70%乙醇提取物对Vero细胞毒性测定结果(n=6)Table 2 Cytotoxicity of 70%ethanol extracts of ten kinds of traditional Chinese medicine on vero cells(n=6)
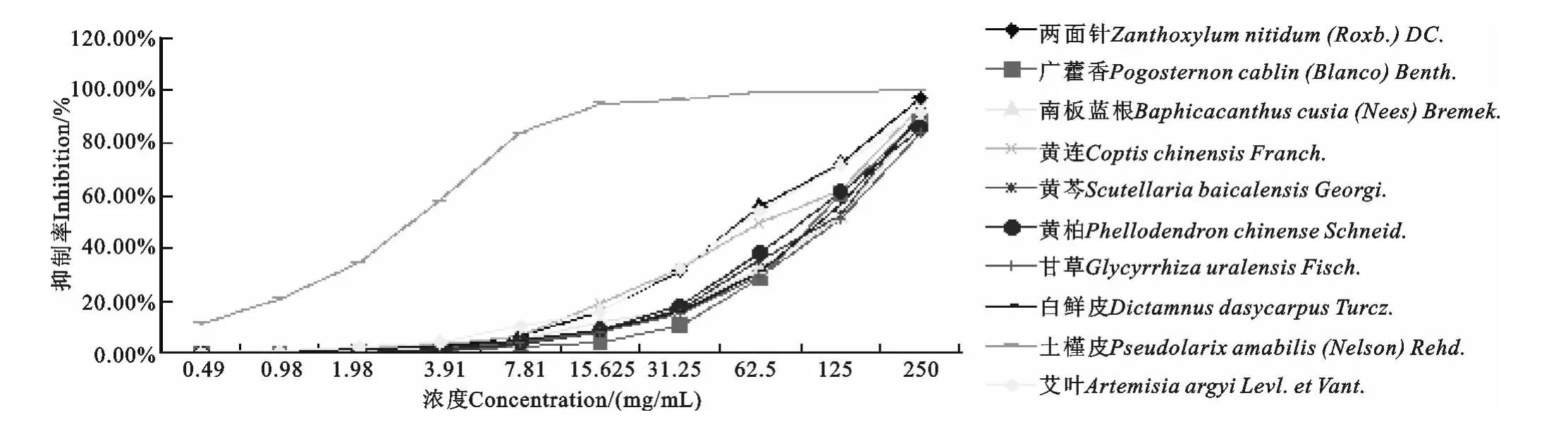
图1 10味中药70%乙醇提取物对Vero细胞抑制曲线Fig.1 Inhibition curves of 70%ethanol extracts of ten kinds of traditional Chinese medicine on vero cells
3 讨论
支原体为兼性厌氧微生物,培养条件最好在37~38 ℃,5%~10%CO2和相对湿度为80%~90%的环境下培养。药物对支原体的MIC测定结果与接种物浓度有很大关系,临床上动物体内的支原体含量约为1×104CCU/mL,故本试验采用1×104CCU/mL作为支原体工作浓度,保持其他实验条件一致性,以确保实验结果的重复性和准确性并具有较好的临床意义。试验用支原体生长的pH 范围在7~8之间,以7.6~7.8最佳,为避免试药本身pH 对支原体的生长繁殖产生影响而干扰试验结果,故测定前需先用5%枸橼酸钠将试药pH 调至与培养基的pH 一致,即pH7.6~7.8。
畜禽支原体病主要以呼吸道感染为主,兽医临床用中药治疗主要以清热解毒、清热燥湿及祛风杀虫为主。本试验主要选用具有清热解毒、清热燥湿、祛风杀虫功效的10味中药70%乙醇提取物对牛支原体PG45株、鸡毒支原体Bc44T 株及羊肺炎支原体Y-98株的敏感性研究,结果表明两面针、南板蓝根、黄连、黄芩、黄柏和甘草这7味中药均具有不同程度的体外抑制和杀灭作用。根据同类试验文献[5-7]的判断标准,7 味中药对畜禽支原体均属于中度敏感范畴。其中两面针(3.91mg/mL≤MIC≤15.625mg/mL)、甘草(7.81mg/mL≤MIC≤31.25mg/mL)和黄柏(15.625mg/mL≤MIC≤62.50mg/mL)敏感性较好;其余3味中药广藿香、土槿皮和艾叶活性最低,MIC均大于250 mg/mL。同时,对空白试剂5%枸橼酸钠做了测定,发现其对畜禽支原体生长无影响。在实验中发现有些中药溶液本身具有一定颜色,使得培养基颜色变深,用肉眼判断其颜色变化,可能会导致实结果误差。因此需要进行多次重复试验,以得到准确的实验数据,其实际操作工作有待进一步完善。
根据单味中药抗支原体活性初步筛选结果,本试验还结合细胞毒性试验,以筛选出理论上可用于临床的无毒或低毒的抗支原体中药。本试验采用的是MTT 法测定中药对Vero细胞的细胞毒性,MTT 法是反映活细胞数量的方法,其原理是MTT 被代谢旺盛的活细胞线粒体脱氢酶还原成的蓝色甲簪结晶就越少,甲簪被溶解后所测得的光密度值就越小,说明细胞存活率低。细胞毒性试验结果表明土槿皮对Vero细胞有一定的细胞毒性,文献记载[16-17]其多作为外用药使用,故因慎用或遵医嘱用药;其他中药细胞毒性很小,对筛选出具有较好抗支原体活性中药具有重要的意义。中药化学成分多而复杂,中药在体内的作用比体外要复杂很多,药物进入机体后对细胞的毒性浓度是否与体外细胞毒性浓度一致,有些中药体外活性可能与临床疗效不一致,尚不清楚。因此仍需进行药理及临床试验等深入研究工作。本细胞毒性试验,可确定药物对细胞的最大安全浓度,评价药物毒性,为以后临床用药提供一定参考。
[1]Roger Miles,Robin Nieholas.Myeo Plasma Protoeols[M].HUMANA press,1998,(104):1.
[2]曹玉璞,叶元康.支原体与支原体病[M].北京:人民卫生出版社,2000,5:1-6.
[3]王爱玲,高伶慧,靳月生,等.禽支原体的分离与鉴定[J].当代畜牧,2008,(5):11-13.
[4]张 利,李玉平,黎晓敏,等.牛支原体药物敏感性试验[J].动物医学进展,2012,33(2):110-113.
[5]陈万平,林 平,边保华,等.中草药体外抗解脲脲原体的药敏研究[J].时珍国医国药,2006,17(7):1 136-1 137.
[6]林 平,边保华,陈万平,等.20味中草药体外对解脲脲原体的抑菌实验研究[J].中国麻风皮肤病杂志,2006,22(5):375-376.
[7]田正阳,丁原全,梁学林.中药抗解脲支原体的药敏试验[J].辽宁中医杂志,2009,36(6):998-999.
[8]王春梅,韩延华.消抗灵Ⅱ号对解脲支原体体外抑菌的实验研究[J].时珍国医国药,2007,18(12):2 924-2 925.
[9]Doris Lechner,Simon Gibbons,Franz Bucar.Plant phenolic compounds as ethidium bromide efflux inhibitors in Mycobacterium smegmatis[J].Journal of Antimicrobial Chemotherapy,2008,62:345-348.
[10]Al-Momani W,Abu-Basha E,Janakat S,et al.In vitro antimycoplasmal activity of six Jordanian medicinal plants against three Mycoplasma species[J].Trop Anim Health Prod,2007,39:515-519.
[11]刘翠艳,赵宏坤,韩春杨.中药免疫调节剂体外细胞毒性测定[J].山东农业大学学报:自然科学版,2007,38(2):225-229.
[12]王蓉蓉,李文莉,田洪,等.不同来源灯盏花素注射液体外细胞毒性比较研究[J].药物分析杂志,2010,30(11):2 173-2 177.
[13]周继春,杨海燕,徐晓月,等.柴胡注射液体外细胞毒性研究[J].药物分析杂志,2010,30(9):1 809-1 812.
[14]刘 倩,秦媛媛,张 媛,等.不同来源生脉注射液体外细胞毒性的比较及原因分析[J].中国中药杂志,2012,37(5):643-647.
[15]徐丽华,李炎,王叔桥,等.穿琥宁注射液的体外细胞毒性考察[J].华西药学杂志,2010,25(4):433-435.
[16]宋永锋,陈 虹,李灵芝.土槿皮的研究进展[J].天津药学,2001,13(6):9-10.
[17]曾 颂,韩秀奇,李书渊.木槿皮、土荆皮、水翁皮的本草考证及现代研究[J].广东药学院学报,2011,27(2):207-210.
