黄芩苷对人肺腺癌LTEP-A2细胞的抑制作用及机制研究
2014-01-21韦小白董竞成
韦小白董竞成
(1复旦大学附属华山医院静安分院,上海,200040;2复旦大学附属华山医院,上海,200040)
黄芩苷对人肺腺癌LTEP-A2细胞的抑制作用及机制研究
韦小白1董竞成2
(1复旦大学附属华山医院静安分院,上海,200040;2复旦大学附属华山医院,上海,200040)
目的:研究观察黄芩苷对人肺腺癌LTEP-A2细胞株体外的抑制作用及相关机制。方法:采用不同浓度的黄芩苷干预人肺腺癌LTEP-A2细胞株,用CCK-8方法检测不同时间点不同浓度的黄芩苷对肺癌细胞增殖的抑制程度,接着用细胞划痕试验和Transwell小室侵袭试验观察黄芩苷对肺癌细胞体外迁移、侵袭能力的影响;用Western blot进一步检测黄芩苷干预后肺癌细胞MMP-2、MMP-9、TGF-β的表达的变化。结果:黄芩苷能明显抑制肺癌细胞增殖;能不同程度降低肺癌细胞的迁移、侵袭、体外划痕愈合能力,呈浓度依赖性;黄芩苷能不同程度下调MMP-2、MMP-9表达,其中以高浓度效果明显,中浓度居中,低浓度作用稍弱,与空白对照组比较,组间差异有统计学意义,P<0.05;对肺癌细胞TGF-β的表达没有显著影响,与对照组比较,P>0.05。结论:黄芩苷能不同程度地降低肺癌增殖迁移侵袭的能力,其机制可能是通过下调MMP-2、MMP-9的表达从而对肺癌细胞的增殖、迁移、侵袭发挥抑制作用。
黄芩苷;增值;迁移;LTEP-A2细胞;MMP-2;MMP-9
黄芩苷(Baicalin)是从唇形科植物黄芩中提取、分离出来的黄酮类化合物,是黄芩的主要有效成分之一,具有多种药理作用,如:抗菌、抗氧化、诱导干细胞分化等[1-3]。近年来,随着对黄芩苷的深入研究,发现黄芩苷还能够抑制黏液表皮样癌肿瘤细胞增殖,促进肿瘤细胞凋亡,具有显著的抗肿瘤作用[4]。目前,对黄芩苷抗肿瘤作用的实验研究主要集中在人前列腺癌、膀胱癌、肝细胞癌、乳腺癌、结肠癌和恶性黑色素瘤等恶性肿瘤[5-6],但是关于黄芩苷作用于肺癌细胞株的研究较少,如仅有少量报道黄芩提取物能够诱导SPC-A-1细胞凋亡,其机制可能与黄芩提取物能上调caspase -3表达和下调survivin基因表达有关[7]。既然黄芩苷对肺癌细胞株SPC-A-1有作用,那么对肺癌细胞株LTEP-A2又有着怎样的作用?除了诱导细胞凋亡,黄芩苷是否还可通过其他途径发挥作用,目前仍不是十分清楚。为了进一步明确黄芩苷的抗肿瘤作用,本研究观察其对LTEP-A2细胞增殖、迁移、侵袭的影响,并进行相关分子机制的初步探讨,以期为临床应用黄芩苷治疗肺癌提供科学的理论依据。
1 材料和方法
人肺癌细胞株LTEP-A2购自中国科学院上海细胞生物研究所。药物黄芩苷购自南京青泽医药公司,纯度:99.1%。小牛血清、RPMI1640培养液购自Gibco公司;CCK8试剂购自日本同仁化学研究所;β-actin抗体为Santa Cruz公司产品;MMP-2、MMP-9、TGF-β抗体为Cell signaling technology公司产品;HRP标记羊抗兔二抗为北京康为世纪生物科技有限公司产品。实验共分为4组,分别为50μmol/L、100μmol/L、200 μmol/L黄芩苷组,空白对照组加等量0.5%二甲基亚砜(DMSO)。
1.1 CCK-8法 取对数生长期细胞按1×105/mL接种于96孔板内,设3个复孔,加入不同浓度黄芩苷,总体积100μL,培养24、48、72、96 h后,每孔加入CCK -8溶液10μL,继续培养2 h后用酶标仪测定在450 nm处的吸光度(A),计算细胞增殖抑制率,绘制细胞增殖抑制曲线。增殖抑制率计算公式:增殖抑制率(%)=(A对照组-A实验组)/A对照组×100%。
1.2 Transwell小室侵袭试验 采用24孔板Transwell小室进行,包被有胶原基质的Matrigel滤膜孔径为8 μm。分别将50μmol/L、100μmol/L、200μmol/L黄芩苷处理的肺腺癌LTEP-A2细胞株用0.25%胰蛋白酶消化后,以105个/孔接种于上层小室,下层小室加入10%胎牛血清(FBS)培养液,37℃孵育24 h,取出滤膜,用棉拭子轻轻擦掉滤膜上层的细胞,将滤膜用PBS淋洗,固定、染色(参照细胞迁移实验相关步骤),置于甲醇固定10 min,高倍镜下随机选取5个视野,计数迁移至滤膜下层的细胞,实验重复3次。抑制率(%)=(实验组侵袭细胞的数量/对照组侵袭细胞的数量)× 100%。
1.3 Transwell小室细胞迁移试验 将Fibronectin 200倍稀释至终浓度50μg/mL,在Transwell小室内加入100μL,小室外加入400μL,4℃过夜。准备受试细胞悬液:取对数生长期细胞,吸取细胞培养液,无钙磷的PBS液冲洗,胰蛋白酶消化细胞,用含1%FBS细胞培养液收集和重悬细胞,调整细胞密度为1×105/mL。吸取transwell中Fibronectin,PBS冲洗一次。将Transwell小室放入24孔培养板中,在小室外加入400μL含10%FBS完全培养液,37℃,5%CO2饱和湿度培养箱中孵育6 h,PBS漂洗3次,4%PAF固定30 min,PBS漂洗3次,Cooomassieblue室温染色适当时间。倒置显微镜下1×10物镜计数贴附于小室多孔膜上的总细胞数(No),棉签擦去小室多孔膜上方细胞,计数残留在小室多孔膜下方的细胞数(N1)。按以下公式计算细胞迁移率:细胞迁移率=N1/No×100%。每孔计数5个视野。
1.4 细胞划痕试验 将肺腺癌LTEP-A2细胞株传代于玻片上,生长至100%汇合后,用无菌吸头在玻片上划痕。磷酸盐缓冲液(PBS)洗净被刮下的细胞,每孔加纤连蛋白后分别加入50μmol/L、100μmol/L、200 μmol/L黄芩苷,对照组加等量0.5%二甲基亚砜(DMSO),孵育96 h,取出玻片,低倍视野下观察细胞伤口愈合情况。随机选取5个视野,计数迁移细胞的数量,以此表示细胞的迁移活性。实验平行重复3次。计算:细胞迁移抑制率(%)=(实验组迁移细胞数/对照组迁移细胞数)×100%。
1.5 MMP-2、MMP-9、TGF-β蛋白表达的Westernblot检测 收集50μmol/L、100μmol/L、200μmol/L黄芩苷处理96 h的LTEP-A2细胞及对照组细胞,用PBS洗涤,加入5倍体积含蛋白酶抑制剂的细胞裂解液,冰浴20 min,12 000 r/min离心15 min,弃去沉淀,上清液为细胞总蛋白。用Bradford法测定蛋白含量。100℃变性10 min,每孔加等量的蛋白样品进行12% SDS-PAGE凝胶电泳,然后电转移至PVDF膜上,5%牛奶室温封闭1 h。分别加入兔抗人MMP-2、MMP-9、TGF-β抗体,4℃孵育过夜。以TBS漂洗5 min×3次,加入羊抗兔HRP标记二抗,室温孵育1 h后TBS漂洗5 min×3次,用化学发光法检测后分析结果。
1.6 统计学处理 实验数据用SPSS 11.5统计软件进行统计分析。计量资料用(±s)表示,两两比较采用t检验。以P<0.05为差异有统计学意义。
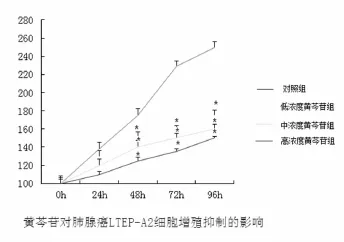
图1 黄芩苷对肺腺癌LTEP-A2细胞体外增殖的影响(*提示P<0.05)
2 结果
2.1 黄芩苷对肺腺癌LTEP-A2细胞增殖抑制作用
CCK-8方法检测黄芩苷对LTEP-A2细胞增殖的影响,结果发现不同浓度的黄芩苷对肺癌细胞有着不同程度的抑制作用,其中高浓度组(200μmol/L)的抑制作用最明显,中浓度组(100μmol/L)的抑制作用居中,低浓度组(50μmol/L)次之。随着时间的推移,不同浓度的黄芩苷作用于肺癌细胞24 h后开始显示出抑制作用,48 h后作用显著,96 h后达到高峰,与对照组比较,差异有统计学意义,P<0.05(如图1)。
2.2 黄芩苷对肺腺癌LTEP-A2细胞迁移作用的影响 将不同浓度的黄芩苷预处理96 h后进行划痕实验、transwell小室迁移实验。结果如图2所示:三种不同浓度的黄芩苷能不同程度降低LTEP-A2肺癌细胞的体外愈合能力,其中高浓度组(200μmol/L)的抑制作用最明显,中浓度组(100μmol/L)的抑制作用居中,低浓度组(50μmol/L)次之,与对照组比较,差异有统计学意义,P<0.05(如图2、图3)。
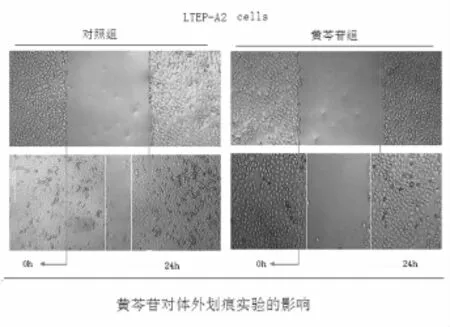
图2 黄芩苷对肺腺癌LTEP-A2细胞体外划痕试验的影响
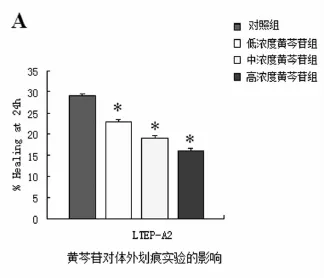
图3 黄芩苷对肺腺癌LTEP-A2细胞体外划痕试验影响统计图(*P<0.05)
2.3 黄芩苷对肺腺癌LTEP-A2细胞侵袭作用的影响 将不同浓度的黄芩苷预处理96 h后进行Transwell小室侵袭实验。结果如图所示:三种不同浓度的黄芩苷能不同程度降低LTEP-A2肺癌细胞的侵袭能力,其中以其中高浓度组(200μmol/L)的抑制作用最明显,中浓度组(100μmol/L)的抑制作用居中,低浓度组(50μmol/L)次之,与对照组比较,差异有统计学意义,P<0.05(如图4)。
2.4 黄芩苷对肺腺癌LTEP-A2细胞MMP-2、MMP -9、TGF-β蛋白表达的影响 将不同浓度的黄芩苷预处理96 h后进行Westernblot检测。结果表明:三种不同浓度的黄芩苷能不同程度的下调LTEP-A2肺癌细胞MMP-2、MMP-9表达,其中以其中高浓度组(200μmol/L)的抑制作用最明显,中浓度组(100 μmol/L)的抑制作用居中,低浓度组(50μmol/L)稍弱,与对照组比较,差异有统计学意义,P<0.05。而黄芩苷对肺腺癌LTEP-A2细胞TGF-β蛋白表达没有影响,与对照组比较,P>0.05(如图5、图6)。
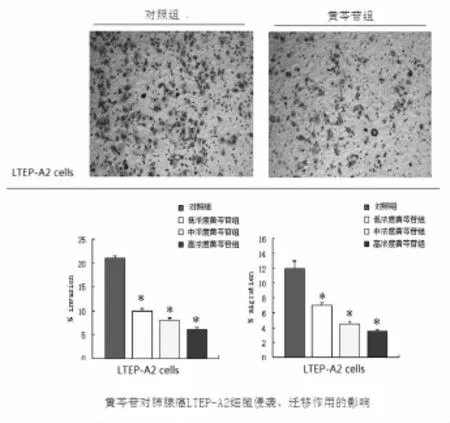
图4 黄芩苷对肺腺癌LTEP-A2细胞迁移侵袭能力的影响
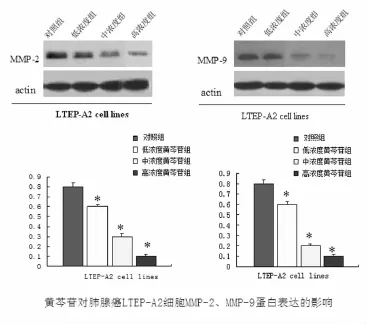
图5 黄芩苷对肺腺癌LTEP-A2细胞MMP-2,MMP-9的影响
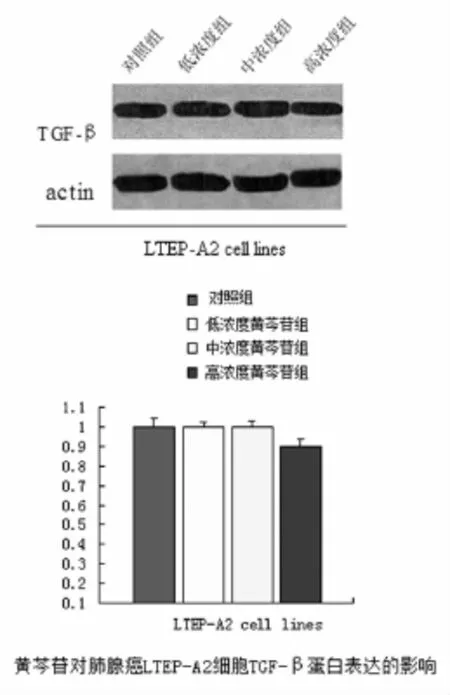
图6 黄芩苷对肺腺癌LTEP-A2细胞TGF-β的影响
3 讨论
肺腺癌是人类常见的恶性肿瘤之一,在我国,肺腺癌死亡居恶性肿瘤首位[8]。由于肺腺癌细胞具有快速侵袭、迁移的特征,因此它是肺癌预后最差的病理类型之一[9-10]。因此,如何有效抑制肺腺癌细胞的增殖、迁移、侵袭,是改善预后、控制病情进展的关键。
黄芩性寒、味苦,归肺、心、肝、胆、大肠经,具有清热燥湿、泻火解毒等功效。主治壮热烦渴,肺热咳嗽,黄疸,目赤肿痛,胎动不安,痈肿疗疮等。关于黄芩可治肿瘤的功效,早在《神农本草经》就载黄芩具有“主诸热黄疸,肠癖泄痢,逐水,下血闭,恶疮疽蚀火疡”的功效。而黄芩苷为传统中药黄芩的主要有效成分之一,目前研究发现黄芩苷对多种肿瘤均有较好的作用。如王英俊等[6]用不同浓度的黄芩苷处理结肠癌细胞株SW-1116后,发现50,100,200μmol/L黄芩苷能够诱导结肠癌细胞株SW-1116凋亡,凋亡率与剂量呈正相关,并随药物浓度和作用时间而变化。细胞周期分布呈现G1期比例逐渐增高,出现典型的凋亡峰。说明黄芩苷能诱导结肠癌细胞凋亡,并明显抑制癌细胞增殖,具有抗肿瘤作用。现有研究表明黄芩苷可以通过多种途径发挥抗肿瘤作用,如抑制肿瘤新生血管生成从而降低肿瘤细胞的增值迁移[11],如通过降低环氧化酶-2的表达抑制前列腺素E2的产生,进而阻断前列腺素合成酶对肿瘤细胞的促进作用[12]。而关于黄芩苷对于肺癌细胞迁移、侵袭能力的作用及机制研究,目前缺乏相关报道。本研究结果显示,黄芩苷对LTEPA2细胞增殖具有明显的抑制作用。同时,经过黄芩苷的干预后,肺癌细胞的侵袭、迁移能力与对照组比较都有不同程度的降低。且这种抑制作用具有时间和剂量依赖性,这和已有报道黄芩苷能抑制人肝癌细胞的侵袭能力[13]一致。
基质金属蛋白酶(MMPs)对基底膜中细胞外基质的降解是肿瘤浸润和转移的重要步骤之一[14-15]。MMPs家族是一类内源性蛋白水解酶,MMP-2和MMP-9是该家族的重要成员,这两种酶的主要功能为降解明胶和Ⅳ、Ⅴ、Ⅶ、Ⅹ型基底膜胶原,在细胞与基质间的黏附中起着重要的作用,MMP-2、MMP-9的表达与肿瘤侵袭关系密切。有研究显示,在肺癌细胞中,MMP-2、MMP-9高表达可促进该肿瘤的浸润、转移[16]。
TGF-β在乳腺癌、卵巢癌、结肠癌、非小细胞肺癌等多种肿瘤中均有表达,是预测相关肿瘤的易感性及肿瘤预后的重要细胞因子[17-21]。有研究表明,TGF-β可促进前列腺癌的侵袭转移[11]。既然MMPs和TGF -β在肺癌的转移复发中如此重要,而黄芩苷能显著抑制肺癌细胞的迁移、侵袭,那么用黄芩苷干预后这些细胞因子是否也发生改变?本实验研究发现,与对照组比较,黄芩苷组的MMP-2、MMP-9的表达下降,TGF-β表达不变。为了进一步验证黄芩苷与MMP-2、MMP-9与TGF-β的关系,我们分别用不同浓度的黄芩苷干预肺癌细胞,结果发现高浓度的黄芩苷组MMP-2、MMP-9表达最低,低浓度组较高浓度组表达高,中浓度组居中,而不同浓度的黄芩苷对TGF-β表达没有影响。
总之,本研究发现黄芩苷能不同程度地降低肺癌增殖迁移侵袭的能力,其机制可能是通过下调MMP-2、MMP-9的表达从而对肺癌细胞的增殖、迁移、侵袭发挥抑制作用。
[1]Zhang S,Jin Y,Zhu W,et al.Baicalin released from scutellariabaicalensis induces autotoxicity and promotes soilborn pathogens[J].ChemEcol,2010,36:329-338.
[2]Li CT,Zhang WP,Fang SH,et al.Baicalin attenuates oxygen-glucose deprivation-induced injury by inhibiting oxidative stress-mediated 5-lipoxygenase activation in PC12 cells[J].ActaPharmacol Sin,2010,31:137-144.
[3]Liang XL,Liao ZG,Zhu JY,et al.The absorption characterization effects and mechanism of Radix Angelicaedahuricae extractson baicalin in Radix Scutellariae using in vivo and in vitro absorption models[J].Ethnopharmacol,2012,139:52-57.
[4]Xu X F,Cai B L,Guan SM,et al.Baicalin induces human mucoepidermoid carcinoma Mc3 cells apoptosis in vitro and in vivo[J].Invest New Drugs,2011,29(4):637-645.
[5]IkezoeT,ChenSS,HeberD,et al.Baicalin is a major component of PC SPES which inhibits the proliferation of human cancer cells via apoptosis and cell cycle arrest[J].Prostate,2001,49(4):285-292.
[6]王英俊,付莉,华海婴.黄芩苷诱导结肠癌细胞株SW1116凋亡的研究[J].TCM Res,2007,20(6):22.
[7]Wei PY,Pu HQ,Wei X,et al.Apoptosis-inducing effect of Scutellariabar bata extract human lung cancer SPC-A-1 cells and the expression of apoptosis associated genes[J].Zhongyaocai,2007,30(10):1270.
[8]Jemal A,Siegel R,Xu J,Ward E.Cancer statistics[J].CA Cancer Clin,2010,60:277-300.
[9]Janssen-Heijnen ML,CoeberghJW.The changing epidemiology of lung cancer in Europe[J].Lung Cancer,2003,41:245-258.
[10]Devesa SS,Bray F,Vizcaino AP,et al.International lung cancer trends by histologic type:male or female differences diminishing and adenocarcinoma rates rising[J].Cancer,2005,117:294-299.
[11]Liu JJ,Huang TS,Cheng WF,et al.Baicalein and baicalin are potent inhibitors of angiogenesis:Inhibition of endothelial cell proliferation,migration and differentiation[J].Int J Cancer,2003,106(4):559-565.
[12]Jui Chao,Su WC,Liu HF.Baicalein induces cancer cell death and proliferation retardation by the inhibition of CDC2 kinase and survivin associated with opposite role of p38 mitogen-activated protein kinase and AKT[J].Mol Cancer Ther,2007,6(11):3039-3048.
[13]Chiu YW,Lin TH,Huang WS,et al.Baicalein inhibits the migration and invasive properties of human hepatoma cells[J].ToxicolAppl Pharmacol,2011,255:316-326.
[14]Baek MJ.Prognostic Role of MMPs in colorectal cancer[J].Korean Soc-Coloproctol,2011,27:105-106.
[15]Roomi MW,Monterrey JC,Kalinovsky T,et al.Inhibition of invasion and MMPs by a nutrient mixture in human cancer cell lines:a correlation study[J].ExpOncol,2010,32:243-248.
[16]Gao M,Zhang JH,Zhou FX,et al.Angelicasinensis suppresses human lung adenocarcinoma A549 cell metastasis by regulating MMPs/TIMPs and TGF-β1[J].Oncol Rep,2012,27:585-593.
[17]Yin J,Lu K,Lin J,et al.Genetic variants in TGF-beta pathway are associated with ovarian cancer risk[J].PLoS One,2011,6:e25559.
[18]Scollen S,Luccarini C,Baynes C,et al.TGF-beta signaling pathway and breast cancer susceptibility[J].Cancer Epidemiol Biomarkers Prev,2001,20:1112-1119.
[19]Fang F,Yu L,Zhong Y,et al.TGFB1 509 C/T polymorphism and colorectal cancer risk:a meta-analysis[J].Med Oncol,2010,27:1324-1328.
[20]Bhayal AC,rabhakar B,Rao KP,etal.Role of transforming growth factor -beta1-509 C/T promoter polymorphism in gastric cancer in south Indian population[J].Tumour Bio,2011,32:1049-1053.
[21]Lin M,Stewart DJ,Spitz MR,et al.Genetic variations in the transforming growth factor-beta pathway as predictors of survival in advanced non-small cell lung cancer[J].Carcinogenesis,2011,32:1050-1056.
(2013-10-10收稿 责任编辑:王明)
Study on Inhibition Effect and Mechanism of Baicalin on LTEP-A2 Cells in Lung Cancer Patients
Wei Xiaobai1,Dong Jingcheng2
(1 Jingan Branch of Huashan Hospital affiliated to Fudan University,Shanghai200040,China;2 Huashan Hospital affiliated to Fudan University,Shanghai200040,China)
Objective:To explore the inhibition effects and mechanism of baicalin on LTEP-A2 cells in vitro of lung cancer patients.Methods:Human pneumonicadenocarcinoma cell line LTEP-A2 was cultured with different dose of baicalin for different periods of time. Cell proliferation was assayed by using Cell Counting Kit-8,and further in vitro study including tumor cell migration and invasion,wound healing assays were performed.Besides,MMP-2,MMP-9,TGF-β,which were related to the migration and metastasis potential in lung cancer cell lines were detected by western blot.Results:Baicalin inhibited the proliferation of LTEP-A2 cells in a time and concentrationdependent manner.In tumor cell migration and invasion test,wound healing assays etc.showed significantly decreased migration,invasion in baicalin-treated cell groups vs control tumor cells.Further study showed that MMPs decreased after baicalin-treated.The higher doses of baicalin,the lower level of MMP-2/MMP-9.However,baicalin did not have a significant effect on the TGF-β.Conclusion:Baicalin inhibits the proliferation and migration of lung cancer LTEP-A2 cells,possibly by decreasing the expression of MMP-2,MMP-9 in part.
Baicalin;Proliferation;Metastasis;LTEP-A2 cells;MMP-2;MMP-9
R285.5;R734.2
A
10.3969/j.issn.1673-7202.2014.02.025
董竞成(1959—),男,博士,博士生导师,教授,复旦大学附属华山医院中西医结合研究所,E-mail:jcdong2004@126.com
韦小白(1981—),女,博士,复旦大学附属华山医院静安分院,E-mail:weixiaobai2005@163.com
