猪三种不同直径卵泡中颗粒细胞的比较研究
2014-01-20邓红惠耿果霞贺亚媚江中良石美虹陈华丽李青旺
邓红惠,耿果霞,贺亚媚,江中良,石美虹,陈华丽,李青旺*
(1.西北农林科技大学动物科技学院,陕西杨凌712100;2.西北农林科技大学动物医学院,陕西杨凌712100)
卵巢是母畜重要生殖器官之一,颗粒细胞是卵巢的主要功能细胞,其增殖分化直接影响卵泡发育、排卵启动、黄体形成及类固醇激素的合成分泌等功能[1]。近年来以颗粒细胞作为生殖研究模型受到研究者越来越多的青睐。外源或内源物质通过与颗粒细胞相互作用进而影响卵巢生殖功能,甚至直接作用(Porter等[2]与Basini等[3]对催乳素的研究)。Jackowska等[4]研究发现不同直径卵泡中卵母细胞的多种基因表达不同,为探究不同直径范围的有腔卵泡中颗粒细胞质量是否相同,本试验将猪有腔卵泡按直径分为大中小三种类型并获得相应颗粒细胞进行分析,以期为后续生殖毒理学研究奠定基础。
1 材料与方法
1.1 材料
成年猪卵巢采集自雨润集团杨凌万盛屠宰场。DMEM/F12培养基和胎牛血清购自Gibco公司,MTT,DMSO,Insulin 及BSA 购自Sigma 公司,RNA 提取及反转录试剂购自TAKARA 公司,荧光定量试剂均购自Vazyme公司,FSH(100IU/支)购自宁波第二激素厂。
1.2 方法
1.2.1 卵巢颗粒细胞的分离与培养 从屠宰场获取成年猪卵巢,置于37 ℃含1%青链霉素的生理盐水中,30 min 内带回实验室。灭菌清洗后,借鉴Jiang 等[5]的方法,剖剪出卵巢内三种直径范围的有腔卵泡(<2 mm,2~5 mm,≥5 mm),分别置于DMEM/F12中,并清洗3次。转移入60 mm 无菌平皿,十字状剪破卵泡,使卵泡液充分流出,400目筛网过滤,收集细胞混合液,800r/min离心5min,洗涤颗粒细胞3次。用添加0.3%BSA,50ng/mL胰岛素,0.1IU/mL FSH,3% FBS,100IU/mL 青霉素,100mg/ml链霉素的DMEM/F12完全培养液重悬细胞,台盼蓝染色计数,调整细胞密度为5×105/mL后接种于培养板,置于37 ℃,5%CO2条件下培养。
1.2.2 卵巢颗粒细胞计数及活率、纯度计算 将充分混匀的细胞悬液取出100μL,与0.4%台盼蓝染液按9∶1混匀,台盼蓝拒染法检测细胞活性,用血细胞计数板在3min内完成计数,计算细胞总数及细胞活率;采用剖剪法、400目过滤所得的细胞中有两种类型细胞,一种是数量上占绝对优势的呈圆形或类圆形细胞,另一种是极少数的纤维状细胞,在显微镜下观察形态计算圆形和类圆形细胞所占的百分比,以初步计算细胞纯度。
1.2.3 颗粒细胞鉴定FSHR基因特异性表达于卵巢颗粒细胞[6],故可用于颗粒细胞的鉴定;LHR基因能反映颗粒细胞所处阶段黄体化程度,故可用于衡量颗粒细胞变性情况。设计特异性引物(表1),进行实时定量分析以鉴定颗粒细胞。

表1 实时定量PCR 的特异性引物Table 1 The primer sequences used in real-time quantitative PCR analysis
1.2.4 细胞生长曲线测定 将细胞以5×105个/mL密度接种于96孔板,8个复孔,200uL/孔,采用MTT 方法于24,48,72,96,120,144h检测OD490。以时间为横坐标,OD490光吸收值为纵坐标绘制细胞生长曲线。
2 结果与分析
2.1 猪有腔卵泡分级
剖剪出卵泡液透亮的有腔生长卵泡,卵泡细化分级标准为:小型卵泡<2mm,中型卵泡2~5mm,大型卵泡≥5mm。
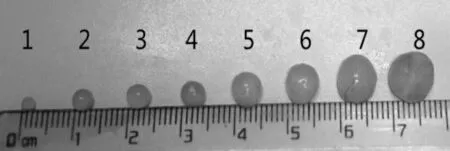
图1 不同级别的猪卵泡1.小卵泡;2-5.中型卵泡;6-8.大型卵泡Fig.1 Different types of procine follicle1.Small follicles;2-5.Middle follicles;6-8.Large follicles
2.2 卵巢颗粒细胞计数及活率计算、纯度估算
采用机械剖剪法及过滤等获得的三种直径有腔卵泡颗粒细胞得率高,活率均超过68%,纯度达到90%以上(表2)。
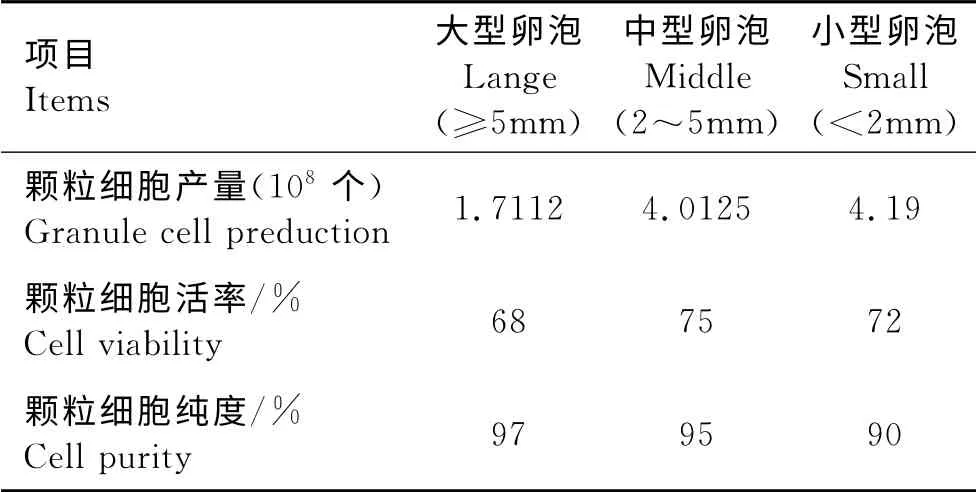
表2 不同直径卵泡中所获得颗粒细胞的活率与纯度Table 2 The yield,viability and purity of granulosa cells from three follicles of different diameters
2.3 颗粒细胞形态学观察
新分离的猪卵巢颗粒细胞呈圆形或类圆形单个分散存在,进行培养24h后,细胞开始单层贴壁生长(图2);36h后开始铺展呈团样集落生长(图3),48h后集落样的数量增多,出现成串细胞群(图4);培养96h聚集生长现象明显,鸟巢状的细胞团块增加(图5)。

图2 培养24h的猪卵巢颗粒细胞(200×)Fig.2 Porcine granulosa cells nurtured for 24h(200×)

图3 培养36h的猪卵巢颗粒细胞(200×)Fig.3 Porcine granulosa cells nurtured for 36h(200×)

图4 培养48h的猪卵巢颗粒细胞(200×)Fig.4 Porcine granulosa cells nurtured for 48h(200×)

图5 培养96h的猪卵巢颗粒细胞(200×)Fig.5 Porcine granulosa cells nurtured for 96h(200×)
2.4 细胞生长曲线测定
细胞生长曲线(图6)表明,24h前细胞处在贴壁适应期,1d后开始进入对数生长期,OD值明显增加,细胞大量增殖,判断细胞进入对数生长期,并于第5d达到最高密度,说明细胞在此时生长极度旺盛。
2.5 颗粒细胞鉴定
2.5.1 形态学观察 在倒置显微镜下观察猪颗粒细胞,形态呈圆形或类圆形。
2.5.2 实时定量结果 实时定量结果(图7)显示,三种不同直径卵泡中获得的颗粒细胞中FSHR基因表达阳性,LHR基因也检测到表达。小型卵泡中颗粒细胞的FSHR的表达量最高且LHR的表达量最低,大型和中型卵泡中获得的颗粒细胞FSHR的表达差异不显著(P>0.05),而LHR基因在大型卵泡中表达显著高于中型卵泡(P<0.05)。
3 讨论
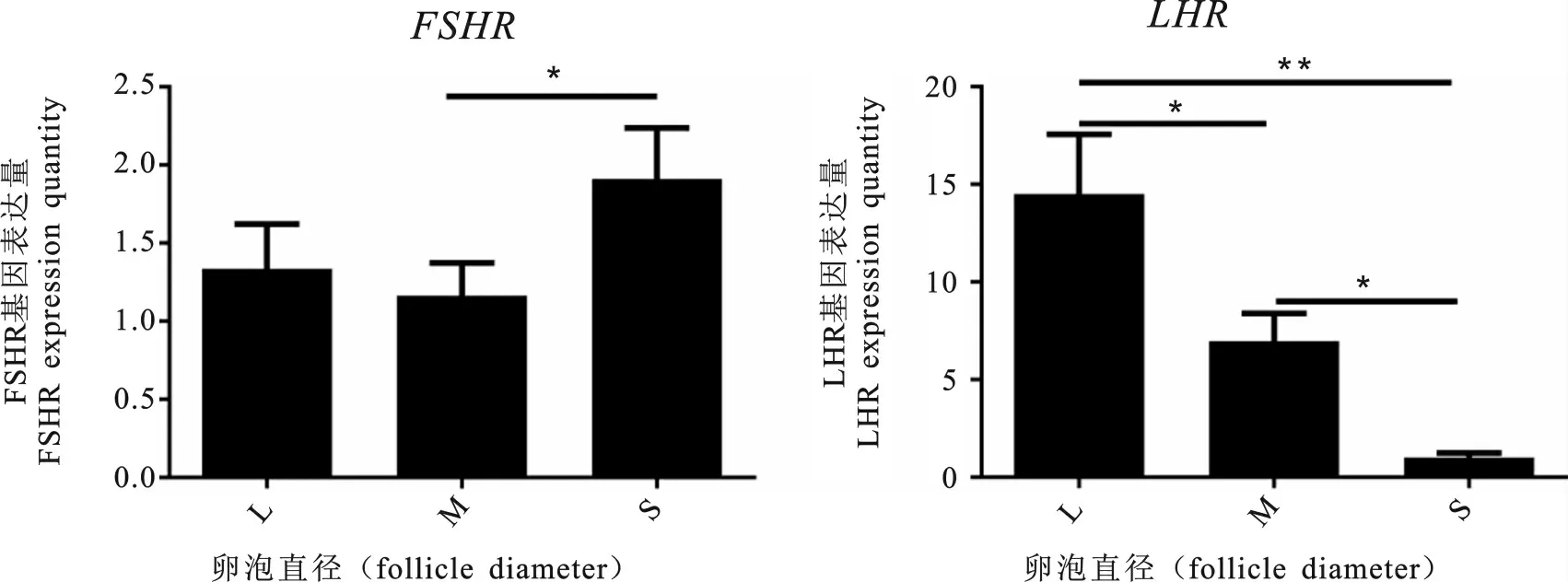
图7 不同直径卵泡颗粒细胞FSHR 及LHR 表达L.大型卵泡中颗粒细胞;M.中型卵泡中颗粒细胞;S.小型卵泡中颗粒细胞Fig.7 The FSHR and LHR expression in GCs from three follicles of different diametersL.Large follicles;M.Middle follicles;S.Small follicles
目前,卵巢颗粒细胞的培养不仅用于生殖生理方面的基础研究,在生殖病理、毒理等研究方面的作用也日趋重要[7]。因此,研究颗粒细胞是生殖相关研究的很好的切入点[8]。由于猪卵巢结缔组织丰富,分离困难,这就使得卵泡的分离获得成为制约研究的重要步骤之一。之前的研究表明酶消化法对卵泡基膜会造成一定程度的破坏而影响卵泡机能[9],目前大多数研究者更倾向于采用机械分离法来获得卵泡[10]。本试验采用机械剖剪法分离获得了猪不同直径卵泡中的颗粒细胞,结果显示细胞得率高,且获得了较高的成活率及纯度,与文献报道一致[11]。显微镜下观察培养的细胞生长状态良好,呈单层贴壁,集落状生长。对不同直径卵泡获得的颗粒细胞进行生长曲线测定,结果显示,猪卵巢颗粒细胞的对数生长期为24~120h,其中48~96h生长最为旺盛。因此我们下一步试验推荐在48~72h间进行,如此能使得细胞在整个试验过程中处于对数生长期状态。Santini等[12]和Tiemann等[13]均在细胞培养48h时进行相关试验,Nynca等[14]在72h 进行试验,这均与我们的结果相符。同时,三类颗粒细胞中,中型卵泡的颗粒细胞的生长曲线S型更为典型,达到平台期时所获细胞数量也最多。
FSHR于卵巢颗粒细胞细胞膜特异性表达[6,8,15],本试验采用实时定量方法检测FSHR的表达以鉴定颗粒细胞,由于试验中颗粒细胞均取自于有腔卵泡,可能会有不同程度的黄体化现象,故同时检测LHR基因的表达,比较三类颗粒细胞黄体化程度。根据实时定量结果,小型卵泡中颗粒细胞的FSHR的表达量最高且LHR的表达量最低即黄体化程度最低,但由于其卵泡直径很小,剖剪难度大,细胞纯度低,生长曲线情况较其他两种不理想,在靳双星等进行卵泡培养过程中,部分卵泡死亡,以较小卵泡死亡为主,小卵泡死亡多是变形解体[10],故不宜成为研究所需的理想类型,大型和中型卵泡所获得的颗粒细胞FSHR的表达量差异性不显著,但LHR的基因表达量差异性显著,大型卵泡中颗粒细胞黄体化程度显著高于中型卵泡,且中型卵泡中颗粒细胞的成活率最高75%,纯度95%,生长曲线即细胞生长状态为最优。
综合卵泡获得难易程度、细胞得率、颗粒细胞活率、纯度、体外培养生长增殖状态、FSHR基因表达情况及黄体化程度等分析,试验结果证明,中型卵泡为后续生殖毒理学试验研究的最适细胞来源。
[1]Havelock J C,Rainey W E,Carr B R.Ovarian granulosa cell lines[J].Molecular and Cellular Endocrinology,2004,228(1-2):67-78.
[2]Porter M B,Brumsted J R,Sites C K.Effect of prolactin on follicle-stimulating hormone receptor binding and progesterone production in cultured porcine granulosa cells[J].Fertil Steril,2000,73(1):99-105.
[3]Basini G,Baioni L,Bussolati S.Prolactin is a potential physiological modulator of swine ovarian follicle function[J].Regul Pept,2014,189:22-30.
[4]Jackowska M,Kempisty B,Wozna M.Differential expression of GDF9,TGFB1,TGFB2and TGFB3in porcine oocytes isolated from follicles of different size before and after culture in vitro[J].Acta Vet Hung,2013,61(1):99-115.
[5]Jiang Z,Price C A.Differential actions of fibroblast growth factors on intracellular pathways and target gene expression in bovine ovarian granulosa cells[J].Reproduction,2012,144(5):625-632.
[6]Taru Sharma G,Dubey P K,Sai Kumar G.Localization and Expression of Follicle-Stimulating Hormone Receptor Gene in Buffalo(Bubalus bubalis)Pre-Antral Follicles[J].Reproduction in Domestic Animals,2011,46(1):114-120.
[7]张天宝.大鼠卵巢细胞体外培养及生殖毒理研究中的应用[J].卫生毒理学杂志,1997(2):60-62.
[8]白晓红,糜若然,岳天孚,等.体外培养人卵巢黄素化颗粒细胞的鉴定及其分泌功能变化[J].中华妇产科杂志,2005(5):351-352.
[9]叶 婧,丁 婷,杜小芳,等.不同分离方法对人卵巢颗粒细胞体外培养的影响[J].中国现代医学杂志,2013(17):1-5.
[10]靳双星,张桂枝,李跃民.猪腔前卵泡机械分离研究[J].中国畜牧杂志,2006(13):9-11.
[11]Lovekamp T N,Davis B J.Mono-(2-ethylhexyl)phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells[J].Toxicol Appl Pharmacol,2001,172(3):217-224.
[12]Santini S E,Basini G,Bussolati S.The Phytoestrogen Quercetin Impairs Steroidogenesis and Angiogenesis in Swine Granulosa Cells In Vitro[J].Journal of Biomedicine and Biotechnology,2009,2009:1-8.
[13]Tiemann U,Schneider F,Vanselow J.In vitro exposure of porcine granulosa cells to the phytoestrogens genistein and daidzein:effects on the biosynthesis of reproductive steroid hormones[J].Reprod Toxicol,2007,24(3-4):317-325.
[14]Nynca A,Jablonska O,Slomczynska M.Effects of phytoestrogen daidzein and estradiol on steroidogenesis and expression of estrogen receptors in porcine luteinized granulosa cells from large follicles[J].J Physiol Pharmacol,2009,60(2):95-105.
[15]Simoni M,Gromoll J,Nieschlag E.The follicle-stimulating hormone receptor:biochemistry,molecular biology,physiology,and pathophysiology[J].Endocr Rev,1997,18(6):739-773.
