不同等电点沉淀法和超速离心法提取牛奶乳清蛋白的双向电泳分析
2014-01-18陈静廷卜登攀杨永新李发弟
陈静廷,卜登攀,马 露,杨永新,李发弟
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;3.中国农业科学院-世界农用林业中心,农用林业与可持续畜牧业联合实验室,北京 100193;4.东北农业大学 食品安全与营养协同创新中心,黑龙江 哈尔滨 150030)
不同等电点沉淀法和超速离心法提取牛奶乳清蛋白的双向电泳分析
陈静廷1,2,卜登攀1,3,4,*,马 露1,杨永新1,李发弟2
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;3.中国农业科学院-世界农用林业中心,农用林业与可持续畜牧业联合实验室,北京 100193;4.东北农业大学 食品安全与营养协同创新中心,黑龙江 哈尔滨 150030)
为探索牛奶乳清蛋白提取的最适方法,以生鲜荷斯坦牛奶为对象,采用不同等电点(pH 4.6和pH 4.8)沉淀法和超速离心法提取牛奶乳清蛋白样品,并对提取效果进行双向凝胶电泳(two-dimensional electrophoresis,2-DE)图谱分析。依据凝胶图谱上蛋白斑点比 较图谱质量,采用PDQuest 8.0凝胶图像分析软件进行凝胶图谱分析。结果显示:2 种方法均能有效提取牛奶乳清蛋白,且获得的2-DE凝胶图谱背景清晰、蛋白点个体独立、无明显的拖尾现象,且重复性强,但都存在一定的酪蛋白残留。与超速离心法相 比,pH 4.6沉淀法和pH 4.8 沉淀法提取乳清蛋白的2-DE凝胶图谱可检测到较多的蛋白质斑点。pH 4.6沉淀法提取乳清蛋白制备的2-DE凝胶图谱中蛋白点的表达丰度略高于pH 4.8沉淀法。研究 表明:pH 4.6沉淀法提取乳清蛋白制备2-DE凝胶图谱略优于pH 4.8沉淀法和超速离心法。但2 种等电点沉淀法和超 速离心法都可有效去除牛奶中的高丰度酪蛋白,提高低丰度蛋白的检出敏感性。
牛奶;乳清蛋白;等电沉淀;超速离心;提取方法;双向凝胶电泳图谱
双向凝胶电泳(two-dimensional electrophoresis,2-DE)技术以其具有高通过量、微量分析与制备等性能仍是目前蛋白质组学研究中的核心技术之一[1-3]。分离获得全面、高分辨率的蛋白图谱是提 高2-DE蛋白质组学研究信息完整性的重要步骤。其中蛋白质样品的制备是2-DE技术中的关键步骤,是蛋白质分离与鉴定的基础[4-5]。由于蛋白质样品的多样性及2-DE操作的复杂性,需要不断的摸索以寻求不同蛋白样品2-DE的最适实验技术。
乳清蛋白是牛奶乳清中的主要成分,其功能性蛋白含量高、必需氨基酸种类齐全且生物利用效价高[6-7]。但乳清蛋白经复杂的遗传变异和丰富的翻译修饰后变得非常复杂,且与酪蛋白相比,其相对含量较低且稳定性较差[8-9]。因此,可采用蛋白质组学技术研究牛奶乳清蛋白,以从蛋白质组整体水平研究不同的生理、病理及环境因素等对乳清蛋白的影响。近年来,有关乳清蛋白质作为 奶牛乳房炎、不同泌乳阶段和不同物种间等表征性物质的蛋白质组学研究报道日益增多[10-12]。然而,由于牛奶中存在多种高丰度蛋白(如酪蛋白)以及脂类、乳糖、灰分等[13],会干扰周围低丰度蛋白的表达与鉴别[14-15],同时会降低电泳结果的重复性和分辨率。如何尽量减少或避免高丰度蛋白及其他成分对乳清蛋白表达的影响成为牛奶乳清蛋白质组学研究的关键步骤之一。
选择合适的、操作步骤简便的蛋白质样品制备方法是获得较多有效蛋白点、原有组分变化小、重复性高2-DE凝胶图谱的关键。但目前尚没有一种方法适用于各种蛋白样品的制备。用于动植物的体液、组织、细胞等蛋白质样品制备的沉淀方法多样,有丙酮沉淀法、三氟乙酸沉淀法、三氟乙酸-丙酮沉淀法、Trizol试剂沉淀法等[16],其中提取牛奶乳清蛋白样品常用且较为简便的方法主要有pH 4.6和pH 4.8 2 种不同等电点沉淀法及超速离心法[17-20]。
因此,本实验采用不同等电点沉淀酪蛋白(pH 4.6和pH 4.8)和超速离心2 种常用方法对牛奶中乳清蛋白进行提取,并对其2-DE凝胶图谱效果进行分析,拟对不同牛奶乳清蛋白常用提取方法的提取效果进行比较分析,以期为今后乳清蛋白质组学的研究提供简便、有效的技 术手段。
1 材料与方法
1.1 材料与试剂
样品采集于北京市周边牧场,奶牛采用全混合日粮方式饲喂,每天饲喂2 次,自由饮水,早晚挤奶2 次。奶样为采自于4 ℃奶罐中的健康奶牛的混合乳样,冷藏带回实验室,立即进行乳清蛋白样品提取处理。
17 cm固相非线性IPG预制胶条(pH 4~7)、IPG Buffer pH 3~10 美国Bio-Rad公司;3-3-胆酰胺丙基-二甲氨基-1-丙磺酸(3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate,CHAPS)和矿物油、甘油、尿素、二硫苏糖醇(dithiothreitol,DTT)、甲叉双丙烯酰胺、丙烯酰胺、甘氨酸、考马斯亮蓝G-250、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵(ammonium persulfate,AP)和低熔点琼脂糖 美国Amresco公司;碘乙酰胺 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TEAN IEF Cell等电聚焦系统、PROTEAN®ⅡXi Cell、光密度扫描仪GS-800 Calibrated Densitometer、PDQuest 8.0凝胶图像分析软件 美国Bio-Rad公司;高速低温冷冻离心机 美国Sigma公司;超速离心机日本Hitachi公司;酶标仪 瑞士Tecan公司;pH酸度计 德国Sartorius公司;Milli-Q超纯水系统 美国MilliPore公司;P0012BCA蛋白浓度测定试剂盒 碧云天生物技术研究所。
1.3 方法
1.3.1 乳清蛋白样品的制备
为尽量减少样品蛋白的损失和修饰,同时提高2-DE凝胶图谱的重复性,采用以简单为原则的乳清蛋白样品制备方法。选用2 种较常用、较简单的乳清蛋白提取方法。
2 种提取方法均先将鲜牛奶于3 000×g、4 ℃、离心15 min,弃去上层脂肪,制得脱脂牛奶。
不同等电点法是分别用1 mol/L盐酸调脱脂牛奶pH值至4.6与4.8,调节pH值过程中不断搅拌,之后于5 000×g、4 ℃、离心20 min。分别收集pH值至4.6与4.8处理后脱脂牛奶上清液,即为不同等电点(pH 4.6和pH 4.8)沉淀酪蛋白后的乳清蛋白样品。
超速离心法即将脱脂牛奶于100 000×g、4 ℃、离心1 h,弃去上层脂肪后吸取上清液,即为超速离心所得乳清蛋白样品。
1.3.2 蛋白质含量测定
提取乳清蛋白后,直接采用BCA蛋白浓度测定试剂盒进行测定。以质量分数0.9% NaCl为空白,1.0 mg/mL的牛血清白蛋白标准蛋白为标准,参照试剂盒说明书,在酶标仪上测A560nm值,用于获得不同方法制备的牛奶乳清蛋白的含量。分装乳清蛋白,于-80 ℃保存备用。
1.3.3 2-DE分析
室温溶解保存的乳清蛋白样品。取上样量为250 μg的乳清蛋白样品与终体积300 μL的水化上样缓冲液(8 mol/L尿素、质量分数4% CHAPS、65 mmol/L DTT及质量分数0.5% IPG缓冲液和痕量溴酚蓝)涡旋混匀,加入等电聚焦盘的聚焦槽内。提前取出固相化pH值梯度IPG预制胶条(17 cm,pH 4~7),室温放置10 min,弃去保护膜、对应正负极后使胶条覆盖于聚焦槽的样品上并与电极紧密接触。确保无气泡后置于胶条上覆盖3 mL矿物油。最后将等电聚焦盘置于等电聚焦电泳仪内进行第一向等电聚焦。聚焦环境为20 ℃,程序如表1所示。

表1 等电聚焦程序与参数设置Table1 Isoelectric focusing procedures and parameters
等电聚焦结束后进行第二向十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),分离胶为质量分数12%。依次用胶条平衡缓冲母液Ⅰ(6 mol/L尿素、质量分数2% SDS、1.5 mol/L pH 8.8的Tris-HCl、质量分数20%甘油和质量分数2% DTT)和胶条平衡缓冲母液Ⅱ(6 mol/L尿素、质量分数2% SDS、1.5 mol/L pH 8.8的Tris-HCl、质量分数20%甘油和2.5%碘乙酰胺)对等电聚焦后的胶条进行平衡处理,平衡时间分别为12 min,之后将胶条置于分离胶上方,用低熔点琼脂糖封胶进行固定,确保胶条底部与分离胶之间无气泡存在。待封胶凝固后,将凝胶置于电泳槽内进行第二向电泳,程序为:12 ℃循环水浴,50 V电泳30 min,200 V电泳至溴酚蓝指示剂到达凝胶底部边缘时即可停止电泳。取出凝胶,切角标记,随后进行固定、染色,最后脱色至背景清晰。
1.3.4 图像分析
用光密度扫描仪GS-800 Calibrated Densitometer对2-DE凝胶进行扫描,光学分辨率为600 dpi。采用Quentity One v4.62和PDQuest 8.0凝胶图像软件进行2-DE图谱分析。使用SAS 9.2和Excel软件进行统计分析。
2 结果与分析
2.1 蛋白质定量
根据测定样品的OD值于标准曲线中得出相应的蛋白质质量浓度。pH 4.6提取法获得样品的蛋白质质量浓度为(11.36±1.1)μg/μL,pH 4.8提取法制备的样品蛋白质质量浓度为(11.78±1.5)μg/μL,超速离心法提取的样品质量浓度为(12.88±1.5)μg/μL。
2.2 2-DE凝胶图谱分析
2.2.1 2-DE凝胶图谱中蛋白质点数量
为进一步分析不同乳清蛋白提取 方法的 差异,实验将不同方法提取的牛奶乳清蛋白样品按2-DE的操作程序分别重复操作3 次,以获得蛋白质双向电泳图谱(图2)。由图2可知,3 种方法均有效提取出牛奶中的乳清蛋白,大部分酪蛋白得以去除。利用PDQuest 8.0凝胶图像分析软件进行凝胶位点检测及统计分析,pH 4.6提取法获得的2-DE凝胶中分离得到的蛋白质点数为124 个,匹配率为97%;pH 4.8提取法获得的2-DE凝胶中蛋白点数为12 7 个,匹配率为100%;超速离心法获得的蛋白点数为82 个,匹配率为100%。pH 4.6与pH 4.8提取乳清蛋白获得的总蛋白点数目较为接近,均多于超速离心获得的总蛋白点数目。
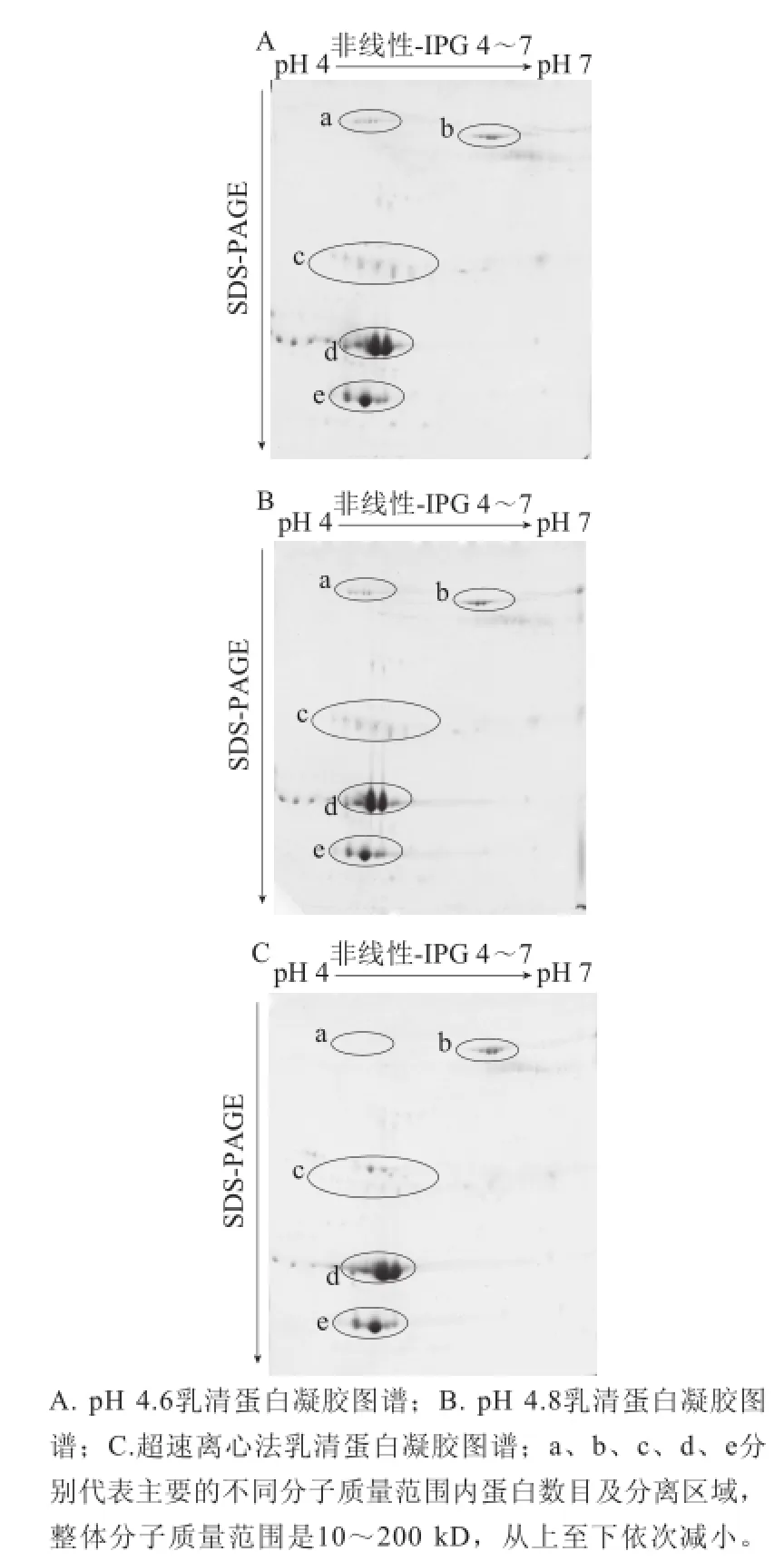
图2 不同提取方法制备的乳清蛋白的2-DE图谱Fig.2 2-DE maps of whey protein extracted by different methods
2.2.2 2-DE凝胶图谱中蛋白质点分布
3 种方法提取的乳清蛋白制备的2-DE凝胶图谱中乳清蛋白在pI 4~7范围得到较为完整的体现,蛋白质分子质量在10~200 kD范围,蛋白质斑点个体独立、形态清晰、点数多且没有明显的横竖条纹。不同方法制备的凝胶图谱中均存在一定的残留酪蛋白(图2c区);pH 4.6提取法制备的凝胶中主要蛋白点的染色密度略高于其他2 种方法(图2b、d、e区、图3);与超速离心法相比,pH 4.6提取法与pH 4.8提取法凝胶图谱中蛋白质位点分布较为接近,而pH 4.8提取法较pH 4.6提取法凝胶中蛋白点略有纵向拖尾现象(图2Bd区);2 种等电点沉淀提取方法凝胶图谱中高分子质量区域乳清蛋白质斑点分离较多(图2Aa、Ba区)。由此可见,3 种方法制备的乳清蛋白样品的2-DE图谱中蛋白斑点分布基本相同,乳清蛋白点均较为全面地 体现。结合图谱中蛋白质斑点的独立性、背景清晰度、杂蛋白量及蛋白点染色密度等综合考虑,得出采用pH 4.6提取法制备的乳清蛋白样品获得的2-DE图谱整体效果略优于pH 4.8提取法与超速离心法。
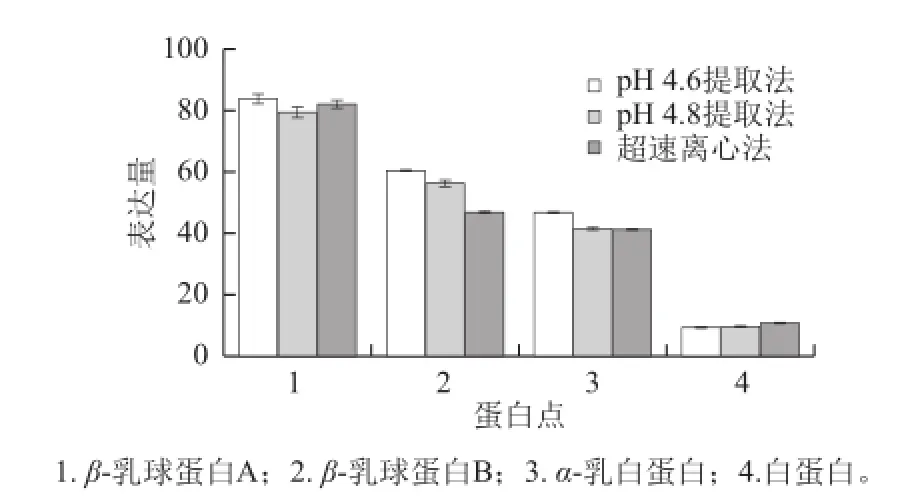
图3 不同提取方法制备的乳清蛋白的2-DE图谱中主要蛋白点的表达量Fig.3 Expressional changes of major whey proteins in 2-DE maps obtained by different methods
3 讨论与结论
蛋白质是两性化合物,当调节牛奶的pH值达到酪蛋白的等电点时,蛋白质所带正、负电荷相等,呈电中性。此时酪蛋白的溶解度最小,酪蛋白及其夹杂物就会从牛奶中沉淀出来,上清液中所含蛋白即为乳清蛋白[21]。因此,常采用等电点沉淀法从牛奶中分离酪蛋白。然而有关酪蛋白等电点的报道不一,一般处于pH 4.6~4.8。邵锦震等[22]研究不同温度和不同pH值条件下牛奶酪蛋白产率,发现利用等电点沉淀分离酪蛋白的最适温度为55 ℃,最适pH值为4.8,与原龙等[23]报道的酪蛋白分离的最佳pH值为4.8的结果一致。然而,王秀娟等[24]采用等电点沉淀法来提取牛奶中的主要过敏原酪蛋白组分,通过SDS-PAGE检测发现,酪蛋白分离最佳条件为:pH 4.6、温度55 ℃。然而,本研究通过分析2-DE凝胶图谱发现,pH 4.6与pH 4.8 2 种不同等电点沉淀方法均能较好地 沉淀酪蛋白获得较为全面的乳 清蛋白信息,且2 种等电点沉淀方法制备的乳清蛋白凝胶图谱结果较为相似、差异较小。
超速离心技术是生物化学、分子生物学中分离、提纯、鉴别生物大分子物质的重要研究手段,广泛的应用于细胞器、病毒、核酸、蛋白质等生物样品的分离提纯[15]。与其他分离技术如电泳技术结合,可用于蛋白质的定性或定量分析。杨永新等[25]研究指出,采用超速离心方法纯化乳腺组织蛋白质样品,可获得相对较多的蛋白质斑点2-DE凝胶图谱,且该方法能够尽可能地除去多糖、脂类等物质的干扰,最大限度地保持组织蛋白质成分,是一种高效的蛋白质样品制备方法。Jiang等[26]报道,三氯乙酸-丙酮沉淀法和超速离心技术均可以有效地用于血清蛋白样品的提取,并除去样品中的盐类等干扰物质,获得较好的凝胶图谱样品。本实验研究结果表明,超速离心法提取牛奶乳清蛋白的2-DE图谱背景清晰、蛋白斑点独立、高丰度蛋白残留量较少,用于牛奶乳清蛋白的分离提取效果较好,但获得的蛋白点数略少于等电点沉淀法。Rood等[27]采用纳米膜超滤法、超速离心法和超速离心结合凝胶排阻法制备肾病患者尿蛋白样品,经MALDITOF-TOF质谱检测结果表明,相对于单独采用纳米膜超滤法、超速离心法制备的尿蛋白样品,超速离心结合凝胶排阻法制备的蛋白样品中能检测到更多的低丰度标志蛋白。Thongboonkerd等[28]研究表明,丙酮沉淀法获得的健康人尿蛋白质样品凝胶图 谱中存在较多的酸性、亲水性蛋白,而超速离心法制备的蛋白样品凝胶中碱性、疏水性和膜蛋白含量较多。上述研究结果表明,超速离心法用于不同蛋白样品的提取效果不一。在蛋白样品制备时应根据样品自身特点和研究目的来进行提取方法的选择与优化。
本研究在比较分析前人研究方法的技术上,选取2 种不同的牛奶乳清蛋白的提取方法进行研究。对牛奶乳清蛋白2-DE图谱效果进行比较分析。结果表明,2 种方法均可有效提取牛奶乳清蛋白。结合牛奶乳清蛋白组2-DE图谱清晰度、蛋白质得率和蛋白质斑点分离效果等方面综合考虑,发现pH 4.6等电点沉淀提取法略优于pH 4.8等电点沉淀提取法和超速离心法,更适用于乳清蛋白组2-DE凝胶电泳过程中蛋白样品的制备。
[1] PENQU D. Two-dimensional gel electrophoresis and mass spectrometry for biomarker discovery[J]. Proteomics-Clinical Applications, 2009, 3: 155-172.
[2] RABILLOUD T, LELONG C. Two-dimensional gel electrophoresis in proteomics: a tutorial[J]. Journal of Proteomics, 2011, 74(10): 1829-1841.
[3] RABILLOUD T, CHEVALLET M, LUCHE S, et al. Two-dimensional gel electrophoresis in proteomics: past, present and future[J]. Journal of Proteomics, 2010, 73(11): 2064-2077.
[4] CARPENTIER S C, WITTERS E, LAUKENS K. Preparation of protein extracts from recalcitrant plant tissues: an evaluation of different methods for two-dimensional gel electrophoresis analysis[J].Proteomics, 2005, 5(10): 2497-2507.
[5] SARAVANAN R S, ROSE J K C. A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues[J]. Proteomics, 2004, 4: 2522-2532.
[6] PESIC M B, BARAC M B, VRVIC M M, et al. The distributions of major whey proteins in acid whey sobtained from caprine/bovine and ovine/bovine milk mixtures[J]. International Dairy Journal, 2011, 21: 831-838.
[7] TAVARS T G, MALCATA F X. Whey proteins as source of bioactive peptides against hypertension[M]. Chapter 4. Bioactive Food Peptides in Health and Disease, 2013: 75-114.
[8] CHEVALIER F, HIRTZ C, SOMMERERR N, et al. Use of reducing/ nonreducing two-dimensional electrophoresis for the study of disulfide-mediated interactions between proteins in raw and heated bovine milk[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 5948-5955.
[9] LIVNEy y D. Milk proteins as vehicles for bioactives[J]. Current Opinion in Colloid & Interface Science, 2010, 15: 73-83.
[10] ALONSO-FAUSTE I, ANDRES M, ITURRALDE M, et al. Proteomic characterization by 2-DE in bovine serum and whey from healthy and mastitis affected farm animals[J]. Journal of Proteomics, 2012, 75: 3015-3030.
[11] SENDA A, FUKUDA K, ISHII T, et al. Changes in the bovine whey proteome during the early lactation period[J]. Animal Science Journal, 2011, 82: 698-706.
[12] yANG yongxin, BU Dengpan, ZHAO Xiaowei, et al. Proteomic analysis of cow, yak, buffalo, goat and camel milk whey proteins: quantitative differential expression patterns[J]. Journal of Proteome Research, 2013, 12: 1660-1667.
[13] 边艳杰, 李庆章, 张岚, 等. 用于双向凝胶电泳分析的奶牛乳清蛋白样品制备方法的比较[J]. 中国生物化学与分子生物学报, 2011, 27(5): 486-492.
[14] 赵东, 邢秀梅, 杨福合. 梅花鹿鹿茸总蛋白提取方法对双向电泳图谱的影响[J]. 中国畜牧兽医, 2012, 39(7): 25-28.
[15] 王宝杰, 刘梅, 蒋克勇, 等. 中国明对虾血浆蛋白质组学研究中高丰度蛋白的超速离心去除技术[J]. 中国水产科学, 2010, 17(4): 695-700.
[16] 谈旭翡, 陈智. 蛋白质组学研究中双向电泳的样品制备[J]. 医学分子生物学杂志, 2008, 5(5): 462-465.
[17] HAN Rongxun, KIM H R, DIAO yunfei, et al. Detection of early pregnancy-specifi c proteins in Holstein milk[J]. Journal of Proteomics, 2012, 75: 3221-3229.
[18] OLLIKAINEN P. Activation of transforming growth factor-β 2 in bovine milk during indirect heat treatments[J]. International Dairy Journal, 2011, 21: 921-925.
[19] 沈维军, 杨永新, 王加启, 等. 高体细胞数低乳糖含量时牛乳清蛋白组分变化的研究[J]. 畜牧兽医学报, 2012, 43(5): 755-760.
[20] FONG B y, NORRIS C S, PALMANO K P, et al. Fractionation of bovine whey proteins and characterisation by proteomic techniques[J]. International Dairy Journal, 2008, 118: 23-46.
[21] PELEGRINE D H G, GOMES M. Analysis of whey proteins solubility at high temperatures[J]. International Journal of Food Engineering, 2012, 8(3): 1-8.
[22] 邵锦震, 易理清. 等电沉淀分离酪蛋白方法的探讨[J]. 湖北师范学院学报: 自然科学版, 2004, 24(1): 19-22.
[23] 原龙, 王新, 尤艳蓉. 牛奶中酪蛋白和乳糖的分离方法研究[J]. 应用化工, 2009, 38(3): 389-394.
[24] 王秀娟, 郑磊, 詹冬玲. 牛乳中主要过敏原组分的分离纯化[J]. 粮油加工, 2010(7): 148-151.
[25] 杨永新, 陶金忠, 张勇, 等. 奶牛乳腺组织蛋白质样品的制备及2-DE图谱分析[J]. 畜牧兽医学报, 2007, 38(8): 846-850.
[26] JIANG L, HE L, FOUNTOULAKIS M. Comparison of protein precipitation methods for sample preparation prior to proteomic analysis[J]. Journal of Chromatography A, 2004, 1023: 317-320.
[27] ROOD I M, DEEGENS J K J, MERCHANT M L, et al. Comparison of three methods for isolation of urinary microvesicles to identify biomarkers of nephrotic syndrome[J]. Kidney International, 2010, 78: 810-816.
[28] THONGBOONKERD V, MCLEISH K R, ARTHUR J M, et al. Proteomic analysis of normal human urinary proteins isolated by acetone precipitation or ult racent rifugation[J]. Kidney International, 2002, 62(4): 1461-1469.
2-DE Analysis of Whey Protein Extracted by Different Isoelectric Precipitations and Ultracentrifugation Methods from Cow Milk
CHEN Jing-ting1,2, BU Deng-pan1,3,4,*, MA Lu1, YANG Yong-xin1, LI Fa-di2
(1. State Key Laboratory of Animal Nutrition, Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China; 3. CAAS-ICRAF Joint Laboratory on Agroforestry and Sustainable Animal Husbandry, Beijing 100193, China; 4. Synergetic Innovation Center of Food Safety and Nutrit ion, Northeast Agricultural University, Harbin 150030, China)
The objective of this study was to investigate the effect of extraction methods on two-dimensional electrophoresis (2-DE) maps of whey proteome in cow milk and to explore an optimal extraction method. Samples were extracted from cow milk by different isoelectric precipitations and ultracentrifugation methods. 2-DE maps were analyzed by PDQuest 8.0 software. The results of 2-DE maps showed that milk whey protein could be effectively extracted by the above methods with less background, no signifi cant strips and good repeatability. However, there were still some residual caseins appearing in each map. 2-DE maps of wh ey protein refi ned by isoelectric precipitations were relatively informative when compared with the gel maps obtained by ultracentrifugation. Moreover, the ri chness of different whey proteins in vari ous maps extracted by adjusting pH to 4.6 as isoelectric point was slightly higher than adjusting pH to 4.8. The results indicated that adjusting pH to 4.6 as isoelectric point to extract whey protein had some advantages than adjusting pH to 4.8 and ultracentrifugation. However, all the methods used in this study could effectively remove high abundant casein to improve the detection sensitivity of low abundance proteins.
cow milk; whey protein; isoelectric precipitation; ultracentrifugation; extraction methods; two-dimensional electrophoresis map
S823
A
1002-6630(2014)20-0180-05
10.7506/spkx1002-6630-201420036
2014-01-23
中国农业科学院科技创新工程项目(cxgc-ias-07);“十二五”国家科技支撑计划项目(2012BAD12B02-5);动物营养学国家重点实验室自主研究课题(2004DA125184G1103)
陈静廷(1987—)女,硕士研究生,研究方向为反刍动物营养。E-mail:chenjingting911@163.com
*通信作者:卜登攀(1975—)男,副研究员,博士,研究方向为反刍动物营养与牛奶品质改良。E-mail:burdenpan@gmail.com
