超高效液相色谱法测定芒果中啶酰菌胺和吡唑醚菌酯
2014-01-18汤永娇袁宏球吕岱竹
汤永娇,袁宏球,朱 珠,吕岱竹,*
(1.华中农业大学植物科学技术学院,湖北 武汉 430070; 2.中国热带农业科学院分析测试中心,海南 海口 570100)
超高效液相色谱法测定芒果中啶酰菌胺和吡唑醚菌酯
汤永娇1,2,袁宏球2,朱 珠2,吕岱竹2,*
(1.华中农业大学植物科学技术学院,湖北 武汉 430070; 2.中国热带农业科学院分析测试中心,海南 海口 570100)
建立芒果中杀菌剂啶酰菌胺和吡唑醚菌酯残留检测的超高效液相色谱方法。芒果样品经乙腈提取,氨基(NH2)固相萃取柱净化,以乙腈和水为流动相梯度洗脱,采用双波长紫外检测器检测,外标法定量。结果表明:啶酰菌胺和吡唑醚菌酯含量分别在0.10~4.00 μg/mL和0.02~1.00 μg/mL质量浓度范围内与色谱峰面积呈现良好的线性关系,决定系数R2均大于0.999,方法的检出限均为0.002 mg/kg,分别从3 个不同添加水平检测结果可以看出,方法的回收率在76.00%~103.00%之间,相对标准偏差为1.07%~13.28%。
超高效液相色谱;芒果;啶酰菌胺;吡唑醚菌酯
芒果(Mangifera indica Linn.)为漆树科(Anacardiaceae)芒果属(Mangifera)热带常绿大乔木,其果实营养丰富,口感细腻,素有“热带果王”之称。芒果性喜湿热,在我国广西、广东、海南、福建等地区种植广泛。与此同时,热带地区高温高湿的气候特点使得真菌病害在农作物上常有发生,其危害程度较温带地区严重的多。为控制病情,杀菌剂的过量使用就会造成一定的食品安全问题。芒果的炭疽病与黑斑病发病较为普遍[1-2],且芒果尚没有较好的抗病品种,因此,杀菌剂在芒果上的使用非常普遍。
啶酰菌胺能够通过抑制琥珀酸基质的氧的呼吸妨碍病原菌的能量代谢[3],吡唑嘧菌酯能通过与线粒体复合物中细胞色素b的辅酶Q0位点结合而阻止线粒体中的电子传递从而抑制病原菌的呼吸作用[4],二者为均为高效、广谱、内吸性的杀菌剂[5-6]。啶酰菌胺和吡唑嘧菌酯目前正广泛应用于防治芒果、香蕉的炭疽病和黑斑病。随着其大量使用必定会带来一系列的农药残留问题,所引发的食品安全问题也不容忽视。目前,国内外检测啶酰菌胺和吡唑嘧菌酯的方法有气相色谱法[7-10]、气相色谱-质谱法[11-13]、气相色谱与离子阱-质谱联用法[14]、液相色谱法[15-19]、高效液相色谱-质谱联用法[20-23]、酶联免疫法[24]等。本研究利用固相萃取净化结合超高效液相色谱(ultra performance liquid chromatography,UPLC)并采用双波长检测,建立了芒果中啶酰菌胺和吡唑醚菌酯快速准确的分析方法,为芒果的食用安全提供了一项检测技术保障。
1 材料与方法
1.1 材料与试剂
Srata NH2柱(500 mg/3 mL,NH2柱使用前使用正己烷-丙酮(6∶4,V/V)溶液6 mL活化) 美国Phenomenex公司;乙腈、正己烷、甲醇(均为色谱纯)上海Fisher Scientific公司;丙酮(色谱纯) 美国Tedia公司;氯化钠(分析纯,使用前160 ℃煅烧4 h) 广州化学试剂厂;啶酰菌胺(纯度为99.5%)、吡唑醚菌酯(纯度为99.6%) 德国Dr. Ehrenstorfer公司。
1.2 仪器与设备
超高效液相色谱仪(配有可变波长紫外检测器)美国Waters公司;IKAT25高速匀浆机 上海万捷科技有限公司;超纯水仪 成都超纯科技有限公司;R206旋转蒸发仪 上海申生科技有限公司。
1.3 方法
1.3.1 UPLC测定条件
色谱柱:BEH C18柱(2.1 mm×100 mm,1.7 μm);梯度洗脱:流量0.25 mL/min;波长:啶酰菌胺227 nm(1.0~7.0 min), 吡唑嘧菌酯278 nm(7.0~11.0 min);进样量0.5 μL。
1.3.2 样品前处理
提取:称取芒果样品20 g于高脚烧杯中,加入40 mL乙腈,高速匀质2 min后用滤纸过滤,收集于装有5~7 g氯化钠的100 mL具塞量筒中,剧烈振荡2 min后,室温静置20 min,待乙腈相和水相分层[25]。
净化:移取上层乙腈相10 mL转入50 mL圆底烧瓶中,40℃水浴旋转蒸发至干。用6 mL 正己烷-丙酮(6∶4,V/V)溶液活化NH2柱,将待净化的样品用2 mL正己烷-丙酮(6∶4,V/V)溶液溶解后上样,再分别用3 mL正己烷-丙酮(6∶4,V/V)溶液淋洗圆底烧瓶3次。收集洗脱液于圆底烧瓶中,40 ℃旋转蒸发干,甲醇定容至5 mL,过0.22 μm微孔滤膜,进UPLC测定。
1.3.3 标准曲线及检出限
啶酰菌胺和吡唑醚菌酯标准曲线的配制:准确称取两种农药的标准品各0.01 g,置于不同的10 mL容量瓶中,分别用甲醇溶解并稀释定容至刻度,配制成质量浓度为1 mg/mL的标准储备液。根据啶酰菌胺和吡唑醚菌酯的最大残留限量分别移取标准储备液适量,配制成啶酰菌胺4.00、2.00、1.00、0.50、0.10 μg/mL和吡唑醚菌酯1.00、0.50、0.10、0.05、0.02 μg/mL的系列混合标准溶液。所有样品进样前均经过0.22 μm微孔滤膜过滤。在1.3.1节色谱条件下测定,以进样质量浓度为横坐标,以峰面积为纵坐标,进行线性回归计算,得到两种农药的线性方程和相关系数。以3倍信噪比对应的样品质量浓度作为方法的检出限。
1.3.4 方法回收率及精密度实验
采用空白芒果样品进行加标回收实验来确定方法的准确度和精密度,分别添加相当于0.50、2.00、4.00 mg/kg水平的啶酰菌胺及0.02、0.05、0.50 mg/kg水平的吡唑醚菌酯混合标准溶液,按照1.3.2节进行样品的前处理及色谱测定,计算样品的回收率。每个添加水平连续重复6 次,测得各组的峰面积,计算其相对标准偏差(relative standard deviation,RSD)。
2 结果与分析
2.1 提取方法的选择
要获得较高的回收率必须选取恰当的提取溶剂。本实验根据啶酰菌胺和吡唑醚菌酯在有机溶剂中的溶解度分别选用乙腈、二氯甲烷、丙酮和乙酸乙酯作为提取溶剂进行比较。在芒果样品中同时添加啶酰菌胺和吡唑醚菌酯后分别采用4 种溶剂进行提取。从表1可以看出,乙酸乙酯对啶酰菌胺回收率过高,对吡唑醚菌酯回收率较低,且偏差较大。丙酮对二者的回收率都较高,但因其对各种杂质的溶解度均较高,为避免出现干扰,不选择丙酮作为提取溶剂。二氯甲烷和乙腈比较,回收率较低,但杂质干扰很少,可以考虑不进行净化直接进样而节省操作步骤和时间。

表1 啶酰菌胺、吡唑醚菌酯在不同提取溶剂中的测定结果Table1 Effect of extraction solvents on determination of boscalid and pyraclostrobin
为进一步验证,采用不同体积的二氯甲烷进行提取。在匀浆过程中发现二氯甲烷易挥发,损失较多,基质不宜分散,提取体积小不容易过滤,造成浓缩回收偏大。考虑到样品检测需充分匀浆,选择采用乙腈提取。若用二氯甲烷提取,则可以考虑使用超声辅助提取。
2.2 净化条件的选择
对啶酰菌胺和吡唑嘧菌酯的性质分析后采用4 种方案进行净化比较,通过对比(图 1),可以看出C18柱(甲醇-水)对吡唑醚菌酯的回收率达不到要求,C18柱(乙腈-水)、C-NH2柱(甲苯-乙腈)、NH2柱(正己烷-丙酮)回收率均在88%~106%之间。考虑到C-NH2柱(甲苯-乙腈)淋洗液中含有甲苯,毒性较大,不选择此方案。NH2柱(正己烷-丙酮)与C18柱(乙腈-水)比较,净化效果好,杂质少(图2、3)。因此采用NH2柱,正己烷-丙酮为淋洗液。经过多次检测,均能将大部分杂质去掉,达到良好的净化效果。
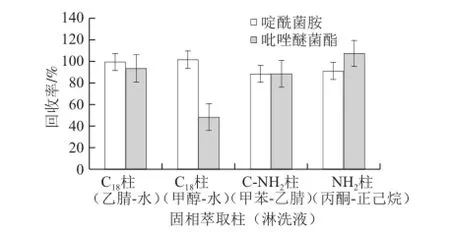
图1 不同萃取柱(淋洗液)对回收率的影响(n=5)Fig.1 Effect of SPE columns (eluents) on recovery rate (n = 5)
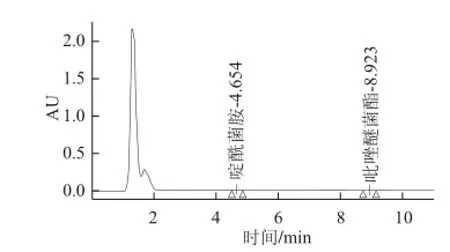
图2 C2C1818柱(乙腈-水)净化效果图Fig.2 Purification efficiency of C18SPE column (acetonitrile-water)
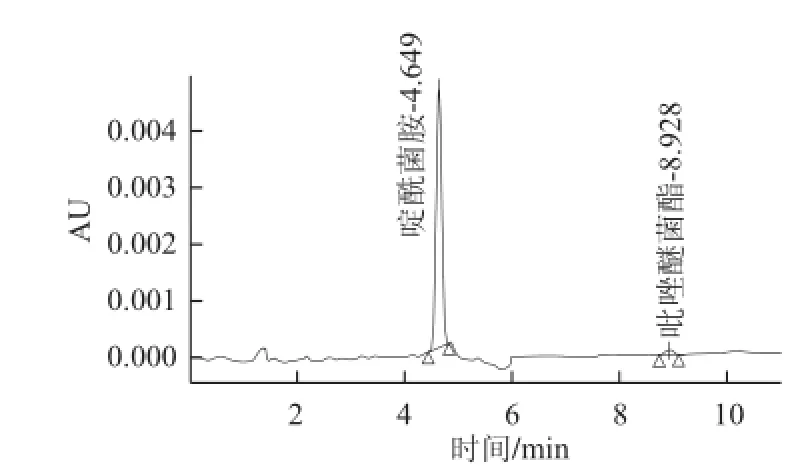
图3 NH3NH2柱(正己烷-丙酮)净化效果图Fig.3 Purification efficiency of NH2SPE column (n-hexane-acetone)
在随后的加标回收实验中发现随着样品中添加啶酰菌胺和吡唑嘧菌酯的浓度增大,回收率有降低的趋势。原因 可能为淋洗液中丙酮比例过小,极性太低不能将小柱上的啶酰菌胺和吡唑醚菌酯洗脱下来。在相当于啶酰菌胺4.00 mg/kg,吡唑醚菌酯0.50 mg/kg的添加量下,对淋洗液中正己烷和丙酮的比例做了优化,结果如图4所示。当正己烷-丙酮(6∶4,V/V)时,效果最好,啶酰菌胺和吡唑嘧菌酯的平均回收率分别为94.70%、97.07%。

图4 淋洗液比例对回收率的影响(n=5)Fig.4 Effect of eluent composition on rec overy rate (n = 5)
2.3 色谱条件的选择
采用等度洗脱,结果如图5所示,啶酰菌胺和吡唑醚菌酯虽能够完全分离,但保留时间较短,为避免之后基质带来干扰,遂采用梯度洗脱。
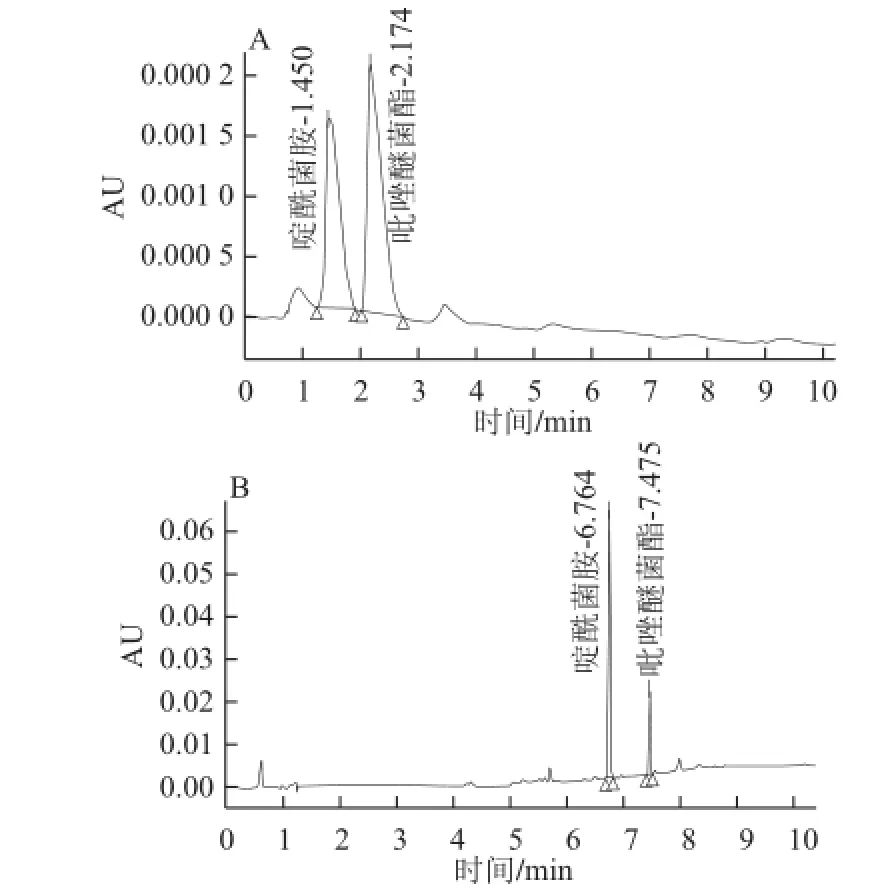
图5 等度(A)和梯度(B)洗脱图谱Fig.5 Isocratic (A) and gradient (B) elution spectrum
经紫外光谱检测,啶酰菌胺和吡唑嘧菌酯的最大吸收波长分别是227 nm和278 nm,因二者吸收波长差别较大,为保证啶酰菌胺和吡唑醚菌酯均有良好地响应,达到最高灵敏度,采用分段波长,即1~7 min内波长为227 nm,7~11 min内波长为278 nm。
2.4 线性相关性
移取一定量的啶酰菌胺和吡唑醚菌酯标准标准储备,配制成质量浓度为0.10、0.50、1.00、2.00、4.00 μg/mL和0.02、0.05、0.10、0.50、1.00 μg/mL的系列混合标准溶液,按照1.3.1节色谱条件进行检测。以峰面积(y)对相应的质量浓度(x)绘制标准曲线。进样量为1.0 μL,标准溶液谱图见图6。
外标法定量分析结果表明,在线性范围内,啶酰菌胺和吡唑醚菌酯标准溶液峰面积(y)与进样质量浓度(x)之间呈良好的线性关系。以3 倍信噪比对应的样品质量浓度作为方法的检出限,结果见表2。
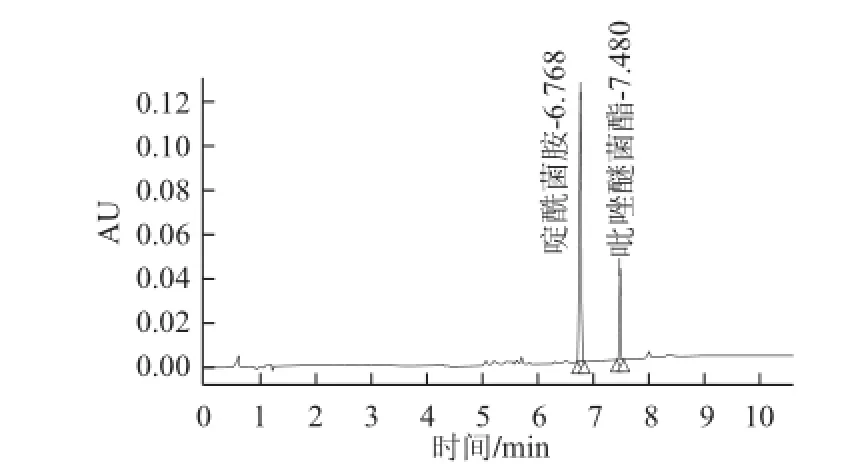
图6 啶酰菌胺(4.0000 μg/mL)和吡唑醚菌酯(11..0000 μgg//mmLL)标准品色谱图Fig.6 Chromatogram of boscalid (4.00 μg/mL) and pyraclostrobin (1.00 μg/mL) standard

表2 啶酰菌胺和吡唑醚菌酯的线性回归方程及检出限Table2 Calibration curves, liner ranges and detection limits for bosocalid and pyraclostrobin
2.5 方法的精密度和准确度
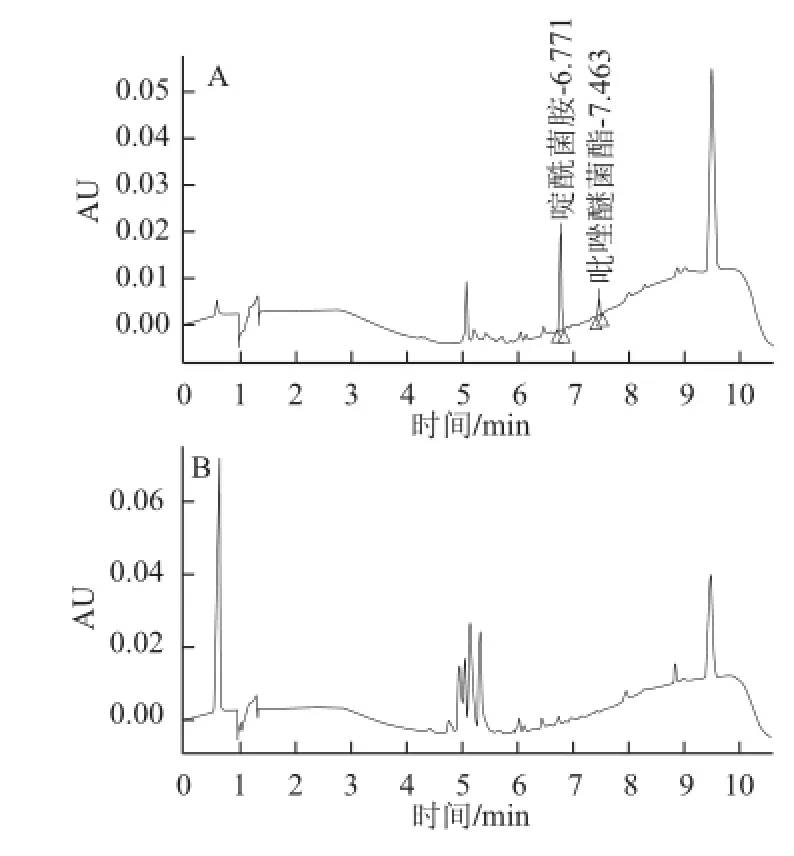
图7 芒果添加回收样品(A)与空白样品(B)色谱图Fig.7 Chromatograms of spiked mango sample (A) and blank sample (B)
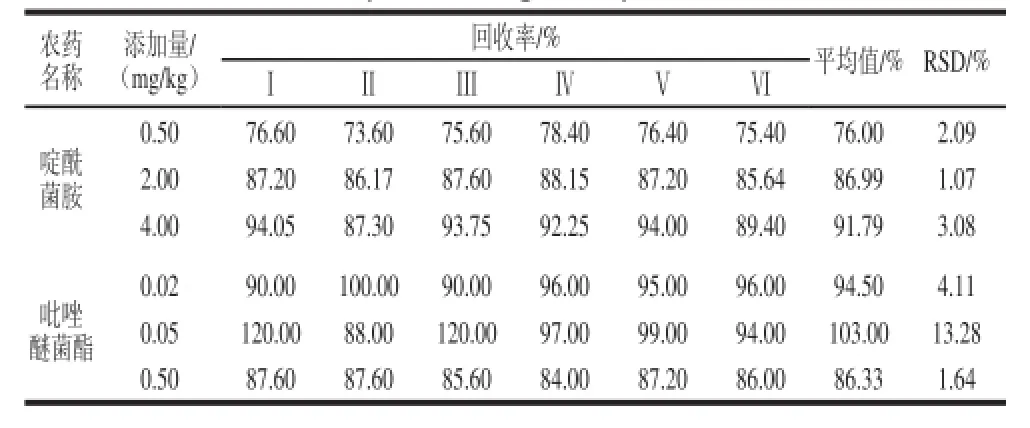
表3 啶酰菌胺和吡唑醚菌酯的加标回收率Table3 Recovery rates of bosocalid and pyraclostrobin from spiked mongo samples
在空白芒果样品中分别按照3 个水平添加啶酰菌胺和吡唑醚菌酯(空白谱图和添加标准品谱图见图7),按照1.3节中的方法进行处理和检测,每个质量浓度进行6 个平行实验,计算回收率和RSD,测得啶酰菌胺和吡唑醚菌酯的回收率范围分别在76.00%~92.00%、86.00%~103.00%之间,RSD的范围分别在1.07%~3.08%、1.64%~13.28%之间,结果见表3。
3 结 论
本实验采用双波长检测,建立了同时测定芒果样品中的啶酰菌胺和吡唑醚菌酯的超高效液相色谱方法。通过对处理条件的优化表明以正己烷-丙酮(6∶4,V/V)为洗脱液的NH2固相萃取小柱能很好的净化芒果样品。加标回收验证方法的平均回收率在76.00%~103.00%之间,重复实验的RSD小于13.28%。该方法对啶酰菌胺和吡唑醚菌酯的检出限均为0.002 mg/kg。本方法具有操作简单、分析速度快、分离度好、节省溶剂用量、线性范围宽等特点,适合大批量芒果样品中啶酰菌胺和吡唑醚菌酯残留的快速定性和定量分析。
[1] 王东方, 刘光华, 尼章光, 等. 芒果炭疽病的发病规律及防治[J]. 广东农业科学, 2008(6): 67-69.
[2] 岑忠保, 潘启城, 黄继庆, 等. 田东县芒果黑斑病的发病与防治[J].广西植保, 2012, 25(1): 24-28.
[3] 颜范勇, 刘冬青, 司马利锋, 等. 新型烟酰胺类杀菌剂: 啶酰菌胺[J].农药, 2008, 47(2): 132-135.
[4] 杨丽娟, 柏亚罗. 甲氧基丙烯酸酯类杀菌剂: 吡唑醚菌酯[J]. 现代农药, 2012, 11(4): 45-50.
[5] 张亦冰. 新颖杀菌剂吡唑醚菌酯·啶酰菌胺水分散粒剂[J]. 世界农药, 2009(10): 52-53.
[6] Health & Consumer Protection Directorate-General. Review report for the active substance pyraclostrobin[R]. European Commission, 2004.
[7] 唐俊, 汤锋, 操海群, 等. 啶酰菌胺在黄瓜和土壤中残留分析方法研究[J]. 安徽农业大学学报, 2008, 35(4): 550-554.
[8] 张玉婷, 郭永泽, 刘磊, 等. 啶酰菌胺在葡萄及土壤中的残留动态[J].农药, 2011, 50(11): 50-52.
[9] 王岩, 姚威风, 梁爽, 等. 甘蓝和土壤中吡唑醚菌酯·烯酰吗啉残留分析[J]. 农药, 2011, 50(1): 46-47.
[10] 张志恒, 李红叶, 吴珉, 等. 百菌清、腈菌唑和吡唑醚菌酯在草莓中的残留及其风险评估[J]. 农药学学报, 2009, 11(4): 449- 455.
[11] 苏建峰, 卢声宇, 陈晶, 等. 溶剂转移-气相色谱-质谱法和选择洗脱-气相色谱法测定大蒜中289 种农药多残留[J]. 色谱, 2011, 29(7): 643-655.
[12] REILLY T J, SMALLING K L, ORLANDO J L, et al. Occurrence of boscalid and other selected fungicides in surface water and groundwater in three targeted use areas in the United States[J]. Chemosphere, 2012, 89(3): 228-234.
[13] MUNITZ M S, RESNIK S L, MONTTI M I T. Method development and validation for boscalid in blueberries by solid-phase microextraction gas chromatography, and their degradation kinetics[J]. Food Chemistry, 2013, 136(3): 1399-1404.
[14] ALBERTO A, FABRIZIO D, VINCENZO L G, et al. Fate of iprovalicarb, indoxacarb, and boscalid residues in grapes and wine by GC-ITMS analysis[J]. Journal of Agricultural and Food Chemistry, 2011, 59(12): 6806-6812.
[15] 陈莉, 贾春虹, 贺敏, 等. 草莓和土壤中啶酰菌胺残留量的高效液相色谱分析[J]. 农药, 2009, 48(5): 360-364.
[16] 张志勇, 王冬兰, 刘贤进. 西瓜与土壤中吡唑醚菌酯残留的分析方法[J]. 安徽农业科学, 2010, 38(34): 19386-193878.
[17] 吴迪, 莘婧, 潘洪吉, 等. 凝胶渗透色谱-固相萃取-高效液相色谱法测定花生中的吡唑醚菌酯残留[J]. 农药学学报, 2012, 14(6): 681-684.
[18] 李瑞娟, 于建垒, 宋国春. 葡萄和土壤中吡唑醚菌酯的高效液相色谱残留分析方法[J]. 农药科学管理, 2010, 31(6): 33-36.
[19] 刘艳萍, 王思威, 孙海滨, 等. 吡唑醚菌酯在香蕉和土壤中的残留消解动态[C]//中国化工学会农药专业委员会第十五届年会论文集, 2012: 361-365.
[20] ZHANG Fengzu, WANG Lei, ZHOU Li, et al. Residue dynamics of pyraclostrobin in peanut and field soil by QuEChERS and LCMS/MS[J]. Ecotoxicology and Environmental Safety, 2012, 78(1): 16-22.
[21] YOU Xiangwei, LIU Congyun, LIU Fengmao, et al. Dissipation of pyraclostrobin and its metabolite BF-500-3 in maize under field conditions[J]. Ecotoxicology and Environmental Safety, 2012, 80(25): 2-7.
[22] LAURA L, MARÍA-TERESA M, JESÚS S, et al. Degradation intermediates and reaction pathway of pyraclostrobin with TiO2photocatalysis[J]. Applied Catalysis B: Environmental, 2012, 89(3): 285-293.
[23] 徐娟, 陈捷, 王岚, 等. QuEChERS提取与超高效液相色谱-电喷雾电离串联质谱联用法检测果蔬中的230 种农药残留[J]. 分析测试学报, 2013, 23(3): 293-301.
[24] JOSEP V M, CONSUELO A, FRANCESC A E, et al. Immunoassays for pyraclostrobin analysis in processed food products using novel monoclonal antibodies and QuEChERS-based extracts[J]. Food Control, 2013, 32(1): 42-48.
[25] 农业部. NY/T 761—2008 蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留检测方法[S]. 北京: 中国农业出版社, 2008.
Determination of Boscalid and Pyraclostrobin in Mango by Ultra Performance Liquid Chromatography
TANG Yong-jiao1,2, YUAN Hong-qiu2, ZHU Zhu2, LÜ Dai-zhu2,*
(1. College of Plant Science and Technology, Huazhong Agricultural University, Wuhan 430070, China; 2. Analysis and Testing Center, Chinese Academy of Tropical Agricultural Sciences, Haikou 570100, China)
An ultra performance liquid chromatography (UPLC) method was established for the determination of boscalid and pyraclostrobin in mango. Samples were extracted with acetonitrile, purified on NH2column, and analyzed by gradient elution using acetonitrile-water as the mobile phase. The residues were determined by dual-wavelength ultraviolet detector, and quantified by an external standard method. An excellent linearity for boscalid and pyraclostrobin was observed in the range of 0.10-4.00 μg/mL and 0.02-1.00 μg/mL with correlation coefficients higher than 0.999, respectively. The limit of detection for both pesticides was 0.002 mg/kg. The average recovery rate for the pesticides from mongo at three spiked concentrations was in the range of 76.00%-10 3.00% with relative standard deviations of 1.07%-13.28%.
ultra performance liquid chromatography (UPLC); mango; boscalid; pyraclostrobin
O657.72
A
1002-6630(2014)20-0175-05
10.7506/spkx1002-6630-201420035
2013-11-08
公益性行业(农业)科研专项(201303088-13)
汤永娇(1988—),女,硕士研究生,研究方向为农药残留与农产品质量安全。E-mail:790404271@qq.com
*通信作者:吕岱竹(1972—),女,高级工程师,本科,研究方向为食品安全。E-mail:ldz162000@126.com
