有机相纳米辣根过氧化物酶传感器法测定植物油的过氧化值
2014-01-18王丽然张媛媛李书国
王丽然,张媛媛,李书国
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
有机相纳米辣根过氧化物酶传感器法测定植物油的过氧化值
王丽然,张媛媛,李书国*
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
研究有机相CS-FC/HRP/MWCNTs酶传感器的制备及其在植物油过氧化值测定中的应用。通过循环伏安法研究了HRP感器在二氯乙烷0.1 mol/L的氯化锂溶液中对脂质过氧化物的电催化作用,该酶传感器的电极过程属于表面电化学控制过程而非蛋白质扩散控制过程;利用电镜扫描技术研究发现该酶传感器修饰膜层内部形成有利于酶电化学催化反应三维的微网格结构,所制备的酶传感器具有良好的稳定性和重复性。过氧化月桂酰在该酶传感器上的催化还原峰电流增量与其在2.5×10-6~3.0×10-5mol/L浓度范围内呈良好的线性关系,y =0.108 5x-0.354 8,R2=0.992 3,最低检测限为2.0×10-7mol/L(RSN=3)。该方法应用于实际大豆油、玉米油等样品的过氧化值测定,其结果与国家标准中碘量法的测定结果一致,而且精度和准确度高于碘量法,所需油样少,检测速度快,不受油样颜色影响,该方法可用于过氧化值的快速、准确测定。
有机相酶传感器;多壁碳纳米管;植物油;过氧化值测定
植物油含有丰富的不饱和脂肪酸,易于发生氧化变质,产生不良风味,破坏必需脂肪酸和脂溶性维生素VA、VE、VK,从而降低营养价值;氧化的油脂对机体的细胞膜、酶系统造成损害作用,从而加快机体的衰老,产生有毒物质和致癌物,严重危害着人体的健康,因此预防油脂的氧化变质对保证食品安全意义重大。过氧化值是判断油脂新鲜程度、质量等级和安全性的重要指标[1-3]。目前过氧化值的测定方法有碘量法[4-5]、紫外检测法[6]、色谱法[7-8]、过氧化物酶传感器法[9-11]等,其中碘量法是国家标准方法,该法虽然简单易行,但测定过程耗时长,所需化学试剂多,对深颜色油脂的测定滴定终点难以判断等问题[12]。
过氧化物酶传感器已广泛地应用于生物、环境、医学、工业、食品等领域的过氧化物的测定,但一般过氧化物酶电极的研究集于测定水相介质中的过氧化氢和其他水溶性过氧化物为主,而植物油及其有机过氧化物属于疏水性的物质成分,在水相电解质溶液中的溶解度比较低,所以有机相过氧化物酶传感器的研究及其在有机过氧化物分析测定的应用备受关注,有机相酶电极的独特性在于测定疏水性底物,避免微生物污染,减少或避免水相中的副反应以及热力学稳定性的提高等,为酶电极的研究与应用开辟了新的领域[13],Konash等[14]利用Eastman AQ聚合物膜包埋辣根过氧化物酶,以二茂铁为电子介体,构建有机相酶传感器,用于快速流动注射分析食用油样品中的过氧化物,酶电极作为流动探测器,氯仿作为载体,辣根过氧化物酶(horseradish peroxidase,HRP)电极与油样中的过氧化物反应迅速,检测限为2.5×10-6mol/L。Chut等[15]利用硅溶胶-凝胶法在碳糊电极表面包埋固定化HRP制备电流型HRP电极,并利用该酶电极测定有机相中的过氧化氢、过氧化月桂酰等有机过氧化物;李书国等[16]制备了Nafion/MB/HRP电极,应用于实际油样过氧化值的检测,其最低检测限为2.75×10-7mol/L。
本实验以壳聚糖(chitosan,CS)为新型固定化材料,同时利用具有大的比表面积和强的吸附能力的多壁碳纳米管(multiwalled carbon nanotubes,MWCNTs),将辣根过氧化物酶、二茂铁(ferrocene,FC)等固定在玻碳电极表面制备夹心式有机相纳米HRP传感器,优化检测条件,确定分析参数,并测定了3 种植物油样品的过氧化值。
1 材料与方法
1.1 材料与试剂
大豆油、玉米油、葵花籽油 市购;壳聚糖(脱乙酰度≥90.0%) 北京Solarbio公司;多壁碳纳米管(8~15 nm,50 μm,>95%) 北京德科岛金公司;辣根过氧化物酶(生化级)(700 U/mg) 上海雪满生物科技有限公司;过氧化月桂酰(95%) 美国Fluka公司;1,2-二氯乙烷、异丙醇、异辛烷、碘化钾、无水氯化锂、高氯酸锂、甲醇、乙腈、氯仿、丙酮、可溶性淀粉、冰乙酸、95%乙醇、硫酸、二茂铁、硫代硫酸钠、无水乙醇(均为分析纯) 天津市永大化学试剂有限公司;电极预处理所用硫酸溶液用三蒸水配制,其余溶液均用无水乙醇配制。
1.2 仪器与设备
PAR 270电化学系统(M283型恒电位仪/恒电流仪、方正电脑及操作软件M270电化学软件) 美国EG & G公司;三电极系统包括(玻碳电极为工作电极(直径为3 mm),铂丝电极为对电极,Ag/AgCl电极为参比电极,电极抛光粉(Al2O3,1.0、0.3、0.05 μm))美国CHI仪器公司;SR8001型电子分析天平 瑞士Mettler Toledo 公司;超声波清洗仪 昆山市超声仪器有限公司;Dragon MED微量移液器 大龙医疗设备(上海)有限公司;TGL-10B高速台式离心机 上海安亭科学仪器厂;SHH.W21型电热恒温水浴箱 北京长风仪器公司。
1.3 方法
1.3.1 CS-FC/HRP/MWCNTs酶传感器的制备
玻碳电极依次用1.0、0.3、0.05 μm的Al2O3粉研磨抛光,用超纯水润湿,接着进行超声清洗处理,再用超纯水和丙酮冲洗除去其表面吸附物质,使成镜面,然后在0.2 mol/L的硫酸溶液中用循环伏安法扫描处理,扫描速率为50 mV/s,电压范围为-0.5~+1.5 V,持续扫描10 min,得到稳定的循环伏安图后,用二蒸馏洗净,室温干燥后备用。
将0.1 mL 0.1 mol/L二茂铁液溶于0.9 mL活化多壁碳纳米管[17-18]的溶液中使二茂铁浓度为0.01 mol/L,用微量移液管吸取5 μL该MWCNTs-FC分散液滴涂于玻碳电极表面,室温条件下干燥后,滴涂5 μL HRP缓冲溶液(质量浓度分别为0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mg/mL)于电极表面,室温条件下干燥后,再滴涂5 μL MWCNTs+CS溶液与电极表面,室温条件下干燥,制备好的CS-FC/HRP/MWCNTs酶传感器在4 ℃条件下保存备用。
1.3.2 碘量法
参照GB/T 5538—2005《动植物油脂过氧化值测定》方法测定。
1.3.3 有机相酶传感器法
选择循环伏安法研究修饰电极对油脂中的过氧化物的催化反应及电极过程,用方波伏安法测量CS-FC/HRP/ MWCNTs酶传感器对油脂中过氧化物的催化还原电流响应,实验在(25±0.5)℃条件下进行。循环伏安图及方波伏安图在1.0~0.0 V电位范围、20 mV/s的扫描速率下记录。
1.3.4 标准加入法
过氧化月桂酰一般在测定油脂产品的过氧化值时,被用作标准品,准确称取0.398 g过氧化月桂酰标准品加入到100 mL的容量瓶,用无水乙醇溶解并稀释到刻度,其浓度为1.0×10-2mol/L,避光贮存备用;取0.5 mL的0.1 mol/L硫酸溶液和0.5 mL的1.0 mol/L的氯化锂乙醇溶液以及一定体积的过氧化月桂酰乙醇溶液使其浓度达2.0×10-5、4.0×10-5mol/L,加入适量体积的1,2-二氯乙烷到25 mL的容量瓶,使其达到70%的比例,用乙腈稀释至刻度要求。在空白样和加入标准过氧化月桂酰溶液样品中,分别记录其循环伏安图及方波伏安图,每个样品都进行3 次平行实验,计算3 次还原峰电流平均值,减去空白样时酶传感器的还原峰电流后即为过氧化月桂酰的催化还原电流值,然后利用Origin软件计算过氧化月桂酰的催化还原电流值与其浓度之间的校正曲线模型。
1.3.5 有机相HRP法测定植物油样品的过氧化值
取0.5~2.0 g的植物油样品置于25 mL的容量瓶,随后加入0.40 mL的0.1 mol/L的乙醇硫酸溶液,0.5 mL的1.0 mol/L的乙醇-氯化锂溶液和3.5 mL的1,2-二氯乙烷,然后用乙腈稀释到最终刻度。混合溶液加入到电化学池中,搅拌溶解并通氮除氧2~5 min,然后在1.0~0.0 V电位范围内,利用方波伏安法进行扫描,记录过氧化月桂酰还原峰电流值。
2 结果与分析
2.1 CS-FC/HRP/MWCNTs测定油脂过氧化值原理
利用循环伏安技术记录了玻碳电极和CS-FC/HRP/ MWCNTs酶传感器在2.0×10-5mol/L过氧化月桂酰的乙腈-1,2-二氯乙烷混合溶液(含0.1 mol/L的LiCl)中的循环伏安图以及酶电极在空白溶液中的循环伏安图如图1所示。由图1A可以看出,裸玻碳电极在扫描电位范围1.0~0.0 V内,没有任何波峰出现,说明过氧化月桂酰在既无氧化也无还原;而图1B表明,CS-FC/HRP/ MWCNTs酶传感器在空白溶液中的循环伏安图上出现了一对形状良好的氧化还原峰,是二茂铁电子对FCox/ FCred在电极表面的发生氧化还原反应,这说明二茂铁能有效地在HRP活性中心和电极表面传递电子,氧化峰与还原峰电位差ΔEp200 mV;由图1C可知,随着溶液中过氧化月桂酰的加入,CS-FC/HRP/MWCNTs酶传感器的循环伏安图中的还原峰电流显著增大,当溶液中加入2.0×10-5mol/L的过氧化月桂酰时,其还原峰电流与空白溶液时相比增加了35%,而且随着过氧化月桂酰浓度的增加,其还原峰电流会继续增大,而氧化峰电流越来越小,浓度增大到一定程度就基本消失。
电解质溶液中的过氧化月桂酰通过扩散至酶传感器的修饰膜层内,将HRP(red)氧化成为氧化态HRP(ox),而过氧化月桂酰发生还原反应,而酶膜内的二茂铁作为电子介体,在HRP活性中心与电极表面之间起到快速传递电子的作用,使氧化态的HRP(ox)快速还原,而二茂铁被氧化,氧化态二茂铁在电极表面得电子快速被还原,所以当溶液中加入过氧化月桂酰或其他过氧化物时,电极表面的氧化态二茂铁浓度增加,因此所形成的还原峰电流显著增大,而氧化峰电流下降,变为不可逆过程,同时由于二茂铁的电子传递作用及多壁碳纳米管的增加电流响应作用使得过氧化月桂酰还原反应的活化能下降,因此其还原峰电位略微正移,这说明CSFC/HRP/MWCNTs酶传感器对油脂中的过氧化物有良好的还原催化作用,其催化还原机理如下:
酶传感器内HRP的氧化还原过程:

根据HRP传感器研究资料,HRP电极对过氧化月桂酰等脂质过氧化物的还原催化机理与催化H2O2的过程基本一致,只是二者的催化反应速率和传质速率有所不同,主要与两种物质的结构、分子大小、溶解性等有关[19]。
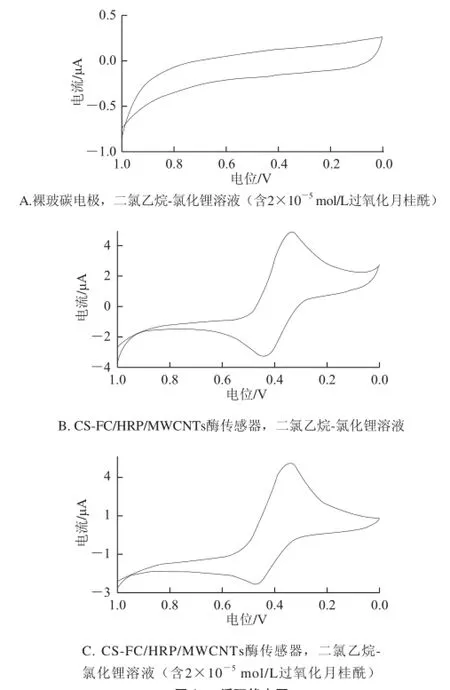
图1 循环伏安图Fig.1 Voltammograms
在上述电解质溶液中,CS-FC/HRP/MWCNTs酶传感器的氧化峰和还原峰电流响应随着电位扫描速率的增加(10、20、30、50、100、150、200 mV/s)而增加,氧化峰电流和还原峰电流与扫描速率平方根的线性关系分别为:y=0.017 3x+0.055 8及y=0.005 9x+0.059 7,线性相关系数R2分别为0.998与0.991,还原峰电流Ipred与v1/2呈线性关系,而氧化峰电流Ipox与v1/2线性关系略差,这说明HRP传感器在过氧化月桂酰溶液中的电极过程是不可逆的,HRP传感器的电化学反应属于表面电化学控制过程而非蛋白质扩散控制过程,因为HRP的氧化还原与电子介体-二茂铁在电极表面的氧化还原速率有关,而不是HRP中的电子传递到电极表面发生氧化还原反应的。
2.2 CS-FC/HRP/MWCNTs酶传感器的微观结构表征
利用扫描电镜(scanning electron microscope,SEM)对所制备的CS-FC/HRP/MWCNTs酶传感器表面微观结构进行了表征,图2为各种修饰膜在放大30万 倍条件下的扫描电镜图。图2A为裸玻碳电极上修饰一层CS薄膜的扫描电镜图。图2B为裸玻碳电极上修饰一层MW-CS薄膜的扫描电镜图,从图2B可以明显看出MWCNTs呈现特有的非常规整的多孔网状纳米纤维结构,且多壁碳纳米管的前处理使得C管末端断裂并羧基化与羟基化,有利于酶的固定。这种结构会增加酶传感器的表面积,从而使更多的酶量固定到电极表面,并且可以有效防止HRP从传感器上脱附泄漏,提高传感器灵敏度。图2C为HRP修饰到MWCNTs-CS复合膜上时的扫描电镜图。可以看出修饰膜成颗粒状,结构较疏松,HRP分子很好地嵌到了MWCNTs-CS膜的空隙当中。因此,根据电镜扫描结果可以得知,MWCNTs-CS膜用来固定酶会拥有较大的比表面积,能够固载更多HRP量,增加电极响应灵敏度,减少响应时间。

图2 不同修饰膜层的电镜扫描图Fig.2 SEM pictures of different modified membrane layers
2.3 制备生物酶传感器工艺参数优化
2.3.1 有机相溶剂及电解质对酶传感器性能的影响
有机溶剂显著影响酶的构象及功能,所以对于有机相酶传感器来说,选择适宜的有机相溶剂对保证酶的活性及催化能力、电流响应灵敏度等十分重要。本实验所研究的HRP传感器用于测定油脂中的脂质过氧化物,有机相溶剂的选择遵考虑以下4点:1) 所选有机溶剂能最大限度保证HRP的生物活性与催化功能,不会致使HRP失活;2)可对油脂样品与支持电解质有良好的溶解性;3)介电性质良好,保证电解质溶液具有良好的导电性能,降低迁移电流对分析测定的影响;4)所选有机溶剂的动力学黏度系数(η)要尽可能小,溶液中待测底物的传质阻力就小,催化反应速度就会提高,电流响应时间就会减少,HRP电极的催化电流响应也会增加。综合考虑选择1,2-二氯乙烷-乙腈作为作为有机相溶剂。
选择合适的支持电解质可增强溶液的导电性,降低有机溶剂的电阻,减小或消除电迁移电流。支持电解质需要满足以下条件:1)在所选溶剂中有足够的溶解度;2)本身不会在电极上发生氧化还原反应,不会对电极反应产生干扰,且应有较宽的电位窗口;3)价格低廉,容易购得;4)毒性和危险性较小。根据本课题组以前研究的资料,选用氯化锂作为支持电解质,氯化锂的浓度对HRP传感器的响应电流的影响如图3所示,随着氯化锂浓度的增加,HRP传感器的氧化还原峰电流显著增加,但当其浓度大于0.1 mol/L后,电流开始呈下降趋势,这可能是由于高浓度的氯化锂对HRP的活性有破坏作用,所以选择氯化锂为支持电解质,浓度为0.1 mol/L。
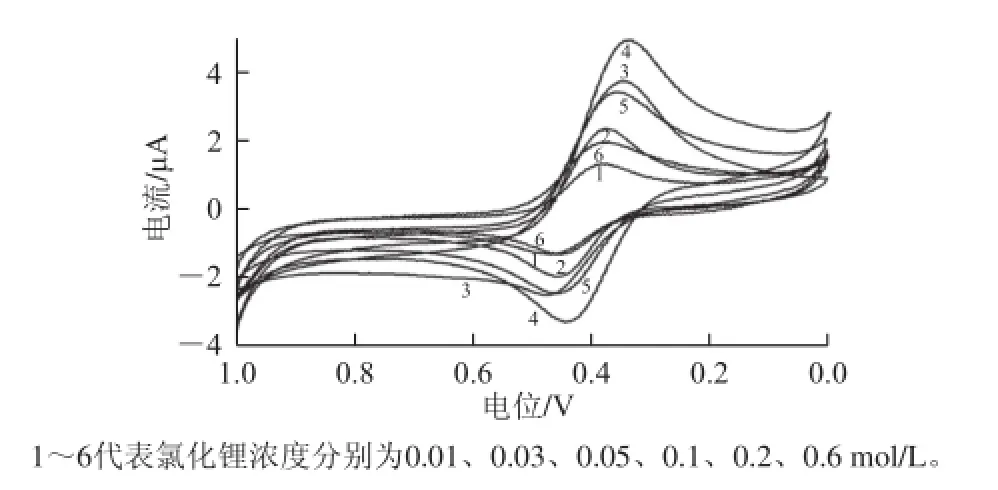
图3 支持电解质浓度对峰电流的影响Fig.3 Influence of supporting electrolyte concentration on peak current
2.3.2 HRP的固定量对酶传感器性能影响
HRP传感器的固定酶量会直接影响其对脂质过氧化物的催化还原响应电流的大小。分别配制0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mg/mL 8个质量浓度的HRP的PBS溶液,均取5 μL的HRP溶液按1.3.1节的方法制备8 支HRP传感器,然后于2×10-5mol/L过氧化月桂酰溶液中进行循环伏安扫描,记录过氧化月桂酰溶液的还原电流增量ΔIpred,并作出ΔIpred与HRP质量浓度之间的关系曲线如图4所示。由图4可知,随着HRP质量浓度的增加即HRP固定量的增加,HRP传感器对过氧化月桂酰的催化还原电流增量逐渐增加,当酶质量浓度逐渐增加到4 mg/mL时,还原电流增量达到最大,而后随着HRP质量浓度持续增加而有所下降随后基本恒定。
HRP质量浓度较低时,以“三明治”式结构包埋在壳聚糖-多壁碳纳米管膜内的HRP量较少,所以当CSFC/HRP/MWCNTs酶传感器与过氧化月桂酰作用时,没有足够的酶量用来催化过氧化月桂酰的还原,HRP电催化反应速率就较慢,所以过氧化月桂酰还原电流增量就较低;而当缓冲液中HRP质量浓度增加即HRP的固定量增加时,酶传感器对过氧化月桂酰催化反应越充分,其还原电流就越大;但当HRP质量浓度大于4.0 mg/mL时,固定到酶传感器的HRP量相对脂质过氧化物呈现过剩状态,这时其还原响应电流的基本上趋于稳定,综合考虑灵敏度和成本因素,选择4.0 mg/mL为最适HRP质量浓度。
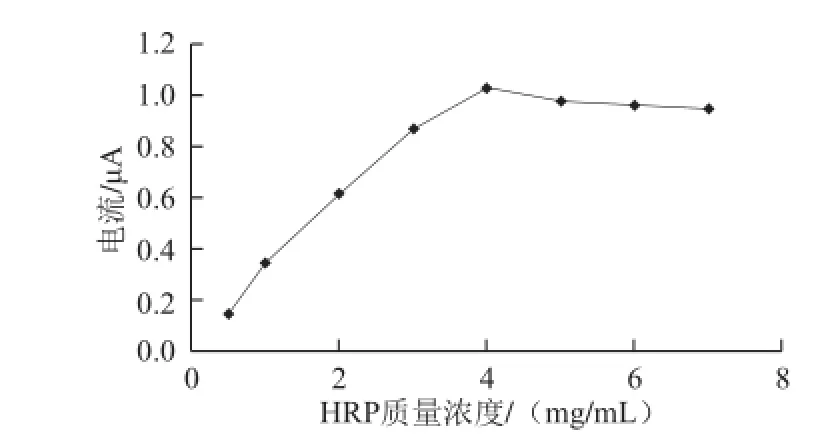
图4 HRP质量浓度对还原峰电流响应的影响Fig.4 Influence of HRP concentration on reductive peak current response
2.3.3 电解质溶液pH值对酶传感器性能的影响
pH值是影响酶催化反应速率与酶生物活性的重要因素之一,当将酶固定到电极上时,因固定化材料的的缘故,酶的最适pH值可能会发生一些变化,所以有必要研究pH值对酶传感器的电流响应的影响。选择pH 5.0~9.0时,在过氧化月桂酰浓度为2×10-5mol/L时,考察不同pH值条件下HRP传感器的催化还原电流增量的变化,结果如图5所示。pH 7.0时电流值响应达到最大值,正好与HRP的最适pH值7.2相接近,说明壳聚糖生物兼容性良好,并未对HRP的构象等造成影响。因此,溶液的pH值选为7.0。
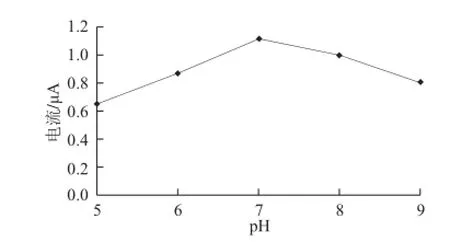
图5 溶液pH值对过氧化月桂酰还原峰电流的影响Fig.5 Influence of pH value on reductive peak current of lauroyl peroxide solution
2.3.4 电子介体浓度对酶传感器性能的影响
电子介体浓度是影响HRP传感器性能的一个重要因素。分别取0.001、0.005、0.01、0.05、0.08、0.1 mol/L浓度的二茂铁溶液,按照1.3.1节的方法6 支HRP传感器,在含2×10-5mol/L的过氧化月桂酰的有机相电解质溶液中进行循环伏安扫描,记录其还原电流响应值,结果如图6所示。HRP传感器对过氧化月桂酰的催化还原电流响随着二茂铁浓度增加而增大,当二茂铁浓度达到0.05 mol/L时,电流响应值达到最大,随后开始随着浓度的增大而逐渐减小。因为二茂铁在低浓度范围内时,电极的电流响应受媒介体动力学控制,当二茂铁浓度增大到一定值时,电流响应开始受酶底物动力学控制。二茂铁属于疏水性的有机金属络合物,通过将其固定包埋在壳聚糖中,使其不易流失,从而能够提高传感器的稳定性。因此,选用浓度为0.05 mol/L的二茂铁作为最佳电子介体。
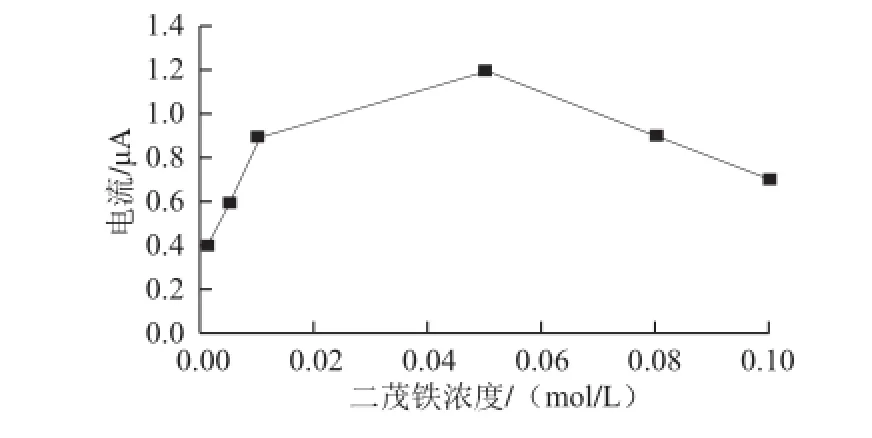
图6 电子介体浓度对电流响应的影响Fig.6 Influence of electronic medium concentration on current response
2.3.5 电化学参数的选择
方波伏安法是一种快速、高效、多功能、高灵敏度,适用广泛的电分析方法。该方法扫描速度快,能较好地抑制背景电流,减小噪声的影响,从而提高信噪比降低检测限。该法较差分脉冲伏安法响应更快、灵敏度更高。过氧化月桂酰的方波伏安图如图7所示,实验条件为前述所定最适实验条件。电位范围1.0~0.0 V、方波频率2.0 Hz、电位增量1 mV、方波幅度0.02 V、等待时间2 s时,还原峰电流响应最好,峰形良好。
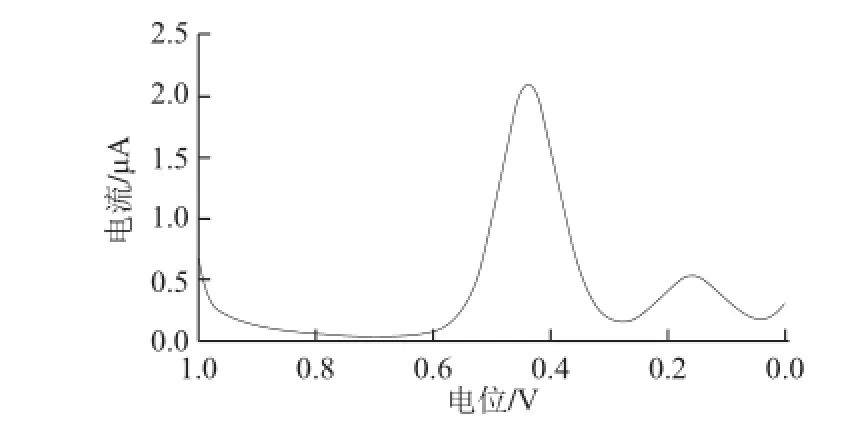
图7 过氧化月桂酰的方波伏安图(浓度为4×10-5mol/L)Fig.7 Square wave voltammogram of 4 × 10-5mol/L lauroyl peroxide
综上所述,最终确定的最佳电化学分析参数如下:1,2-二氯乙烷为最宜有机溶剂;0.1 mol/L乙醇-氯化锂为最宜支持电解质,乙醇硫酸浓度6 mmol/L,电位范围1.0~0.0 V、方波频率2.0 Hz、电位增量1 mV、方波幅度0.02 V、等待时间2 s。在该参数下,峰形良好,灵敏度较高。
2.4 酶电极的重复性和稳定性
按1.3.1节方法及优化条件制备15 支CS-FC/HRP/ MWCNTs酶传感器,采用方波伏安法对4×10-5mol/L过氧化月桂酰进行重复性实验测定研究,测定结果的过氧化月桂酰催化还原电流增量平均值为3.72 μA,相对标准偏差(relative standard deviation,RSD)为3.5%,证明该法制备的HRP传感器具有良好的重复性。同样方法制备一支CS-FC/HRP/MWCNTs酶传感器,对4×10-5mol/L过氧化月桂酰进行6次测定,平均响应电流为(3.68±0.02)μA,RSD为2.10%。同样方法制备的CS-FC /HRP/MWCNTs酶传感器置于4 ℃的冰箱保存,1 周后其电流响应为初始电流响应值的98%,4 周后电极响应为到初始值的95%。由此表明本实验制备的CS-FC/HRP/MWCNTs酶传感器具有良好的可重复性与稳定性,这主要是因为多壁碳纳米管与壳聚糖生物相容性好,所选有机相溶剂合理,能较好地保持辣根过氧化物酶的活性。
2.5 CS-FC/HRP/MWCNTs酶传感器对脂质过氧化物的催化还原电流与脂质过氧化物浓度之间的关系
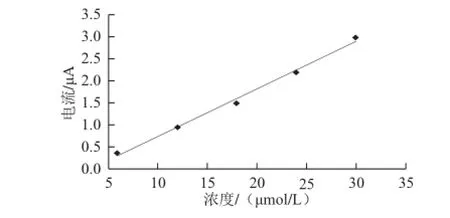
图8 HRP传感器催化过氧化月桂酰还原电流与其浓度的关系Fig.8 Calibration curve of reductive current response of HRP enzyme sensor against lauroyl peroxide concentration
按标准加入法配制一定梯度浓度的过氧化月桂酰的乙醇溶液,在最优实验条件下进行方波伏安扫描并分别记录不同浓度的过氧化月桂酰在CS-FC/HRP/MWCNTs酶传感器上的催化还原峰电流值,如图8所示,每一个浓度样品均做3 次平行实验,以3 次还原电流的平均值作为过氧化月桂酰的还原电流值,然后减去空白对照样时CSFC/HRP/MWCNTs酶传感器在电解质溶液中还原峰电流值即得到该浓度的过氧化月桂酰在CS-FC/HRP/MWCNTs酶传感器上的催化还原电流增量。以催化还原峰电流增量为纵轴,过氧化月桂酰的浓度为横轴作图,得到二者的校正曲线方程y =0.108 53 x-0.354 8,R2=0.992 3(式中:y为过氧化月桂酰在CS-FC/HRP/MWCNTs酶传感器上的催化还原电流增量/μA;x为有机相电解质溶液中过氧化月桂酰的浓度/(mol/L))。线性检测范围为2.5×10-6~3.0×10-5mol/L,最低检测限为2.0×10-7mol/L(RSN=3),检测灵敏度为1.08×10-5μA/(mol/L)。CS-FC/HRP/MWCNTs酶传感器的电化学 催化还原电流响应随着过氧化物浓度的增加而增加,且响应灵敏迅速,单次样品测定分析只需45~60 s,检测结果的精确性、准确性、所需时间均好于Mannino等[20]的报道。
2.6 实际植物油样品过氧化值的测定
利用CS-FC/HRP/MWCNTs酶传感器法测定了4 种市售植物油(大豆油、花生油、玉米油和葵花籽油)的过氧化值,为了验证该方法的有效性,同时利用国标碘量法测定同一植物油样的过氧化值,并加以对比,测定结果如表1所示,CS-FC/HRP/MWCNTs酶传感器法测定样品如图9所示。采用HRP传感器法测定实际植物油样品的过氧化值时,无需对植物油样品进行预处理。准确称取0.5 g的油样品置于10 mL的电解池中,随后加入3.5 mL的1.0 mol/L乙醇-氯化锂溶液、1.5 mL的乙腈,搅拌均匀并通氮除氧2 min,然后进行方波伏安扫描,并记录其脂质过氧化物的催化还原峰电流。每个植物油样品平行测定3 次,其平均值作为植物油样品过氧化物的还原峰电流,带入2.5节中校正曲线,计算得到其过氧化物值;碘量法测定按照GB/T 5538—2005 《动植物油脂:过氧化值测定》进行。
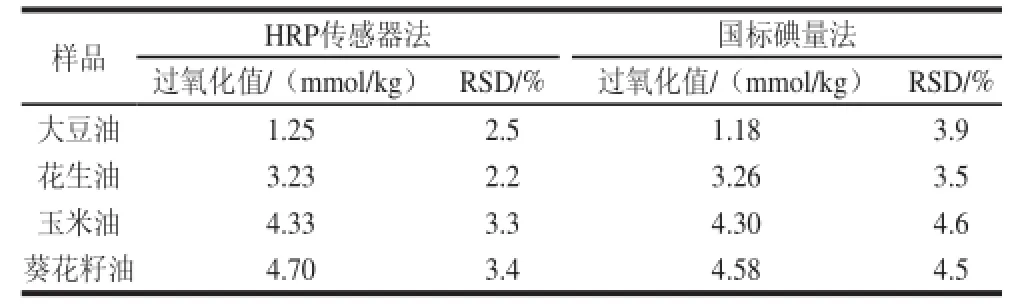
表1 HRP传感器法与国标碘量法测定植物油样过氧化值的结果Table1 Determination of peroxide value of vegetable oils by HRP enzyme sensor method vs iodometric titration
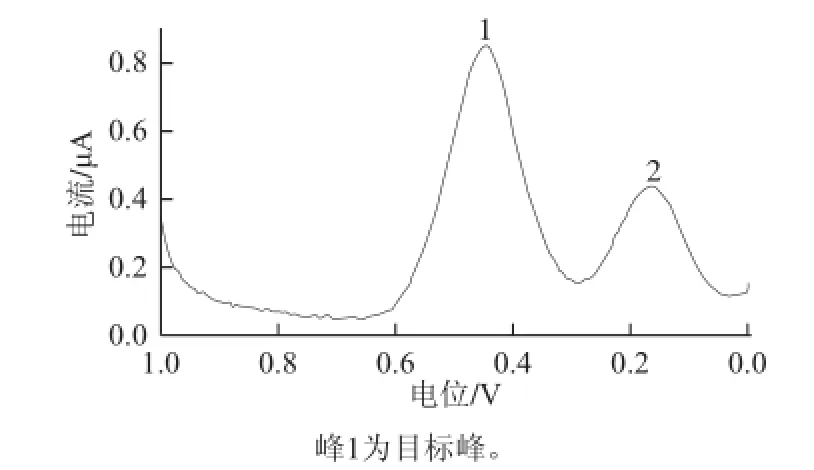
图9 玉米油样品方波伏安图Fig.9 Square wave voltammogram of corn oil sample
由表1可知,HRP传感器法所测得的植物油样的过氧化值与国标碘量法所测结果基本一致,RSD小于5%。图9表明,该酶传感器在玉米油样中的方波伏安图出现两个峰,其中峰1为玉米油中过氧化物的还原峰,峰2可能是植物油中含有的其他能被HRP所催化反应的其他物质,但对峰1不产生干扰。
3 结 论
采用壳聚糖为固定化材料,制备了有机相CS-FC/ HRP/MWCNTs酶传感器。该酶传感器对脂质过氧化物等有机过氧化物的还原具有显著催化作用。用循环伏安法研究了过氧化物在该电极上的电化学行为,并对分析条件进行了优化,该修饰电极对过氧化物的催化氧化电流与其浓度在2.5×10-6~3.0×10-5mol/L范围内呈良好的线性关系,该方法检测限为2.0×10-7mol/L。利用该酶传感器法对市售4 种植物油中的过氧化值进行测定,所测结果与国标碘量法测定结果基本一致,而且该方法的灵敏度、准确度较高,能有效避免油样自身的颜色对检测结果的影响,所需植物油样量小且无需任何预处理,故该法可用于油脂及含油食品过氧化值的测定。
[1] 卢艳杰, 龚院生, 张连富. 油脂检测技术[M]. 北京: 化学工业出版社, 2004: 134-254.
[2] 李书国, 李雪梅, 陈辉. 我国食用油质量安全现状、存在问题及对策研究[J]. 粮食与油脂, 2005(12): 3-6.
[3] 韩玉莲. 油脂氧化常用检测方法及其评价[J]. 中国食品卫生, 1994, 6(1): 57-60.
[4] 梅盛华, 张伟忠, 刘马英. 碘量比色法测定食品油脂中过氧化值的研究[J]. 海峡预防医学, 2000, 6(2): 48-49.
[5] 李遂勤. 可见分光光度法与碘量法测定食用植物油过氧化值的比较[J]. 河南预防医学, 2001, 12(3): 147-148.
[6] DOBARGANES M, VELASCO J. Analysis of lipid hydroperoxides[J]. European Journal of Lipid Science and Technology, 2002, 104(7): 420-428.
[7] 戴晋生, 曹素芳, 尚瑛达. 测定食用植物油中过氧化值方法改进[J].西部粮油科技, 2001, 26(6): 51-52.
[8] 江秀明, 周长智, 李建伟. 可见分光光度法测定食用油过氧化值[J].郑州粮食学院学报, 1999, 20(2): 55-57.
[9] 应太林, 王朝瑾, 刘海鹰. Nafion膜固定的亚甲基蓝为介体的生物传感器[J]. 生物化学与生物物理进展, 1997, 24(3): 254-258.
[10] WANG J, DEMPSEY E, EREMENKO A. Organicphase biosensing of enzyme inhibitors[J]. Analytica Chemica Acta, 1993, 279(2): 203-208.
[11] CAMPANELLA L, de SANTIS G, FAVERO G, et al. Two OPEEs (organic phase enzyme electrodes) used to check the percentage water content in hydrophobic foods and drugs[J]. Analyst, 2001, 126: 1923-1928.
[12] 李书国, 薛文通, 张惠. 食用油脂过氧化值分析检测方法研究进展[J].粮食与油脂, 2007(7): 35-38.
[13] WANG J. Organic-phase biosensors-new tools for flowanalysis: a short review[J]. Talanta, 1993, 40(12): 1905-1909.
[14] KONASH A, MAGNER E. Characterization of an organic phase peroxide biosensor based on horseradish peroxidase immobilized in eastman AQ[J]. Biosensors and Bioelectronics, 2006, 22(1): 116-123.
[15] CHUT S L, LI J. Reagentless amperometric determination of hydrogen peroxide by Silica Sol-Gel modified biosensor[J]. Journal of the Electrochemical Society, 1998, 448: 69-77.
[16] 李书国, 陈辉, 李雪梅. Nafion/MB/HRP酶电极的制备及在测定植物油过氧化值中的应用[J]. 中国粮油学报, 2009(2): 106-112.
[17] OSINA M A, BOGDANOVSKAYA V A, TARASEVICH M R. Bioelectrocatalytic reduction of peroxide compounds on the peroxidase-nafion composite[J]. Russian Journal of Electrochemistry, 2004, 40(8): 802-812.
[18] BI Huaqing, LI Yanhui, LIU Shufeng, et al. Carbon-nanotube-modified glassy carbon electrode for simultaneous determination of dopamine, ascorbic acid and uric acid: the effect of functional groups[J]. Sensors and Actuators B: Chemical, 2012, 171/172: 1132-1140.
[19] 张凌燕, 袁若, 柴雅琴, 等. 基于辣根过氧化物酶/纳米金/辣根过氧化物酶/多壁纳米碳管修饰的过氧化氢生物传感器的研究[J]. 化学学报, 2006, 64(16): 1711-1715.
[20] MANNINO S, COSIO M S. Determination of peroxide value in vegetable oils by an organic-phase enzyme electrode[J]. Analytical Letters, 1994, 27(2): 299-308.
An Organic Phase Horseradish Peroxidase Sensor Based on Nanomaterials for the Determination of Peroxide Value in Vegetable Oils
WANG Li-ran, ZHANG Yuan-yuan, LI Shu-guo*
(College of Biological Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China)
An organic phase chitosan-ferrocene horseradish peroxidase multiwalled carbon nanotubes (CS-FC/HRP/ MWCNTs) enzyme sensor for the determination of peroxide value of vegetable oils was studied. The catalytic effect of CS-FC/HRP/MWCNTs enzyme sensor on the electrochemical reduction of lipid hydroperoxide in organic phase was investigated by cyclic voltammetry. The mechanism of the redox process of lauroyl peroxide and HRP was expounded. The electrode process of CS-FC/HRP/MWCNTs enzyme-based sensor was typically controlled by the electrochemical reaction on the electrode surface, instead of the diffusion of HRP protein. The micro-grid structure in three dimensions which facilitated electrocatalytic reaction of enzyme sensor was observed by scanning electron microscopy technique (SEM). The increase in catalytic reduction current of lauroyl peroxide at the CS-FC/HRP/MWCNTs enzyme sensor was linearly correlated with substrate concentration in the range of 2.5 × 10-6-3.0 × 10-5mol/L (y = 0.108 5x - 0.354 8, R2= 0.992 3). Meanwhile, the limit of detection of this enzyme sensor was 2.0 × 10-7mol/L (RSN= 3). The developed method was applied to the determination of peroxide value of soybean oil and grapeseed oil, and the results well agreed with those obtained by the classical iodometric titration method. Being more precise and accurate than iodometric titration method, it is a practical method for rapid determination of peroxide value in vegetable oils.
organic phase enzyme sensor; multi-walled carbon nanotube; vegetable oil; determination of peroxide value
TS227
A
1002-6630(2014)20-0119-07
10.7506/spkx1002-6630-201420024
2013-12-24
国家自然科学基金面上项目(20876165);河北省教育厅科技项目(2009329)
王丽然(1988—),女,硕士研究生,研究方向为食品科学与安全。E-mail:963673369@qq.com
*通信作者:李书国(1969—),男,教授,博士,研究方向为粮油食品科学与安全技术。E-mail:shuguolee@126.com
