加压毛细管电色谱-紫外法检测复方维生素片中4 种脂溶性维生素
2014-01-18施文君王晓曦
郑 署,施文君,王晓曦,李 静,谷 雪,闫 超,*
(1.上海交通大学药学院,上海 200240;2.上海通微分析技术有限公司,上海 201203)
加压毛细管电色谱-紫外法检测复方维生素片中4 种脂溶性维生素
郑 署1,施文君1,王晓曦1,李 静2,谷 雪1,闫 超1,*
(1.上海交通大学药学院,上海 200240;2.上海通微分析技术有限公司,上海 201203)
采用反相加压毛细管电色谱-紫外检测,建立一种高效、简便、快速的脂溶性维生素分析方法,并用于复合维生素片中脂溶性维生素的检测。使用C18反相毛细管色谱柱,以含0.05%三氟乙酸的95%甲醇溶液(pH 3.3)为流动相进行等度洗脱,泵总流速为0.2 mL/min,分离电压为15 kV,并针对脂溶性维生素样品个体间紫外吸收波长差别较大的问题,采用波长时间程序进行检测。VA、VD3、VE、VK3四种脂溶性维生素可在5 min内实现快速分离。各组分的最低检出限(RSN=3)分别为1.5、3.0、15、1.5 μg/mL,线性关系良好,样品加标回收率在90.0%~110.0%之间,相对标准偏差为0.53%~5.46%。将所建立方法应用于维生素片样品分析,取得了良好的分析结果。该方法简单方便、重复性好、准确可靠。
加压毛细管电色谱;紫外检测;脂溶性维生素;复合维生素片
维生素是人和动物维持正常的生理功能而必需从食物中获得的一类微量有机物质,在人体生长、代谢、发育过程中发挥着重要的作用。维生素是个庞大的家族,目前所知的维生素就有几十种,大致可分为脂溶性和水溶性两大类。脂溶性维生素主要包括VA、VD、VE和 VK。VA和VD主要储存于肝脏,VE主要存于体内的脂肪组织,而VK储存较少。它们是人体所需要的微量营养成分,对人体的生理活动有非常重要的作用。目前,脂溶性维生素的检测方法有胶束电动色谱法[1]、高效液相色谱法[2-3]、薄层色谱法[4]、荧光法[5-7]、电色谱法[8]等,其中高效液相色谱法是应用最多、最广的方法,但同时测定脂溶性维生素(VA、VD、VE、VK)的文献报道较少,且常规液相色谱法的分离时间长,试剂样品耗费多。因此,建立一种更为简便、快速、经济的多组分脂溶性维生素分离检测的方法则成为必然趋势。
加压毛细管电色谱(pressurized capillary electrochromatography,pCEC)是近年发展起来的一种新兴微分离技术,同时具备高效液相色谱的高选择性和毛细管电泳的高柱效。其特征是电渗流和压力流同时驱动流动相,由于在流动相和固定相中分配系数的不同以及电泳淌度的差异,样品被快速、高效地分离。pCEC系统结构简单,特点突出,通用性和稳定性好,并可与多种检测技术进行联用,目前已广泛应用于环境分析[9]、药物分析[10-13]、食品安全检测[14]、生命科学[15-16]等研究领域。
本研究基于pCEC微分离平台,建立了波长时间程序检测维生素片中脂溶性VA、VD3、VE、VK3的多组分同时分离检测的加压毛细管电色谱法,该方法简单快速、灵敏度高、重复性好、准确可靠,可为常用脂溶性维生素的分离检测提供新的途径。
1 材料与方法
1.1 材料、试剂与仪器
供试品购自国大药房有限公司。
乙腈、甲醇(均为色谱纯)和磷酸二氢钠、磷酸氢二钠(均为分析纯) 上海国药集团化学试剂有限公司;水为二次蒸馏水;三氟乙酸(trifluoroacetic acid,TFA)(分析纯) 上海安谱科学仪器有限公司;脂溶性维生素对照品:VA(批号:36952,纯度>98%)、VD3(批号:38718,纯度>98%) 阿拉丁试剂公司;D-α-VE(纯度>99%) 日本Tokyo Chemistry Industry公司;VK3(纯度>98%) 百灵威科技有限公司。
TriSepTM-2100加压毛细管电色谱仪 美国Unimicro Technologies公司;KQ2200B型超声波清洗器昆山超声仪器有限公司;PB-10 pH计 北京赛多利斯仪器有限公司;FA1004电子天平 上海恒平科学仪器有限公司;AS5150A超声波清洗机 天津奥特赛思斯仪器有限公司;HP-01无油真空泵 天津恒奥科技发展有限公司;C18毛细管电色谱柱 苏州环球色谱有限公司。
1.2 方法
1.2.1 标准溶液的配制
4 种脂溶性维生素标准储备液的配制:分别准确称取VA、VD3、VK3、VE各100 mg,置于不同烧杯中,用适量甲醇溶解,经0.22 μm滤膜过滤后,分别移入10 mL棕色容量瓶中,以甲醇定容至刻度,低温避光保存。
4 种脂溶性维生素系列标准工作溶液的配制:用甲醇溶液将上述标准储备液逐级稀释为5、10、50 、100、300、500、1、2 mg/mL的系列标准混合溶液,置于冰箱保存备用。
1.2.2 样品前处理
在避光操作条件下精密称取供试品3 g,研磨均匀后置于100 mL烧杯中,加入适量甲醇,超声提取15 min;经0.22 μm滤膜过滤,将滤液转移至10 mL棕色容量瓶中;重复上述提取操作两次,合并滤液,摇匀后以甲醇定容至刻度,低温避光保存。
1.2.3 pCEC-UV色谱条件
色谱柱:C18毛细管电色谱柱(100 mm×100 μm,3 μm);流动相:甲醇-水(含0.05% TFA,pH 3.3)(95∶5,V/V);泵总流速:0.2 mL/min;检测波长时间程序见表1;进样量1 μL(分流比1∶300);电压施加在毛细管色谱柱的出口端,进口端接地。
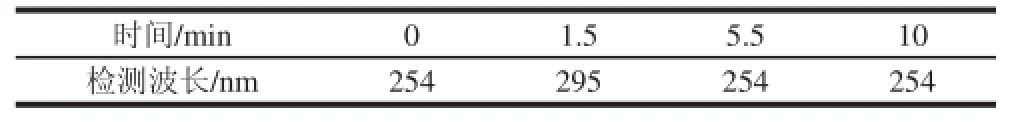
表1 波长时间程序Table1 Detection wavelength-time program for four fat-soluble vitamins
2 结果与分析
2.1 样品前处理方法的选择
脂溶性维生素的性质不稳定,酸碱、氧气、光和热均可使其分解变质,为保证测定结果的准确性和精密度,在完成样品制备后,应迅速制备成分析试样进行色谱分析。测定脂溶性维生素常用的样品前处理方法有固相萃取法[17]、皂化法[18-19]及溶剂直接萃取法[20]。其中皂化法分为加热回流皂化法和室温过夜皂化法,前者需要高温环境,对脂溶性维生素造成破坏,而后者需要较长的处理时间,一定程度上会造成脂溶性维生素变质,影响测定结果的准确度;而固相萃取法避免了皂化法的上述缺点,但是使用成本较高,操作也较为繁琐;综合考虑,选择溶剂直接萃取法作为脂溶性维生素样品的前处理方法,该方法简便、快捷、成本低、准确度高。
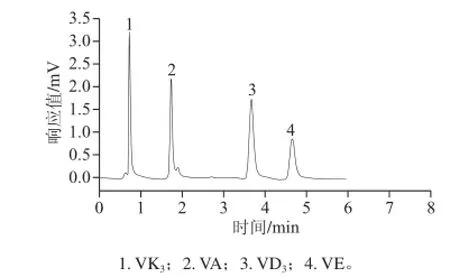
图1 4种脂溶性维生素对照品的pCEC分离色谱图Fig.1 pCEC electrochromatogram of four fat-soluble vitamins
2.2 pCEC-UV色谱条件的选择与优化
本研究基于加压毛细管电色谱平台,实验中主要考察了波长时间程序、流动相组成、分离电压、缓冲盐等色谱条件对4 种脂溶性维生素分离的影响,并进行了条件优化,建立4 种脂溶性维生素的pCEC-UV快速分离检测的方法,见图1。
2.2.1 波长时间程序
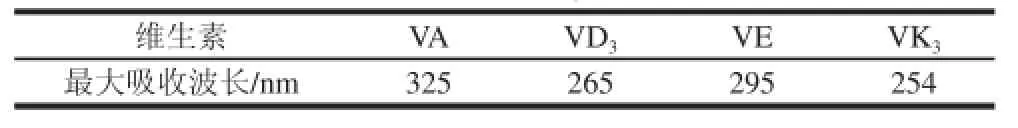
表2 4 种脂溶性维生素的最大吸收波长Table2 Maximum absorption wavelengths of four fat-soluble vitamins
4 种脂溶性维生素的紫外最大吸收波长(表2)差别较大,实验中尝试选择280 nm作为单一检测波长时,发现VA和VE的信噪比较低;而选择295 nm作为单一检测波长时,VK3的信噪比又变得很低。为了提高检测灵敏度,本研究使用波长时间程序(表1)进行检测,结果表明各脂溶性维生素样品均可得到满意的信噪比。
2.2.2 流动相的选择
分别考察甲醇-水、乙腈-水作为流动相时对样品分离的影响,见图2,发现在乙腈-水体系条件下,VD3的信噪比较低,选择甲醇-水体系可得到更好的结果。本实验最终确定以甲醇-水(95∶5,V/V)作为流动相进行等度洗脱。

图2 脂溶性维生素在不同流动相条件下的色谱图Fig.2 pCEC electrochromatogram of four fat-soluble vitamins under different mobile phase conditions
2.2.3 流动相中缓冲盐的选择与优化
加压毛细管电色谱分离体系中需要添加可导电的酸碱或者缓冲盐溶液,以保证施加电压后形成稳定的电场及电渗流,实验中分别考察TFA、磷酸盐以及Tris-HCl缓冲体系对分离的影响。结果表明,磷酸盐以及Tris-HCl缓冲溶液体系下,加电后的电流值过高,引起的焦耳热效应,造成基线噪声较大;而添加TFA后,可有效改善色谱峰形,在确保电渗流产生的前提下,还可以避免维生素在反相色谱柱上的吸附。同时注意到,添加过量的TFA会造成流动相体系的pH值过低,不利于电渗流的产生,所以本实验最终选择TFA体积分数为0.05%(pH 3.3,V/V)。
2.2.4 分离电压的影响
电压是pCEC实验条件中的一个重要参数,施加不同的电压对样品的分离会产生不同的影响,在本研究中主要是对分离速度和分辨度的影响。实验中分别考察了电压为0、5、10、15 kV和20 kV时,4 种脂溶性维生素的分离情况。由图3可见,伴随着施加在毛细管出口端负电压的增加,电渗流方向和压力流一致,且一直呈增大趋势,整体分析速度明显提高。但当分离电压超过15 kV后,过大的电压造成电流值急剧上升,焦耳热效应不但使得基线波动增大,且造成了VD3的信噪比下降。
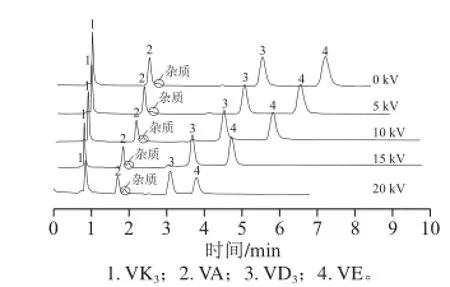
图3 脂溶性维生素在不同电压条件下的色谱图Fig.3 Effect of applied voltage on pCEC separation of four fat-soluble vitamins
实验中发现VA对照品存在杂质,在不加电的情况下两者无法实现基线分离,随着分离电压的增大,分辨度增大(表3)。在考虑不影响定量的基础上,综合各方面因素,本实验最终选择15 kV作为分离电压。
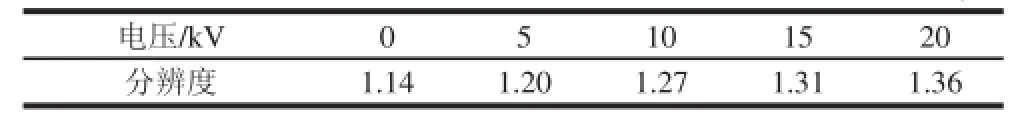
表3 不同电压条件下VA和杂质的分辨度Table3 Resolution of vitamin A and impurities at different voltages
2.3 分析方法学验证
2.3.1 线性范围和检出限
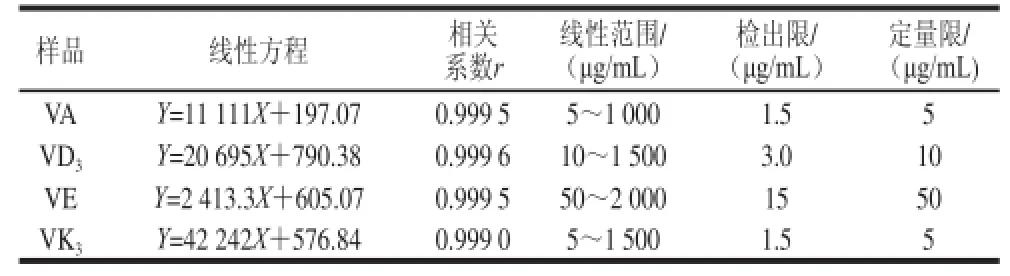
表4 4种脂溶性维生素的线性方程、线性相关系数、线性范围、检出限和定量限Table4 Regression equations, correlation coefficients (r), linear ranges, limits of detection and limits of quantitation for four fat-soluble vitamins
以1.2.1节配制的系列标准溶液按照本实验方法进行测定,以4 种脂溶性维生素的色谱峰面积(Y)与其对应的质量浓度X/(mg/mL)进行线性回归,以信噪比RSN=10计算定量限,RSN=3计算检出限,结果见表4。4 种脂溶性维生素的线性范围均超过两个数量级,线性关系良好,线性相关系数均大于0.999。
2.3.2 加标回收率和精密度
取复方维生素片样品3 g,在线性范围内,添加3 个不同水平的维生素标准品,按照1.2.2节的样品前处理方法进行处理后进行pCEC分析,每个样品连续进样3 次,结果见表5。该方法加标回收率在90.0%~110.0%之间,相对标准偏差为0.53%~5.46%,表明本方法具有良好的准确性和精密度。
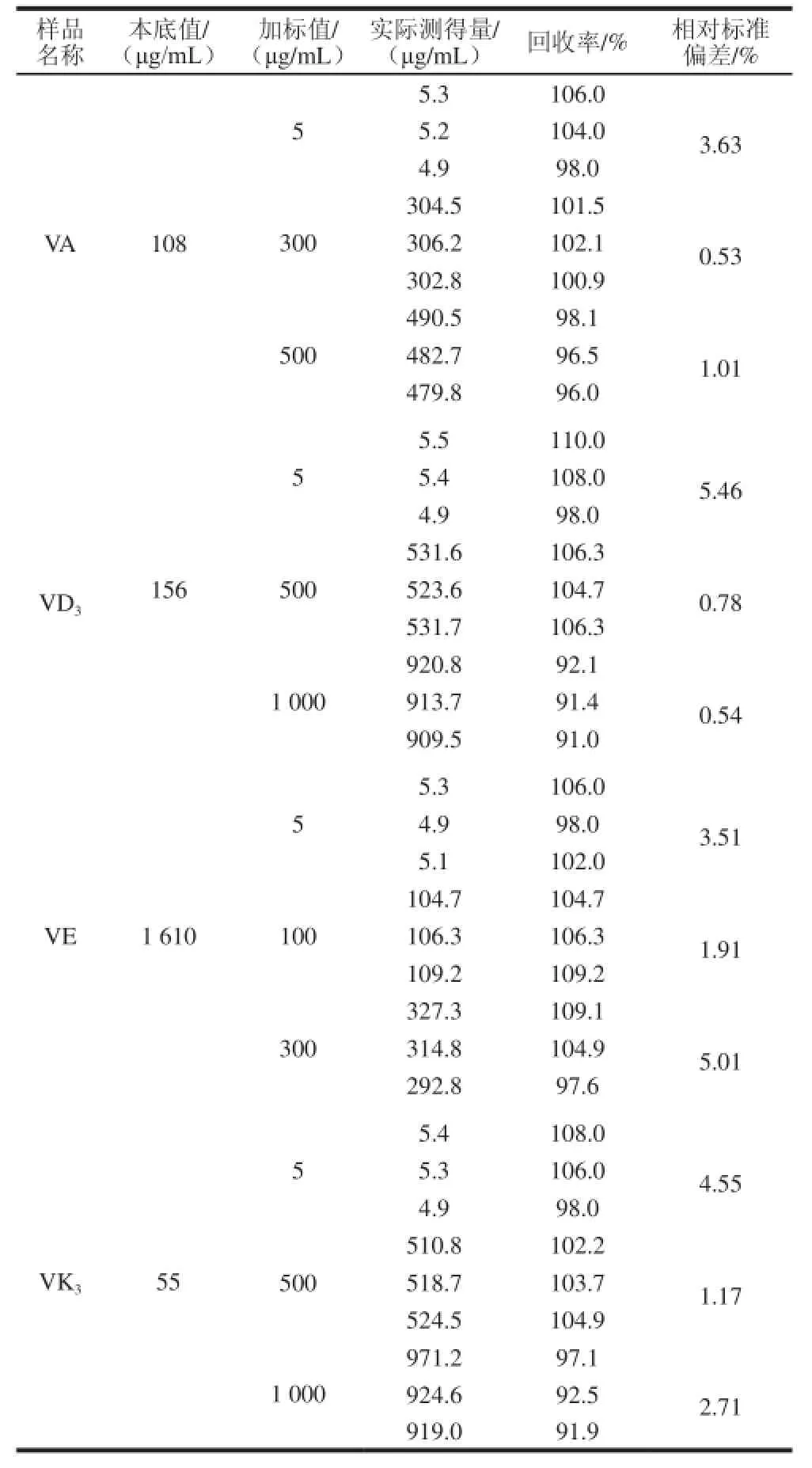
表5 复方维生素片中4 种脂溶性维生素的加标量、回收率及其相对标准偏差(n=3)Table5 Recoveries and relative standard deviations (RSD) of four fatsoluble vitamins in spiked vitamin tablets (n=3)
2.4 复方维生素片的分析
准确称取复合维生素片3 g,按照1.2.2节的样品前处理方法进行处理后,按照1.2.3节的pCEC色谱条件进行分析,见图4。
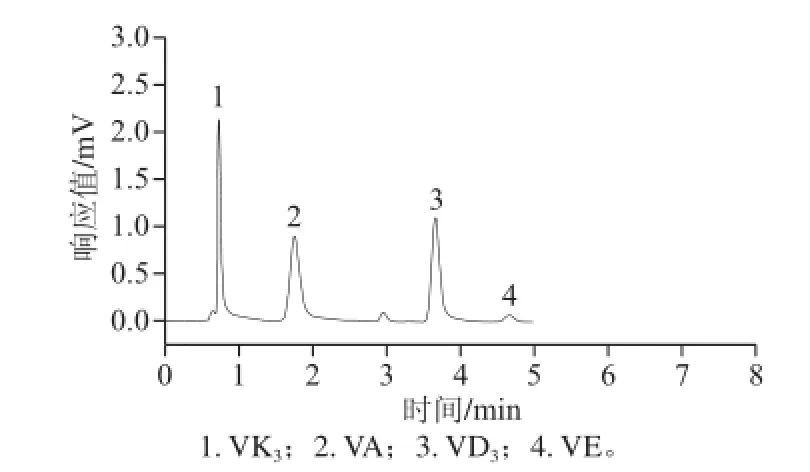
图4 复合维生素片样品中4种脂溶性维生素的pCEC色谱图Fig.4 pCEC electrochromatogram of four fat-soluble vitamins in vitamin tablets
该品牌复方维生素片产品所标注的脂溶性VA、VD3、VK3和VE均被准确的检出,根据线性方程计算其含量见表6。
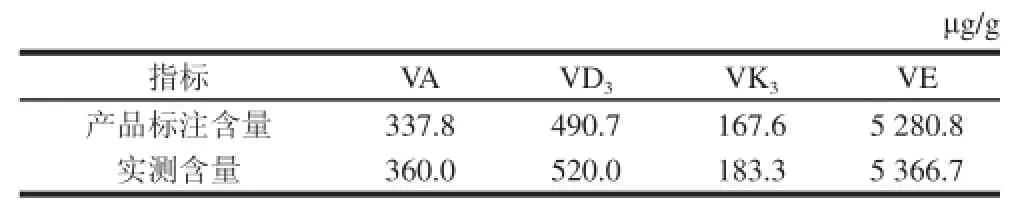
表6 复方维生素片中4 种脂溶性维生素的含量Table6 Contents of four fat-soluble vitamins in vitamin tablets
3 结 论
本实验以pCEC为平台,在5 min内可以完成常用4 种脂溶性维生素的同时测定。该方法简单方便,准确可靠,灵敏度较高,借助pCEC电渗流和压力流的双重推动力,显著提高了分析速度和分离效能。且pCEC作为一种微分离技术,实际分析流速只在微升级甚至纳升级,大大节省了检测成本,具有实用推广价值。
[1] DELGADO-ZAMARRENO M M, GONZALEZ-MAZA I, SANCHEZ-PEREZ A, et al. Separation and simultaneous determination of water-soluble and fat-soluble vitamins by electrokinetic capillary chromatography[J]. Journal of Chromatography A, 2002, 953(1): 257-262.
[2] 徐军, 张慧芬, 邵裕坤, 等. 高效液相色谱法测定人血中脂溶性维生素的含量[J]. 中国药学杂志, 2006, 41(2): 147-149.
[3] 卢燕, 许群, 陈静, 等. 高效液相色谱多阀多柱技术同时分析水溶性和脂溶性维生素[J]. 环境化学, 2012, 31(9): 1442-1447.
[4] 方海顺, 周远华, 苏广海. 薄层色谱法快速检测注射用脂溶性维生素(Ⅰ)[J]. 中国医药工业杂志, 2013, 44(5): 483-486.
[5] DUGGAN D E. Spectrofluorometric determination of tocopherols[J]. Archives of Biochemistry and Biophysics, 1959, 84(1): 116-122.
[6] HANSEN L G, WARWICK W J. A fluorometric micro method for serum tocopherol[J]. Technical Bulletin of the Registry of Medical Technologists, 1966, 36(6): 131-136.
[7] 阚健全. 荧光法同时测定食品中维生素A和维生素E的含量[J]. 营养学报, 1990, 12(1): 46.
[8] ATURKI Z, D’ORAZIO G, FANALI S. Rapid assay of vitamin E invegetable oils by reversed-phase capillary electrochromatography[J]. Electrophoresis, 2005, 26(4/5): 798-803.
[9] GU Congying, LIN Li, LI Bin, et al. Rapid separation and determination of microcystins using monolithic columns in isocratic elution mode by pressurized capillary electrochromatography[J]. Electrophoresis, 2008, 29(18): 3887-3895.
[10] WU Kongxian, GU Xue, YAN Chao. Study on fingerprint of ginkgo leaves by pressurized capillary electrochromatography[J]. Chinese Journal of Analytical Chemistry, 2009, 37(4): 581-584.
[11] CHENG Zhongyi, XIA Zongling, HU Chunqi, et al. Chiral separation of bisoprolol, atenolol, clenteral and terbutaline by capillary chromatography[J]. Chinese Journal of Analytical Chemistry, 2007, 35(2): 181-186.
[12] YANG Juniao, SU Xiulan, FANG Ping, et al. Analysis of resveratrol by pressurized-capillary electrochromatography[J]. Chinese Journal of Chromatography, 2004, 22(3): 270-272.
[13] 董洁莹, 欧阳小琨, 曹国洲, 等. 加压毛细管电色谱法测定鳗鱼中5 种磺胺类药物残留[J]. 浙江海洋学院学报: 自然科学版, 2011, 30(5): 392-396.
[14] GARCÍA-CAMPAÑA A M, GÁMIZ-GRACIA L, LARA F J, et al. Applications of capillary electrophoresis to the determination of antibiotics in food and environmental samples[J]. Analytical and Bioanalytical Chemistry, 2009, 395(4): 967-986.
[15] 谢国祥, 邱明丰, 赵爱华, 等. 加压毛细管电色谱法测定肥胖大鼠尿液中内源性代谢物[J]. 分析化学, 2007, 35(8): 1111-1115.
[16] WEI Juan, GU Xue, WANG Yan, et al. Two-dimensional separation system by coupling capillary isoelectric focusing to pressurized capillary electrochro-matography for peptides separation[J]. Chinese Journal of Analytical Chemistry, 2011, 39(2): 188-192.
[17] 刘红菊, 闫冲. 固相萃取RP-HPLC同时测定复合维生素注射液中的VA棕榈酸酯VD3和VE醋酸酯[J]. 药学实践杂志, 2007, 25(3): 162-164.
[18] 张戈, 张虹, 马丽英. 乳粉维生素A, D, E的高效液相色谱测定[J]. 哈尔滨医科大学学报, 2002, 36(2): 171; 174.
[19] 李东, 顾鹏, 蒋淑梅. 高效液相色谱法测定食品中维生素E的研究进展[J]. 食品科学, 2000, 21(6): 57-59.
[20] 海沙尔, 塔依尔. 液相色谱水-异丙醇体系测定脂溶性维生素A, D, E[J]. 光谱学与光谱分析, 2002, 22(4): 693-694.
Determination of Four Fat-Soluble Vitamins in Vitamin Tablets by Pressurized Capillary Electrochromatography with UV Detection
ZHENG Shu1, SHI Wen-jun1, WANG Xiao-xi1, LI Jing2, GU Xue1, YAN Chao1,*
(1. School of Pharmacy, Shanghai Jiaotong University, Shanghai 200240, China; 2. Unimicro (Shanghai) Technologies Co. Ltd., Shanghai 201203, China)
An effective, convenient and fast method for the analysis of fat-soluble vitamins in vitamin tablets was developed using pressurized capillary electrochromatography (pCEC) with ultra violet (UV) detection. The separations was performed on a reversed-phase C18capillary column with a certain detection wavelength-time program. The mobile phase was 95% (V/V) methanol containing 0.05% TFA (pH 3.3) at a flow rate of 0.2 mL/min with a separation voltage of 15 kV. Four fatsoluble vitamins (vitamin A, vitamin D3, vitamin E, and vitamin K3) were baseline separated within 5 min in an isocratic pCEC mode. The detection limits for vitamin A, vitamin D3, vitamin E, and vitamin K3(RSN= 3) were 1.5, 3.0, 15 and 1.5 μg/mL with good linearity, respectively. The interference on the analysis of vitamin tablets was effectively eliminated. The recoveries of spiked fat-soluble vitamin samples were 90.0%-110.0% with RSD ranging from 0.53% to 5.46%. This method is simple, rapid, repeatable and accurate.
pressurized capillary electrochromatography (pCEC); ultra-violet (UV) detection; fat-soluble vitamin; vitamin tablets
O657
A
1002-6630(2014)20-0105-05
10.7506/spkx1002-6630-201420021
2013-11-10
国家自然科学基金面上项目(21175092);国家自然科学基金青年科学基金项目(21105064);国家重大科学仪器设备开发专项(2011YQ150072;2011YQ15007204;2011YQ15007207;2011YQ15007210);上海市自然科学基金项目(12ZR1413600)
郑署(1989—),女,硕士研究生,研究方向为加压毛细管电色谱体系的优化及其在食品添加剂中的应用。
E-mail:zs559618@163.com
*通信作者:闫超(1956—),男,教授,博士,研究方向为色谱分析。E-mail:chaoyan@unimicrotech.com
