微波辅助萃取-超高效液相色谱-质谱法测定食品用纸容器中双酚A
2014-01-17马晓斐梁天佐贾振国
马晓斐,宋 炜,梁天佐,贾振国,张 岩,*
微波辅助萃取-超高效液相色谱-质谱法测定食品用纸容器中双酚A
马晓斐1,宋 炜2,梁天佐1,贾振国1,张 岩1,*
(1.河北省食品质量监督检验研究院,河北 石家庄 050091;2.河北省食品药品检验院,河北 石家庄 050011)
建立食品用纸容器中双酚A的超高效液相色谱-质谱检测方法。采用微波辅助萃取仪对 样品进行萃取,Sep-Pak C18固相萃取柱净化,甲醇-水(含有体积分数0.05%氨水)作为流动相,梯度洗脱,经Kinetex C18(2.1 mm×100 mm,2.6 μm)色谱柱分离,采用电喷雾电离,多反应监测模式下进行测定。结果表明:该方法在1.0~100.0 μg/L质量浓度范围内线性良好,其相关系数(r )为0.999 7。在5、10 μg/kg和50 μg/kg 3个添加水平下,双酚A的平均回收率稳定在90.5%~98.6%之间,相对标准偏差均小于5.6%,方法检出限2.5 μg/kg。该方法操作简便,灵敏度高,适用于食品用纸容器中双酚A残留分析。
超高效液相色谱-质谱;双酚A;微波辅助萃取;食品用纸容器
双酚A是一种重要的化工原料,被广泛应用于食品包装材料及容器内壁涂料[1-3]。研究表明,双酚A可渗透、转移进入到食品及饮料中,可引起人类和动物的内分泌系统、免疫系统、神经系统异常,不仅具有致癌、致突变、致畸的危害,还会严重干扰人类和动物的生殖遗传功能,目前已引起世界各国的关注[4-6]。2008年,加拿大卫生部宣布双酚A为危害物质,禁止进口和销售含有双酚A的聚碳酸酯婴儿奶瓶。挪威污染控制署颁布的“关于限制特定有害物质在消费品中的使用”(prohibition on certain hazardous substances in consumer products,PoHS)指令也限制双酚A在消费品中的使用。随着人们对环保要求的日益严格,纸质包装材料以其良好的物理性能、机械操作性能以及环保方面的优势,已经成为食品包装行业的重要原料之一。但是纸质包装材料在生产及后续加工过程中会添加一些化学物质或者存有潜在的污染物,如双酚A通过这些包装材料迁移进入食品中,严重威胁到人们的身体健康。因此建立食品包装,特别是食品用纸容器中双酚A的测定方法是十分必要的。
目前,双酚A的检测方法主要有高效液相色谱法[7-11]、气相色谱-质谱法[12-15]和液相色谱-质谱法[16-20],但是使用气、液相色谱法无法满足被测物准确定性的要求,而气相色谱-质谱法则需要应用衍生试剂进行衍生化,实验过程不仅费时费力,检测方法灵敏度也不能满足测定要求。液相色谱-质谱法前处理过程不需要衍生反应,具有操作简便、选择性和灵敏度高等优点,近年来报道逐步增多。 双酚A的前处理方法主要有液液萃取、超声提取和微波萃取等方法,而微波萃取技术在提取效率和提取回收率等方面具有显著的优势,越来越备受人们的青睐。目前,尚未见食品用纸容器中双酚A的检测方法,本研究应用微波辅助萃取-超高效液相色谱-质谱(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS-MS)法,建立了食品用纸容器中双酚A的检测方法,该方法灵敏度高、选择性和特异性好,为食品包装用纸的高通量快速检测提供了可靠的分析平台。由于本方法检出限低,所以更适合作为可疑样品的定性确证方法。
1 材料与方法
1.1 材料与试剂
纸餐盒(一次性纸质餐盒)、纸杯(一次性纸质水杯)、复合纸罐(膨化食品包装纸罐) 市购;双酚A标准品(纯度>98%) 美国Sigma公司;甲醇、正己烷、二氯甲烷均为色谱纯 美国Fisher Scientic公司;去离子水由Millipore公司超纯水器制得。
1.2 仪器与设备
8030超高效液相色谱-质谱联用仪 日本岛津公司;Explorer sp 48全自动微波萃取仪 美国培安公司;旋转蒸发仪 瑞士Büchi公司;Sep-Pak C18固相萃取柱(500 mg,6 mL)、氮吹仪 美国Organomation Associates.Jnc公司。
1.3 方法
1.3.1 标准储备液的配制
用甲醇配制双酚A质量浓度1 000 mg/L的储备液,使用时再用甲醇稀释成所需的标准工作溶液,所有标准溶液在4 ℃冰箱中保存。
1.3.2 样品的测定
将样品剪成约1 cm×1 cm的小块。称取2 g试样于35 mL微波辅助萃取管中,加入15 mL二氯甲烷萃取溶液,萃取功率300 W,50 ℃条件下萃取10 min,冷却至室温,将萃取液转移至25 mL比色管中,于40 ℃条件下减压浓缩至近干,用正己烷定容至3 mL,待净化。
净化前首先将Sep-Pak C18柱依次用3.0 mL二氯甲烷和3.0 mL甲醇活化,将试样全部转移至已活化好的固相萃取柱上,流速控制在1 mL/min,待样品溶液流尽后,先用10 mL正己烷淋洗,再用5 mL甲醇洗脱,收集洗脱液于40 ℃条件下氮吹至干,加入甲醇-水(1∶1,V/V)溶液1 mL,旋涡混匀2 min,经0.22 μm滤膜过滤,待测。
1.3.3 色谱条件
色谱柱:Kinetex C18色谱柱(2.1 mm×100 mm,2.6 μm);柱温:35 ℃;流动相:0.05%氨水(A)+甲醇(B),流速0.3 mL/min;梯度洗脱:0 min,60%B;0~3.0 min,60%~90%B;3.0~5.0 min,90%~60%B;进样量:2.0 μL。
1.3.4 质谱条件
离子源:电喷雾电离(electrospray ionization,ESI)源;离子化方式:负模式;监测模式:多反应监测;脱溶剂气流量:15 L/min;脱溶剂气温度:250 ℃;离子源电压:3.5 kV;离子源温度:350 ℃;监测离子对:母离子m/z 227.0、定量离子m/z 212.0、定性离子m/z 133.0;监测离子及碰撞能量:m/z 227.0>212.0(20 eV),m/z 227.0>133.0(20 eV)。
2 结果与分析
2.1 萃取方式的选择
实验采用空白样品(纸餐盒、纸杯和复合纸罐)加标法,比较了索氏萃取、超声萃取、恒温振荡萃取和微波辅助萃取4 种萃取方式的提取回收率,结果见表1。研究表明,恒温振荡萃取提取率较低,索氏萃取和超声萃取的提取率相当,但索氏萃取存在耗时长和操作繁琐等缺点,微波辅助萃取提取率最高,而且提取速度快,操作简便,因此,选用微波辅助萃取作为实验萃取方式。
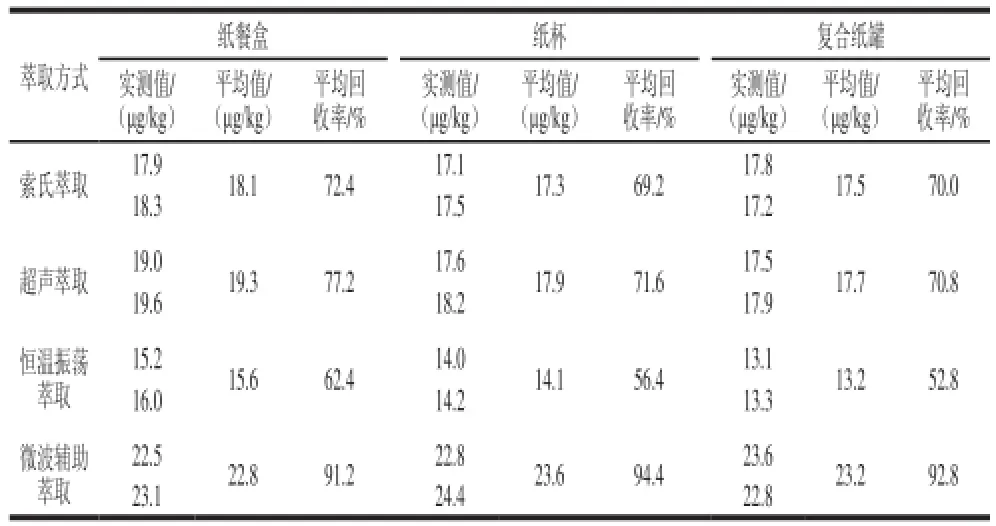
表1 萃取方式的选择Table 1 Selection of optimal extraction procedure
2.2 萃取条件的选择
实验采用空白样品(纸餐盒、纸杯和复合纸罐)加标法,考察了甲醇、正己烷、二氯甲烷分别作为萃取溶剂时双酚A的提取回收率(图1)。研究表明,二氯甲烷的萃取效率最高。同时对萃取温度和萃取时间进行了优化(图2和图3),确定最终萃取条件为二氯甲烷为萃取溶剂,萃取温度50 ℃、萃取时间10 min。
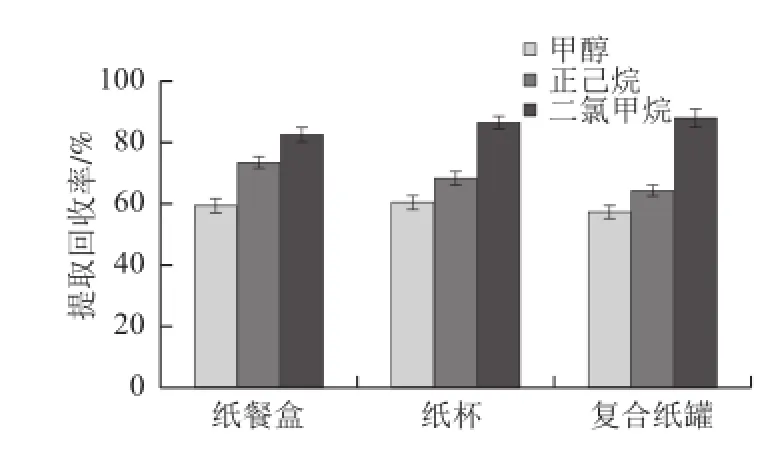
图1 萃取溶剂的萃取效率比较Fig.1 Comparison of extraction efficiency using different solvents
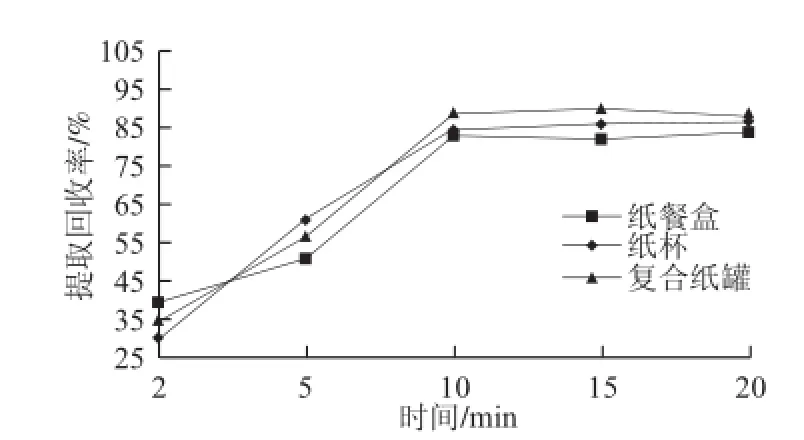
图2 萃取时间的萃取效率比较Fig.2 Comparison of extraction efficiency after different extraction periods
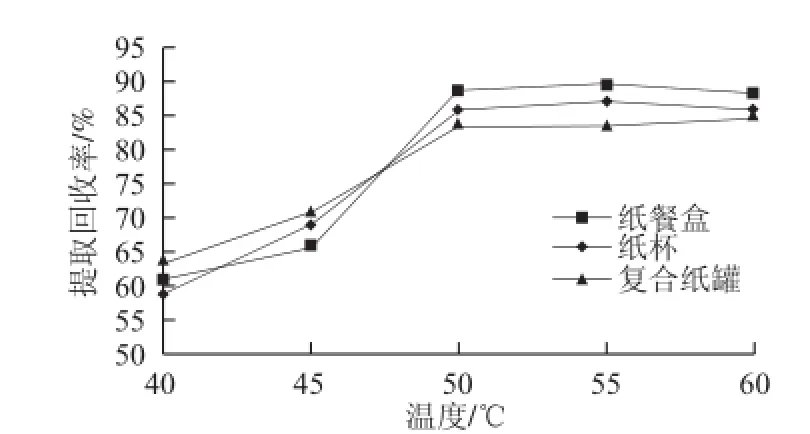
图3 萃取温度的萃取效率比较Fig.3 Comparison of extraction efficiency at different temperatures
2.3 净化条件的选择

图4 Sep-Pakk C18固相萃取柱洗脱实验图Fig.4 Elution curve on Sep-Pak C18column
实验考察了Sep-Pak C18柱、Oasis HLB柱和Supelclean Envi-Carb柱对净化效果和回收率的影响。结果表明,Sep-Pak C18固相萃取柱的净化效果最佳。实验选用100 ng/mL的双酚A标准物溶液作回收率实验研究,选用500 mg/6 mL Sep-Pak C18固相萃取柱,结果表明,10 mL正己烷淋洗时不会使被测物流失,使用5 mL甲醇洗脱回收率即可达到90%以上(图4),所以实验选择500 mg/6 mL Sep-Pak C18固相萃取柱进行富集净化。
2.4 仪器条件的选择及优化
实验比较了Agilent poroshell 120 SB-C18和Kinetex C182种反相色谱柱的分离效果。结果表明,使用Kinetex C18(2.1 mm×100 mm,2.6 μm)色谱柱,分析速度快,峰形及色谱分离效果显著优于Agilent poroshell 120 SB-C18色谱柱(图5)。同时考察了甲醇-水和乙腈-水两种流动相体系对目标物离子化程度的影响。结果表明,使用甲醇-水时,响应值为乙腈-水流动相的2.5 倍,但峰形宽。实验进一步优化了流动相,比较了甲醇-水、甲醇-醋酸铵溶液、甲醇-甲酸铵溶液和甲醇-氨水溶液作为流动相时目标物的离子化效率和峰形。研究表明,在流动相中加入一定量的氨水时,发现目标物的响应值有了明显的提高,且峰宽明显变窄。除了考察流动相组成外,还比较了流动相体系中氨水溶液的体积分数分别为0.01%、0.025%、0.05%、0.1%和0.25%时目标物响应值,结果表明,甲醇-水(体积分数0.05%氨水)作为流动相获得了最优峰形和最高质谱响应。这是由于双酚A具有弱酸性,当流动相中加入一定的碱性物质(氨水)时,信号响应值得到了显著提高。
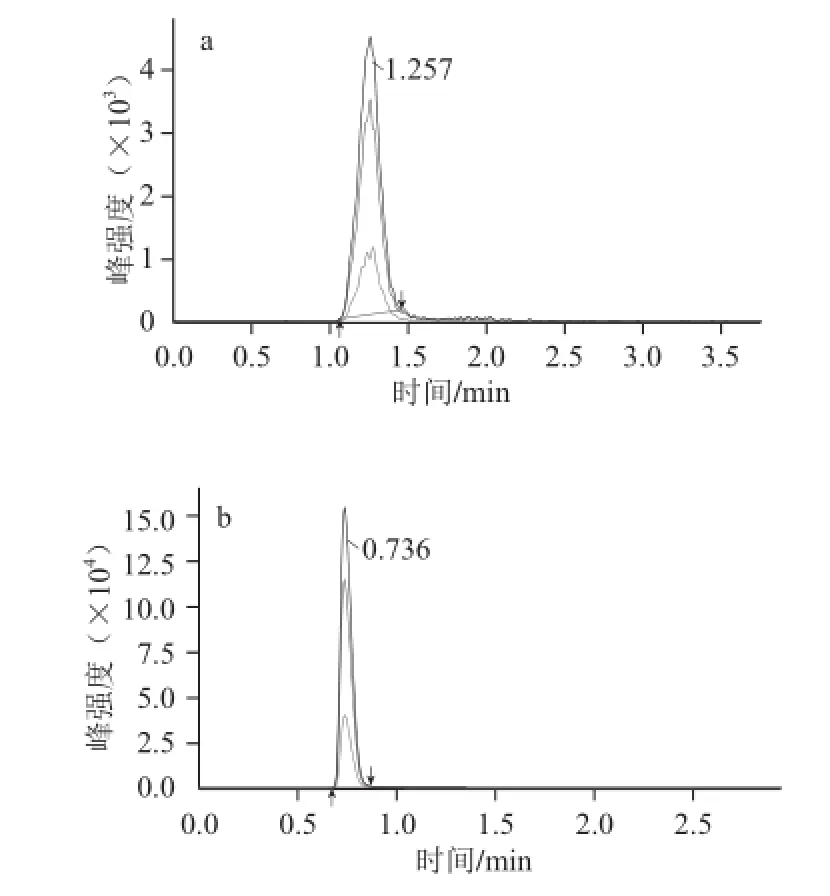
图5 Agilent poroshell 120 SB-C18(a)and Kineteexx C18(b)色谱柱的总离子流图Fig.5 Total ion current chromatograms using Agilent poroshell 120 SB-C18(a) and Kinetex C18(b)
本实验选用ESI作为离子化模式,在负离子检测方式下对双酚A进行一级质谱扫描,双酚A脱去氢离子后得到m/z 227的母离子[M—H]-,对其母离子进行二级质谱分析,实验通过对碰撞能等质谱参数进行比较和优化,双酚A分子断裂后形成m/z 212、m/z 133和m/z 93的特征碎片离子,这些离子分别是m/z 227母离子失去碎片CH3,C6H6O和C9H11O而产生的,最终确定m/z 212为定量离子、m/z 133为定性离子(图6)。

图6 双酚标准溶液多反应监测色谱图(5.0 ng/mL)Fig.6 Multi-reaction monitoring chromatogram of bisphenol A standard solution (5.0 ng/mL)
2.5 线性方程和检出限
为消除样品基质效应,实验采用空白基质匹配标准溶 液法制备标准曲线。取空白样品按照1.3.1节操作,制备空白基质溶液,将标准工作液用空白基质溶液逐级稀释得到质量浓度1、2、5、10、20、50、100 μg/L的系列标准溶液,按质量浓度从低到高依次经液相色谱-质谱测定,以双酚A(m/z 227.0>212.0)的峰面积(Y)对其质量浓度(X,μg/L)作标准曲线,双酚A的线性方程、线性范围、相关系数和检出限见表2。
本实验采用空白样品加标法以信噪比RSN≥3确定检出限,双酚A的检出限为2.5 μg/kg。双酚A空白样品及空白样品加标图谱见图7。
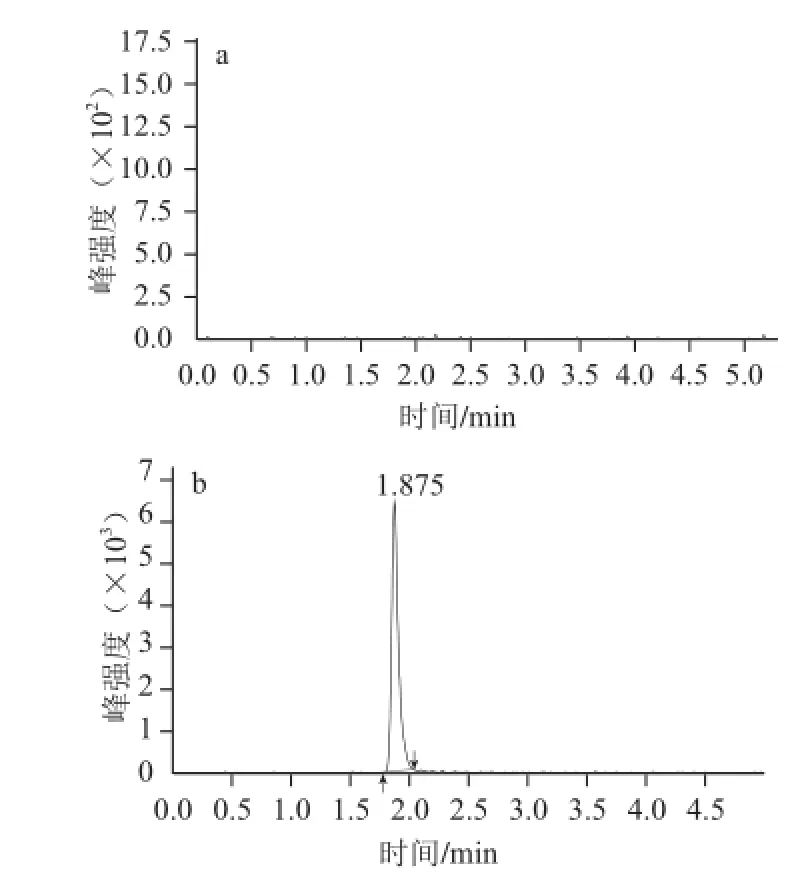
图7 空白样品色谱图(a)及空白样品加标色谱图(b)(2.5 μg/kg)Fig.7 Chromatogram of blank samples (a) and chromatogram of spiked blank samples (b) (2.5 μg/kg)

表2 双酚A的线性方程、相关系数和检出限Table 2 Linear equations, correlation coefficients and LOD of bisphenooll AA
2.6 回收率和精密度
采用3 种空白样品(纸餐盒、纸杯和复合纸罐)加标的方式进行回收率实验,分别添加低、中、高3 个质量浓度水平后,进行微波辅助萃取,经富集净化后浓缩,每个质量浓度平行测定6 次,同时采用空白基质匹配标准溶液法制备3 种空白样品标准系列溶液,计算回收率和相对标准偏差,结果见表3。结果表明,在不同的添加质量浓度条件下,双酚A的平均回收率稳定在90.5%~98.6%,相对标准偏差均低于5.6%。
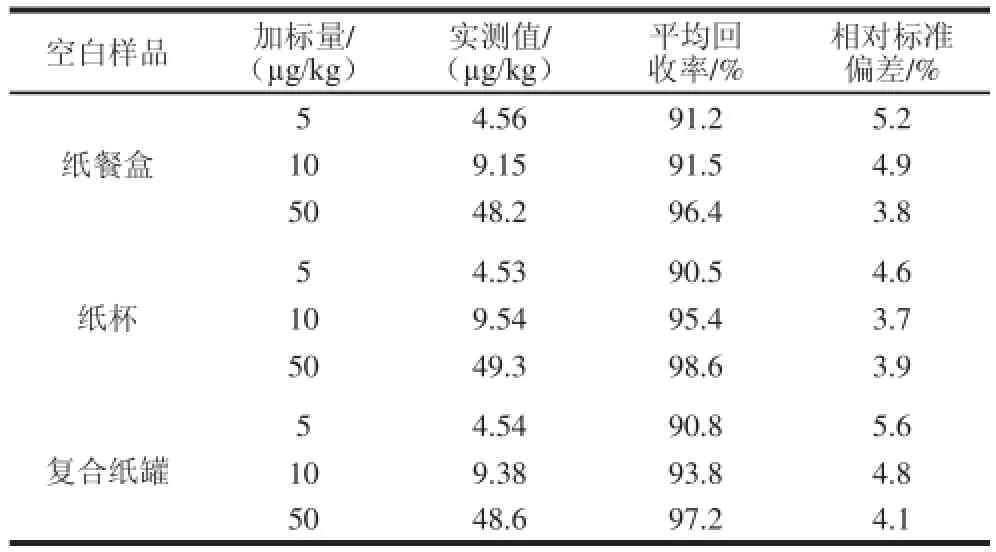
表3 空白样品中双酚A的加标回收率和精密度(n=6)Table 3 Spiked recoveries of bisphenol A in blank samples (n = 6)
2.7 实际样品的检测
用建立的方法对目前市场在售的食品用纸容器共计15 批次进行检测,均未检出双酚A。
3 结 论
该方法采用微波辅助萃取,Sep-Pak C18固相萃取柱净化,液相色谱-质谱法对食品用纸容器中双酚A的测定进行了研究。本方法的回收率、检出限和精密度等各项技术指标均符合要求,该方法具有操作简便、检出限低、准确度高、污染小的特点,在食品用纸容器中双酚A的检测及确证方面有着较高的实用价值和应用前景。
[1] TAN Feng, ZHAO Hongxia, LI Xiaona, et al. Preparation and evaluation of molecularly imprinted solid-phase microextraction fibers for selective extraction of bisphenol A in complex samples[J]. Journal of Chromatogr A, 2009, 1216(30): 5647-5654.
[2] 林福华, 黄晓佳, 袁东星. 分子印迹聚合物为涂层的吸附萃取搅拌棒在环境水样双酚A含量测定中的应用[J]. 色谱, 2010, 28(5): 507-512.
[3] 黄少婵, 杭义萍. 液相色谱-质谱法同时测定塑料制品中的双酚A和四溴双酚A[J]. 色谱, 2010, 28(9): 863-866.
[4] 赵美萍, 李元宗, 常文保. 酚类环境雌激素的分析研究进展[J]. 分析化学, 2003, 31(1): 103-109.
[5] 吴新华, 丁利, 肖家勇, 等. 单分散磁性亚微米粒子固相萃取-液相色谱-串联质谱法测定牛奶中的双酚A[J]. 色谱, 2011, 29(5): 399-403.
[6] THEOBALD A, SIMONEAU C, HANNAERT P, et al. Occurrence of bisphenol F diglycidyl ether (BFDGE) in canned fish in oil[J]. Food Additives and Contaminants, 2000, 17(10): 881-887.
[7] ANA B G, SOLEDAD R, DOLORES P B. Analytical methods for the determination of bisphenol A in food[J]. Journal of Chromatography A, 2009, 1216(3): 449-469.
[8] YOSHIDA T, HORIE M, HOSHINO Y, et al. Determination of bisphenol A in canned vegetables and fruit by high performance liquid chromatography[J]. Food Additives and Contaminants, 2001, 18(1): 69-75.
[9] 吴淑燕, 许茜, 陈天舒. 尼龙6纳米纤维膜固相膜萃取-高效液相色谱法测定塑料瓶装矿泉水中双酚A[J]. 分析化学, 2010, 38(4): 503-507.
[10] 王丽婷, 周围, 王波, 等. 固相萃取-高效液相色谱荧光检测法测定一次性纸杯和桶装方便面盒中的双酚A[J]. 中国卫生检验杂志, 2013, 23(17): 3340-3347.
[11] 孙秀武, 张元标, 林辉, 等. 高效液相色谱法同时测定环境水体中的双酚A、辛基酚和壬基酚[J]. 分析科学学报, 2013, 29(2): 149-153.
[12] IMANAKA M, SASAKI K, NEMOTO S, et al. Determination of bisphenol A in canned foods by GC/MS[J]. Journal of Food Hygienic Society of Japan, 2001, 42(2): 71-78.
[13] 高永刚, 张艳艳, 高建国, 等. 衍生化气相色谱-质谱法测定玩具和食品接触材料中双酚A[J]. 色谱, 2010, 30(10): 1017-1020.
[14] 陈啟荣, 魏岩, 郎爽, 等. 加速溶剂萃取/气相色谱-质谱法测定糖果包装材料中的双酚A[J]. 食品科学, 2010, 31(6): 165-167.
[15] 卫碧文, 缪俊文, 于文佳. 气相色谱-质谱法分析食品包装材料中双酚A[J]. 分析实验室, 2009, 28(1): 107-109.
[16] SHAO Bing, HAN Hao, TU Xiaoming. Analysis of alkylphenol and bisphenol A in eggs and milk by matrix solid phase dispersion extraction and liquid chromatography with tandem mass spectrometry[J]. Journal of Chromatography B, 2007, 850(1): 412-416.
[17] TOLLBACK J, CRESCENZI C, DYREMARK E. Determination of the flame retardant tetrabromobisphenol A in air samples by liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2006, 1104(1): 106-112.
[18] HORIE M, YOSHIDA T, ISHII R, et al. Determination of bisphenol A in canned drinks by LC/MS[J]. Bunseki Kagaku, 1999, 48: 579-587.
[19] CARABIAS M, RODRIGUEZ G, REVILLA R. Determination of endocrine-disrupting compounds in cereals by pressurized liquid extraction and liquid chromatography-mass spectrometry study of background contamination[J]. Journal of Chromatography A, 2006, 1137(2): 207-215.
[20] 马强, 白桦, 王超. 液相色谱-串联质谱法同时测定纺织品和食品包装材料中的壬基酚、辛基酚和双酚A[J]. 分析化学, 2010, 38(2): 197-201.
Determination of Bisphenol A in Paper Food Containers by Ultra Performance Liquid Chromatography and Tandem Mass Spectrometry
MA Xiao-fei1, SONG Wei2, LIANG Tian-zuo1, JIA Zhen-guo1, ZHANG Yan1,*
(1. Hebei Institute of Food Quality Supervision Inspection and Research, Shijiazhuang 050091, China; 2. Hebei Provincial Institute for Food and Drug Control, Shijiazhuang 050011, China)
A method for the determination of bisphenol A in paper food containers by ultra performance liquid chromatography and tandem mass spectrometry (UPLC-MS-MS) after microwave-assisted extraction was developed. Sample extracts were purification on a Sep-Pak C18column. The target compound was separated on a Kinetex C18(2.1 mm × 100 mm, 2.6 μm) column using methanol-water (containing 0.05% ammonia water) as the mobile phase with gradient elution, and detected by MS with electrospray ionization (ESI) under a multiple reaction-monitoring mode. In the range of 1.0 to 100.0 μg/L, the calibration curve developed showed good linearity with correlation coefficients (r²) of 0.999 7. The recoveries for spiked samples were 90.5%-98.6% at three levels of 5, 10 and 50 μg/kg, and the relative standard deviations were less than 5.6%. The limit of detection was 2.5 μg/kg. The method proved to be easy to use, timesaving, sensitive and suitable for the determination of bisphenol A residues in food paper containers.
ultra performance liquid chromatography tandem mass spectrometry; bisphenol A; microwave-assisted extraction; paper food containers
R917
A
1002-6630(2014)16-0165-05
10.7506/spkx1002-6630-201416032
2013-10-12
河北省质监局科技计划项目(2012ZD09)
马晓斐(1984—),男,工程师,硕士,主要从事食品中禁用物质及药物残留分析。E-mail:xiaofeima1984@163.com
*通信作者:张岩(1979—),男,高级工程师,博士,主要从事化学危险品安全性评价技术研究。E-mail:snowwinglv@126.com
