肉鸭表皮组织中脱氢枞酸残留的SPE-HPLC检测方法
2014-01-17张苏珍耿志明王道营诸永志张牧焓徐为民
张苏珍,耿志明*,王道营,诸永志,刘 芳,张牧焓,卞 欢,徐为民
肉鸭表皮组织中脱氢枞酸残留的SPE-HPLC检测方法
张苏珍1,2,耿志明2,*,王道营2,诸永志2,刘 芳2,张牧焓2,卞 欢2,徐为民2
(1.南京农业大学 肉品加工与质量控制教育部重点实验室,江苏 南京 210095;2.江苏省农业科学院农产品 加工研究所,江苏 南京 210014)
建立经松香脱毛处理的肉鸭表皮组织中残留脱氢枞酸的固相萃取-高效液相色谱检测方法。肉鸭表皮组织中的脱氢枞酸用乙腈提取,经C18固相萃取小柱净化,以0.003 mol/L磷酸溶液-甲醇(13∶87,V/V)为流动相,采用反相C18(25 0 mm×4.6 mm,5 μm)色谱柱分离,以紫外检测器(检 测波长212 nm)进行检测。结果表明:该方法检测脱氢枞酸线性范围 为0.1~10 mg/L,检测限为0.10 μg/g,定量限为0.33 μg/g。在 低中高3 个添加量范围内回收率为80.8%~91.8%。实际样品分析显示,肉鸭表皮中脱氢枞酸含量最高达10.06 μg/g。所建立的分析方法简便快捷、具有较好的灵敏度和可靠性,可用于肉鸭表皮组织中脱氢枞酸残留量的分析。
肉鸭;松香;脱氢枞酸;高效液相色谱法;固相萃取
脱氢枞酸(亦称脱氢松香酸)是松香的主要成分之一。松香中的枞酸和脱氢枞酸是人们熟知的肺和皮肤致敏剂,可以导致职业哮喘和接触过敏[1],它们的氧化产物被认为是重要的皮肤过敏源[2]。枞酸和脱氢枞酸可以损伤水生生物的DNA活性[3],对水蚤的生长发育有一定的限制作用[4]。细胞毒理学研究表明脱氢枞酸对人体红细胞、多核白细胞有毒性作用[5-9]。脱氢枞酸和枞酸一样,广泛存在于纸浆、造纸 厂废液[10]以及药剂[11-15]、化妆品[16]和工业品中[4],在食品包装材料中也存在有相当浓度的脱氢枞酸和枞酸[17]。脱氢枞酸和枞酸的分析方法主要包括气相色谱法和高效液相色谱(high performance liquid chromatography,HPLC)。采用气相色谱法方法时,样品中的脱氢枞酸和枞酸必须通过衍生化反应转变为甲酯形式,样品处理繁琐、重现性较差[18-19]。HPLC法分析脱氢枞酸和枞酸,无需进行衍生化反应,因而HPLC结合紫外检测器、二极管阵列检测器、荧光检测器以及质谱越来越多地应用于不同样品基质的脱氢枞酸和枞酸含量分析[13,20-23]>。
松香加热后具有良好的黏附性,在我国曾被广泛用于鸭、鹅等水禽加工中的二次脱毛工序。2009年,我国颁布实施《食品安全法》,禁止在畜禽加工过程中使用松香。但是,由于GB/T 2760—2007《食品添加剂使用卫生标准》中允许使用的松香甘油酯脱毛效果不理想、且成本高,少数水禽加工作坊仍然非法采用松香用于鸭、鹅等脱毛加工,导致枞酸、脱氢枞酸残留在鸭、鹅的表皮组织中,给消费者带来严重的健康隐患。
为了研究松香主要成分在采用松香脱毛的鸭、鹅中的残留,本课题组在前期研究中已建立了鸭表皮组织中枞酸的残留含量的测定方法[24]。与枞酸相比,脱氢枞酸(图1)具有更强的极性和不同的最佳紫外吸收波长。本研究在建立枞酸检测方法的基础之上,通过固相萃取法对样品进行净化,采用高效液相色谱法对脱氢枞酸进行检测分析,建立了肉鸭表皮组织中脱氢枞酸的定量检测方法。本方法具有操作便捷、灵敏度高、自动化程度高等优点,可用于经松香脱毛处理的水禽中脱氢枞酸残留的分析检测。本实验建立的方法可以和前期建立的枞酸残留检测方法互为验证,共同用于监控肉鸭加工中松香的非法使用、以及流通环节中违法使用松香脱毛肉鸭的鉴别。

图1 脱氢枞酸分子结构Fig.1 Molecular structure of dehydrogenated abietic acid
1 材料与方法
1.1 材料与试剂
阴性和阳性样本,肉鸭来自农贸市场,宰杀后分别采用人工脱毛(阴性样本)和松香脱毛(阳性样本);实际肉鸭样本分别来源于畜禽屠宰加工企业F和附近一家农贸市场。所有样本取不同部位表皮组织,切碎,混合均匀,于-20 ℃条件下保存。
脱氢枞酸标准品(纯度95%) 加拿大CSC公司;乙腈、甲醇(均为色谱纯) 美国Tedia公司;其余试剂为分析纯;水由Millipore纯水仪制备;C18固相萃取(solid phase extraction,SPE)小柱 美国Supelco公司。
标准溶液储备液以及工作溶液配制:称取适量脱氢枞酸标准品,用甲醇溶解,配制100 mg/L脱氢枞酸储备液。用移液管吸取适量标准储备溶液,用流动相(0.003 mol/L磷酸溶液-甲醇,13∶87,V/V)稀释配制质量浓度为0.1、0.5、1、2、5、10 mg/L的脱氢枞酸系列工作溶液。
1.2 仪器与设备
Ultimate-3000高效液相色谱戴安(配有VWD-3000紫外(ultraviolet detector,UV)检测器、Chromeleon色谱管理系统软件)、LPG-3400SD四元分析泵、WPS-3000SL自动进样器 美国Dionex公司;Xtimate C18色谱柱 美国Welch公司;Biofuge stratus高速离心机 德国Heraeus公司;HS2060A超声波振荡器 常州国华电器有限公司;PX-12固相萃取装置 天津谱祥科技有限公司。
1.3 方法
1.3.1 样品处理
样品处理参照文献[24]方法。
1.3.2 色谱条件
色谱柱:C18柱(250 mm×4.6 mm,5 μm);流动相:0.003 mol/L磷酸溶液-甲醇(13∶87,V/V);流速:1 mL/min;柱温:25 ℃;检测波长:212 nm;进样量:20 μL。
1.3.3 精密度实验
称取充分混合均匀的阳性样品7 份,按照上述样品处理方法处理、并进行HPLC测定,以测定的结果计算相对标准偏差(relative standard deviation,RSD)。
1.3.4 回收率实验
称取阴性表皮样品1 g于10 mL离心管中,分别添加不同量脱氢枞酸标准溶液(5 mg/L),并在室温条件下放置1 h(使脱氢枞酸渗透至样品中)。按照上述样品处理方法处理、并进行HPLC测定,以测定的脱氢枞酸量和添加量之比计算回收率。
2 结果与分析
2.1 色谱条件的优化
脱氢枞酸在200 nm有最大吸收峰[13],此外在276 nm波长处有次强吸收峰,但强度比200 nm波长处收弱得多[25]。在采用HPLC-UV进行分析时,在200 nm分析目标物会受到样品基质的干扰,通常适当增加检测波长,以获得理想的灵敏度和选择性。为了获得最佳检测波长,本实验采用多波长UV检测器同时观察了脱氢枞酸标准溶液和阳性样本在212、224、268、276 nm的吸收。随着波长的增加,脱氢枞酸吸收强度急剧下降,1 mg/L的标准溶液4波长处的信噪比分别为78、52、12和16。由于采用SPE净化手段,4 波长处样品基质对脱氢枞酸的干扰均比较少。本方法选择212 nm为检测波长,在此波长处脱氢枞酸与基质干扰峰达到基线分离,具有最好的灵敏度(图2)。

图2 样品的高效液相色谱图Fig.2 HPLC chromatograms of samples
脱氢枞酸和枞酸是二萜类化合物,但脱氢枞酸具有更强的极性。流动相由0.003 mol/L磷酸溶液和甲醇组成,在实验中观察二者比例对脱氢枞酸在反相C18色谱柱上保留时间的影响,结果表明流动相中甲醇比例显著影响脱氢枞酸保留时间,流动相中甲醇比例在12%~15%范围内,脱氢枞酸有较适中的保留时间。实验中还观察温度、流速对脱氢枞酸在C18柱上的保留行为的影响,二者对脱氢枞酸的保留时间有一定影响,但对检测灵敏度影响不大。最终确定的最佳色谱条件为流动相0.003 mol/L磷酸溶液-甲醇(13∶87,V/V)、流速1 mL/min、柱温25 ℃、检测波长212 nm,在此条件下,脱氢枞酸保留时间约12.40 min,与基质干扰可以基线分离。
2.2 方法的线性范围、检测限和定量限
本实验建立的方法通过标准曲线、以外标法定量样品中的脱氢枞酸含量。以脱氢枞酸系列工作溶液的质量浓度 为横坐标X,相应的峰面积为纵坐标Y,得回归方程Y = 0.682 2X+0.170 5,线性相关系数R²= 0.999 1。由此可见在0.1~10 mg/L范围内,脱氢枞酸质量浓度与峰面积呈良好的线性关系。按照3倍信噪比(RSN=3)和10倍信噪比(RSN=10)计算方法的检测限和定量限,分别为0.10 μg/g和0.33 μg/g。
2.3 方法的精密度和回收率
为了验证本实验建立的肉鸭表皮组织中脱氢枞酸含量检测方法,本实验采用松香脱毛的肉鸭为阳性样本、人工脱毛的肉鸭为阴性样本,分别进行精密度和添加回收实验(表1)。其中,阳性肉鸭表皮组织中脱氢枞酸含量为2.69 μg/g(检测值分别为2.73、2.75、2.71、2.75、2.71、2.66、2.53 μg/g),精密度实验RSD为2.83%;在不同水平的阴性样品添加回收实验中,脱氢枞酸的回收率为80.8%~91.8%。结果表明,本实验建立的肉鸭表皮组织中脱氢枞酸含量检测方法具有良好的重复性和准确性。

表1 脱氢枞酸不同添加水平回收率测定结果(n=3)Table 1 Recoveries of dehydrogenated abietic acid spiked at different levellss (n=3)
2.4 实际样品分析
为了进一步验证本实验建立的肉鸭表皮组织中脱氢枞酸含量检测方法,本实验分析了来源于畜禽屠宰加工企业(F)和农贸市场的15个肉鸭样本表皮组中的脱氢枞酸含量,结果列于表2。
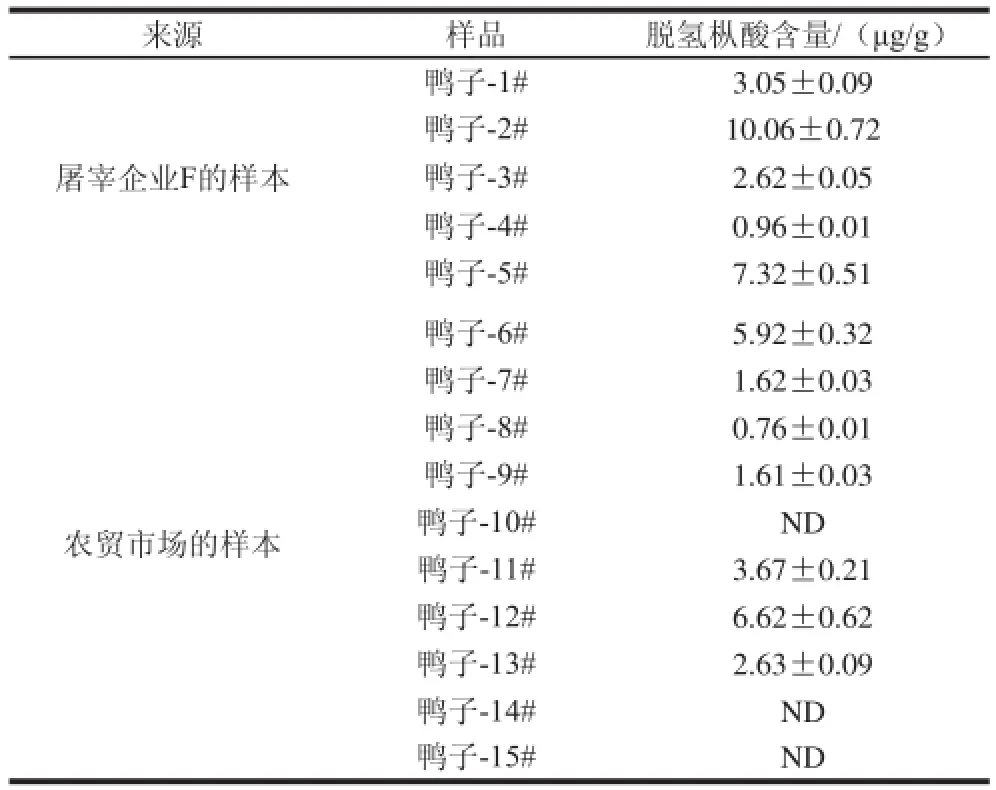
表2 实际样品分析结果(n=3)Table 2 Contents of dehydrogenated abietic acid in commercial sampleess (n=3)
畜禽屠宰加工企业(F)5 个样品中均发现含有脱氢枞酸,含量范围0.96~10.06 μg/g,阳性率100%;农贸市场的10 个样品中7 个检出脱氢枞酸,含量范围0.76~6.62 μg/g,阳性率70%。从检出的脱氢枞酸含量看,变化范围较大,应该与生产加工过程中脱毛剂配方中松香含量、以及脱毛工艺(温度、时间)有关,这一检测结果也与前期的研究结果基本一致[18]。这一分析结果进一步说明,虽然我国在2009年明令禁止使用松香进行畜禽加工脱毛,但仍有相当多的企业在违法使用松香进行水禽脱毛加工。除了加工企业片面最求利益外,监管部门缺乏相关监测分析手段也是造成这一现象的重要原因。因此,在进一步宣传相关从业企业、人员遵纪守法外,加强水禽生产加工过程中非法使用脱毛剂的监管、以及流通环节中肉鸭等产品中枞酸、脱氢枞酸的检测,对于杜绝松香脱毛肉鸭进入百姓餐桌、保护消费者身体健康尤为重要。
3 结 论
本实验建立了肉鸭表皮组织中脱氢枞酸含量的检测方法,样品中的脱氢枞酸经乙腈超声波提取、C18SPE小柱净化,然后以0.003 mol/L磷酸溶液-甲醇(13∶87,V/V)为流动相、在反相C18柱上进行分离,用UV检测器在212 nm进行检测。线性范围0.1~10 mg/L,最低检测限和定量限分别为0.10 μg/g和0.33 μg/g。精密度和添加回收实验表明,建立的肉鸭表皮组织中脱氢枞酸含量的检测方法,具有良好的重现性和准确性。畜禽加工企业及农贸市场的实际肉鸭样本中脱氢枞酸含量的分析结果表明,仍然有畜禽加工企业违法利用松香进行水禽脱毛。本实验建立的肉鸭表皮中脱氢枞酸的高效液相色谱检测方法,可以和前期建立的枞酸残留检测方法互为验证,同时用于生产过程中违法使用松香的监管、以及流通环节中肉鸭等产品中脱氢枞酸的检测,对于确保肉鸭制品质量安全具有一定的技术参考意义。
[1] SMITH P A, GARDNER D R, DROWN D B, et al. Detection of resin acid compounds in airborne particulate generated from rosin used as a soldering flux[J]. American Industrial Hygiene Association Journal, 1997, 58(12): 868-875.
[2] KARLBERG A T, BOMAN A, HACKSELL U, et al. Contact allergy to dehydroabietic acid derivatives isolated from Portuguese colophony[J]. Contact Dermatitis, 1988, 19(3): 166-174.
[3] OZAKI A, yAMAGUCHI y, FUJITA T, et al. Safety assessment of paper and board food packaging: chemical analysis and genotoxicity of possible contaminants in packaging[J]. Food Additives and Contaminants, 2005, 22(10): 1053-1060.
[4] KAMAyA y, TOKITA N, SUZUKI K. Effects of dehydroabietic acid and abietic acid on survival, reproduction, and growth of the crustacean Daphnia magna[J]. Ecotoxicology and Environmental Safety, 2005, 61(1): 83-88.
[5] OZAKI A, OOSHIMA T, MORI y. Migration of dehydroabietic and abietic acids from paper and paperboard foo d packaging into food-simulating solvents and Tenax TA[J]. Food Additives and Contaminants, 2006, 23(8): 854-860.
[6] TAVENDALE M H, MCFARLANE P N, MACKIE K L, et al. The fate of resin acids-1. The biotransformation and degradation of deuterium labelled dehydroabietic acid in anaerobic sediments[J]. Chemosphere, 1997, 35(10): 2137-2151.
[7] NESTMANN E R, LEE E G, MATULA T I, et al. Mutagenicity of constituents identified in pulp and paper mill effluents using the Salmonella/mammalian-microsome assay[J]. Mutation Research/ Genetic Toxicology, 1980, 79(3): 203-212.
[8] SUNZEL B, SÖDERBERG T A, REUTERVING C, et al. Neutralizing effect of zinc oxide on dehydroabietic acid-induced toxicity on human polymorphonuclear leukocytes[J]. Biological Trace Element Research, 1991, 30(3): 257-266.
[9] SÖDERBERG T A, JOHANSSON A, GREF R. Toxic effects of some conifer resin acids and tea tree oil on human epithelial and fi broblast cells[J]. Toxicology, 1996, 107(2): 99-109.
[10] LISS S N, BICHO P A, SADDLER J N. Microbiology and biodegradation of resin acids in pulp mill effl uents: a minireview[J]. Canadian Journal of Microbiology, 1997, 43(7): 599-611.
[11] 仇雅静. 高效液相色谱法检查骨筋丸胶囊中非法添加的枞酸[J]. 中国药业, 2011, 20(4): 39-40.
[12] 肖聪, 饶伟文, 钟名诚. 没药掺伪品中枞酸的检测方法研究[J]. 中药材, 2012, 35(8): 1237-1241.
[13] LEE B L, KOH D, ONG H y, et al. High-performance liquid chromatographic determination of dehydroabietic and abietic acids in traditional Chinese medications[J]. Journal of Chromatography A, 1997, 763(1): 221-226.
[14] 李富贤, 米彩峰, 石会丽. RP-HPLC测定清毒素胶囊中枞酸的含量[J].中国中药杂志, 2008, 33(9): 1086-1087.
[15] 赵江红. 高效液相色谱法鉴定29 批血竭中非法添加的3 种化学成分[J]. 中医研究, 2011, 24(8): 17-19.
[16] LEE B L, ONG H y, KOH D, et al. High-performance liquid chromatographie method for determination of dehydroabietic and abietic acids, the skin sensitizers in bindi adhesive[J]. Journal of Chro matography A, 1994, 685(2): 263-269.
[17] OZAKI A, yAMAGUCHI y, FUJITA T, et al. Chemical ana lysis and genotoxicological safety assessment of paper and paperboard used for food packaging[J]. Food and Chemical Toxicology, 2004, 42(8): 1323-1337.
[18] PENG G, ROBERTS J C. Solubility and toxicity of resin acids[J]. Water Research, 2000, 34(10): 2779-2785.
[19] VOLKMAN J K, HOLDSWORTH D G, RICHARDSON D E. D etermination of resin acids by gas chromatography and highperformance liquid chromatography in paper mill effl uent, river waters and sediments from the upper Derwent Estuary, Tasmania[J]. Journal of Chromatography A, 1993, 643(1): 209-219.
[20] SMITH P A, SON P S, CALLAGHAN P M, et al. Sampling and analysis of airborne resin acids and solvent-soluble material derived from heated colophony (rosin) flux: a method to quantify exposure to sensitizing compounds liberated during electronics soldering[J]. Toxicology, 1996, 111(1): 225-238.
[21] KERSTEN P J, KOPPER B J, RAFFA K F, et al. Rapid analysis of abietanes in conifers[J]. Journal of Chemical Ecology, 2006, 32(12): 2679-2685.
[22] SADHRA S, GRAy C N, FOULDS I S. High-performance liquid chromatography of unmodified rosin and its applications in contact dermatology[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1997, 700(1): 101-110.
[23] NILSSON U, BERGLUND N, LINDAHL F, et al. SPE and HPLC/ UV of resin acids in colophonium-containing products[J]. Journal of Separation Science, 2008, 31(15): 2784-2790.
[24] 张苏珍, 耿志明, 王道营. 固相萃取-高效液相色谱法检测肉鸭表皮组织中的松香酸[J]. 食品科学, 2014, 35(4): 82-85.
[25] 南京林产工业学院. 林产化学工业手册[M]. 北京: 中国林业出版社, 1980: 96-97.
Development of SPE-HPLC Method for Determination of Dehydrogenated Abietic Acid Residue in Duck Skin Tissue
ZHANG Su-zhen1,2, GENG Zhi-ming2,*, WANG Dao-ying2, ZHU Yong-zhi2, LIU Fang2, ZHANG Mu-han2, BIAN Huan2, XU Wei-min2
(1. Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China; 2. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
A high-performance liquid chromatographic (HPLC) method was established to determine dehydrogenated abietic acid in duck skin. Dehydrogenated abietic acid in duck skin sample was extracted with acetonitrile, followed by purifi cation with a C18solid-phase extraction (SPE) cartridge, and detected by HPLC-ultraviolet detector (UV). The chromatographic conditions were as follows: column, reversed-phase C18(250 mm × 4.6 mm, 5 μm); mobile phase, a mixture of 0.003 mol/L phosphoric acid-methanol (13:87, V/V); fl ow rate, 1.0 mL/min; and detection wavelength, 212 nm. Results indicated that the linearity ranged from 0.1 to 10.0 mg/L, and the detection limit and the quantifi cation limit were 0.10 μg/g and 0.33 μg/g, respectively. The recoveries of dehydrogenated abietic acid spiked at 0.5-20 μ g/g were in the range of 80.8%-91.8%. The method was successfully applied for the determination of dehydrogenated abietic acid in rosin-defeathered duck skin, and the result indicated that content of dehydrogenated abietic acid in th e duck sample could reach 10.06 μg/g. The present method proved to be of high maneuverability and excellent sensitivity and accuracy, and could be employed to analyze dehydrogenated abietic acid residue in duck skin tissue.
duck; rosin; dehydrogenated abietic a cid; high-performance liquid chromatographic (HPLC); solid polymer electrolyte (SPE)
TS201.5
A
1002-6630(2014)16-0101-04
10.7506/spkx1002-6630-201416019
2013-08-28
国家自然科学基金青年科学基金项目(31101312);江苏省农业科技自主创新资金项目(CX(13)3081)
张苏珍(1988—),女,硕士研究生,研究方向为食品科学。E-mail:xsdzsz@126.com
*通信作者:耿志明(1965—),男,副研究员,硕士,研究方向为食品化学。E-mail:zmgeng@163.com
