五大连池地区香鳞毛蕨自然越冬特性研究
2014-01-16常缨李艳安玉婷张志美王鹤萌张微
常缨,李艳,安玉婷,张志美,王鹤萌,张微
(东北农业大学生命科学学院,哈尔滨 150030)
五大连池地区香鳞毛蕨自然越冬特性研究
常缨,李艳,安玉婷,张志美,王鹤萌,张微
(东北农业大学生命科学学院,哈尔滨 150030)
探讨黑龙江省五大连池地区香鳞毛蕨越冬机制,对其自然越冬过程中的生理生化特性及超微结构进行研究。结果表明,香鳞毛蕨相对电导率和MDA含量先增加后减少;POD、CAT两种保护酶活性呈“N”型,SOD活性先降低后升高;脯氨酸和可溶性糖含量均呈“N”型变化,可溶性蛋白含量变化不明显;ABA含量随温度下降而上升,GA3、IAA含量与ABA趋势相反;叶片中的叶绿体,体积膨胀变形,基粒片层逐渐不清晰,但未全部解体;线粒体内脊数量明显减少,双层膜结构破坏严重,膜边界模糊,直至膜遭到严重破坏,解体消失。
香鳞毛蕨;自然越冬;生理机理;保护酶;抗寒性
香鳞毛蕨(Dryopteris fragrans(L.)Schott)是多年生蕨类植物,以黑龙江省为分布中心,在塔河县白卡鲁山、呼中的大白山高地、牡丹江镜泊湖及小兴安岭北部高寒地区均有分布,特别是在五大连池地区分布广泛[1]。香鳞毛蕨生境特殊,生长于火山喷发后形成的滑石坡、火山周围岩浆缝中,在低温环境可生存[2]。近年来,研究发现香鳞毛蕨对皮肤病、类风湿性关节炎、抑菌等具有很好疗效[3-5],是极具开发潜力和应用前景的珍稀天然药用植物资源,但其药材来源靠野生采挖,由于人类盲目采收以及对熔岩环境的破坏致使香鳞毛蕨资源不断减少,野生资源正遭到严重破坏。
植物在自然越冬过程中对低温逆境有一个适应和自我调节过程,低温促使植物细胞发生一系列生理生化变化[6-8]。低温严重影响香鳞毛蕨的正常生长发育,野生香鳞毛蕨主要依靠根状茎进行繁殖并且能自然越冬,独特的生理特性增加了香磷毛蕨对低温的适应能力。
本试验探究五大连池地区野生香鳞毛蕨自然越冬期间的低温生理学适应机制,探讨低温对香鳞毛蕨生长发育过程生理生化反应的影响,对香鳞毛蕨低温胁迫下的叶片进行超微结构体观察,为进一步了解香鳞毛蕨生长机制、指导生产实践提供可靠的理论依据,对香鳞毛蕨野生资源低温保护和可持续利用具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试验样地越冬期间的气温变化
五大连池市位于黑龙江省北部,黑河市南部,地处小兴安岭与松嫩平原的过渡地带。东起东经127°37′,西至125°42′;南起北纬48°16′,北至49°12′。五大连池气候特征是冬长夏短,低温冷湿,年平均气温0℃左右,年平均降水量500 mm左右。平均海拔高度为250~300 m,属寒温带大陆性季风气候,夏季较炎热,最高日温可达34℃,多见于6~8月;冬季较冷,气温一般在-20℃左右,最低日温可达-36℃,无霜期121 d。
根据采集样品实际测量结果表示,2011~2012年越冬期,五大连池二池地区最高气温出现在2011年10月中旬,为5.8℃,随后气温大幅度下降,到翌年1月左右气温达到最低值,为-28℃,2012年2月、2012年3月气温基本与2011年11月、2011年12月气温保持一致,2012年3月气温回升到0℃,越冬期的6个月平均气温为-7.6℃。各采样日气温变化如图1所示。

图1 各采样日期的气温变化Fig.1 Temperature records at each sampling date
1.1.2 材料来源
野生香鳞毛蕨孢子体植株于2011年10月至2012年3月每个月中旬赴黑龙江省五大连池二池火山岩地区采集,采集时间及外部形态如表1所示;每次选取长势相同的整株香鳞毛蕨植株10株,混合后分装并标记,迅速放入液氮中冷冻,-80℃保存备用。每个样品3次重复。

表1 香鳞毛蕨越冬期间外部形态变化Table 1 Changes of Dryopteris fragrans external morphology during the winter
1.2 方法
1.2.1 测定指标及方法
相对电导率(Electrical conductivity)采用电导仪法测定[9];丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸比色法测定[10];超氧化物歧化酶(Superoxide dismutase,SOD)采用氮蓝四唑比色法测定[10];过氧化物酶(Peroxidase,POD)活性采用愈创木酚比色法测定[10];过氧化氢酶(Catalase,CAT)采用碘量法测定[11];可溶性蛋白含量采用考马斯亮蓝G-250比色法测定[11];可溶性糖含量采用蒽酮比色法测定[12];脯氨酸含量采用磺基水扬酸提取茚三酮比色法测定[12];参照植物生理学实验技术高效液相色谱法[13]测定脱落酸(Abscisic Acid,ABA)、吲哚乙酸(Indole-3-acetic acid,IAA)、赤霉素(Gibberellin,GA3)含量,用美国Waters 600型高效液相色谱仪测定,测定条件流动相为100%甲醇-水-冰乙酸(体积比为45:54.2:0.8)混合液,流速为1.0 mL·min-1,柱温为室温,进样量为20 μL,检测波长为254 nm,定量方法为外标标准曲线法。每个样品3次取样,3次测量重复。
1.2.2 叶片超微结构观察方法
采用透射电镜方法[14]对香鳞毛蕨叶片超微结构进行观察,对越冬期间香鳞毛蕨叶片叶肉部位进行取样,并用戊二醛进行前固定,经过清洗、后固定、清洗、脱水、浸透、包埋、修块、切片、染色等过程,最后在透射电镜下对香鳞毛蕨叶片叶绿体和线粒体进行观察并拍照。
1.2.3 数据分析及图像处理软件
数据均用Microsoft Excel 2003进行计算并制图,SPSS11.5对试验数据进行统计分析,采用单因素方差分析进行差异显著性分析,并对各指标进行相关分析。
2 结果与分析
2.1 越冬期间香鳞毛蕨质膜相对透性和膜脂过氧化的动态变化
2.1.1 质膜相对透性的动态变化
在低温下植物的膜结构受到破坏,破坏程度随温度的降低而增加,膜的破坏程度可以通过细胞内电解质外渗率,即相对电导率大小判断。香鳞毛蕨在自然越冬期间相对电导率的总体动态变化趋势表现为先升后降。如表2所示,从2011年10月五大连池地区气温开始持续下降,冬长夏短的气候特征导致深冬季节环境温度变化不大,随着自然降温过程中温度的降低和低温持续时间的延长表现为电导率不断升高,在2011年12月到2012年2月,香鳞毛蕨电导率处于较平稳趋势,分别为0.33、0.35、0.34,在2012年1月测量值达到最大,2月到3月期间,随温度的回升,电导率降至0.23。

表2 自然越冬过程中香鳞毛蕨各项生理指标的动态变化Table 2 Dynamic change of various physiological indices of Dryopteris fragrans during the winter
2.1.2 膜脂过氧化的动态变化
植物在逆境胁迫过程中,膜脂过氧化的中间产物自由基和最终产物MDA都会严重损伤生物膜。所以,MDA是膜系统受害的标志之一,也用于评价植物对低温条件反应的强弱。如表2所示,在自然越冬过程中随着自然温度的下降,2011年10月到2012年1月MDA活性升高,低温胁迫加剧膜脂过氧化强度,导致MDA含量由7.63 μg·g-1缓慢增加至11.9 μg·g-1,增加幅度为55.9%;2012年2月至2012年3月,随着温度的持续回升和低温胁迫逐渐解除,MDA含量也因此从11.25 μg·g-1缓慢下降至10.00 μg·g-1,下降幅度为12.5%。
2.2 越冬期间香鳞毛蕨保护酶活性的动态变化
2.2.1 超氧化物歧化酶(SOD)活性的变化
SOD是活性氧清除剂中的核心成员,在低温逆境条件下,SOD能被活性氧诱导产生,从而减轻细胞膜的受害程度。在自然越冬过程中,香鳞毛蕨中SOD活性随着环境温度的变化,总体上呈现小幅度的先降后升变化趋势,结果如表2所示。在低温胁迫下,调节适应机制的局限性,超过一定限度,从2011年10月开始,SOD酶活性开始随温度的降低逐渐变弱,2012年1月达到最低值90 U·g-1。2012年2月温度回升后,香鳞毛蕨植株进入生长阶段,SOD活性逐渐升高,促进香鳞毛蕨生长,3月达到最高值210 U·g-1。
2.2.2 过氧化物酶(POD)活性的变化
在自然越冬中,如表2所示,香鳞毛蕨中POD酶活性随时间的变化总体呈类似“N”型变化趋势。2011年11月POD酶活性升高到31.19 U·g-1·min-1,表明随着温度的降低,香鳞毛蕨细胞中H2O2大量积累,从而香鳞毛蕨细胞中POD酶活性逐渐增强,清除过剩的H2O2,保护香鳞毛蕨组织细胞免受伤害。在2011年12月至2012年2月,POD酶活性一直处于较低水平,最低值出现在2月,为18.67 U·g-1·min-1。随着温度回升,POD活性开始变强,2012年3月值为25 U·g-1·min-1。
2.2.3 过氧化氢酶(CAT)活性的变化
在整个自然越冬采样期,如表2所示,CAT酶活性同样呈先升后降再上升的变化趋势。2011年11月CAT酶活性从84.15 U·g-1·min-1增加至97 U· g-1·min-1,表明随着温度的降低,香鳞毛蕨细胞中H2O2大量积累,植物为减轻和防止H2O2对细胞的伤害,CAT活性逐渐增强,清除过剩的H2O2,保护香鳞毛蕨组织细胞免受伤害。随后CAT活性开始下降,到2012年2月,一直维持较低活性,2012年2月以后,随气温回升,CAT活性开始变强,2012年3月达到最高值125.66 U·g-1·min-1。
2.3 越冬期间香鳞毛蕨渗透调节物含量的动态变化
2.3.1 可溶性蛋白含量的变化
随着温度降低,如表2所示,香鳞毛蕨中可溶性蛋白含量呈现上升趋势,2011年11月含量达到1.89 μg·g-1。但随着越冬时间的持续,可溶性蛋白含量小幅度降低,说明香鳞毛蕨在抵御外界环境的变化时,导致部分蛋白质发生降解,2011年12月以后,可溶性蛋白虽然仍在减少,但变化幅度相对较小,整体趋势趋于平缓。
2.3.2 可溶性糖含量的变化
在自然越冬过程中,如表2所示,香鳞毛蕨内可溶性糖含量随自然温度的变化总体表现出“N”型变化趋势。2011年10~11月,香鳞毛蕨能够在低温诱导下通过增加组织中可溶性糖的含量增强细胞保水能力以获得低温适应性,可溶性糖含量为72.03~74.91 μg·g-1,含量升高7%。随着寒冬的到来,可溶性糖含量维持在较低水平,随后3个月里,可溶性糖含量缓慢降低,最低值出现在2012年2月,为24.5 μg·g-1。之后随着温度回升,可溶性糖含量提高到49.56 μg·g-1,为提高香鳞毛蕨细胞的吸水能力,适应初春温度变化提供生理条件。
2.3.3 脯氨酸含量的变化
在自然越冬过程中,如表2所示,香鳞毛蕨中脯氨酸含量呈现先降后升再下降的“N”型变化趋势。2011年12月到2012年2月脯氨酸含量一直保持在较低水平,最低值达到25 μg·g-1,之后随着温度的升高升高到46.66 μg·g-1,有助于香鳞毛蕨在较低温度下生长,说明香鳞毛蕨在受到低温胁迫后,迅速调节体内渗透能力以适应环境变化,从而减少低温对细胞的伤害。但随着胁迫时间的持续,脯氨酸含量达到峰值后又有所下降,这可能是由于低温胁迫条件下碳水化合物供应受阻,影响谷氨酸形成,进而影响脯氨酸合成。
2.4 越冬期间香鳞毛蕨叶片内源激素含量的动态变化
2.4.1 越冬过程中香鳞毛蕨ABA含量的变化
如表2所示,在越冬过程中,香鳞毛蕨中ABA含量经历先升后降的变化趋势。随着越冬过程中气温的降低,香鳞毛蕨中ABA含量在2011年11月达到最大值23.693 μg·g-1。随后ABA含量逐渐下降,到2012年3月,ABA含量为6.78 μg·g-1,同2011年11月相比,下降71.38%。
2.4.2 越冬过程中香鳞毛蕨IAA含量的变化
如表2所示,香鳞毛蕨中IAA含量呈现先降后升的趋势。随着温度的降低,IAA含量从2011年10月的16.62 μg·g-1下降到2012年1月的1 μg·g-1。然后随着温度回升,IAA含量开始上升,最大值为13.18 μg·g-1。
2.4.3 越冬过程中香鳞毛蕨中赤霉素(GA3)含量的变化
如表2所示,香鳞毛蕨中GA3含量整体上呈现先降后升变化趋势。随着温度的降低,GA3含量从2011年10月的157.21 μg·g-1下降到2012年1月的24.43 μg·g-1。然后随着温度的回升,GA3含量的最大值达到455.12 μg·g-1。
2.5 香鳞毛蕨越冬期间各生理指标相关性分析
如表3所示,在自然越冬过程中,香鳞毛蕨电导率与MDA含量、可溶性糖含量、SOD活性呈现显著正相关,与可溶性蛋白、脯氨酸、POD、CAT、IAA、GA3呈负相关;MDA含量与可溶性蛋白含量呈极显著正相关,与SOD活性显著相关,与脯氨酸含量、POD及CAT活性呈负相关,与IAA活性呈极显著负相关,与GA3呈显著负相关;可溶性蛋白含量与可溶性糖含量、POD活性及IAA、GA3呈负相关,与SOD活性呈显著正相关,与ABA显著相关;可溶性糖与脯氨酸含量、POD及CAT活性、IAA及GA3含量呈负相关;脯氨酸含量与SOD活性、ABA含量呈正相关,与CAT活性呈显著正相关;SOD活性与POD活性呈显著正相关,与ABA含量正相关;POD与CAT活性与ABA含量正相关;ABA与IAA及GA3呈负相关,而IAA和GA3呈显著正相关。
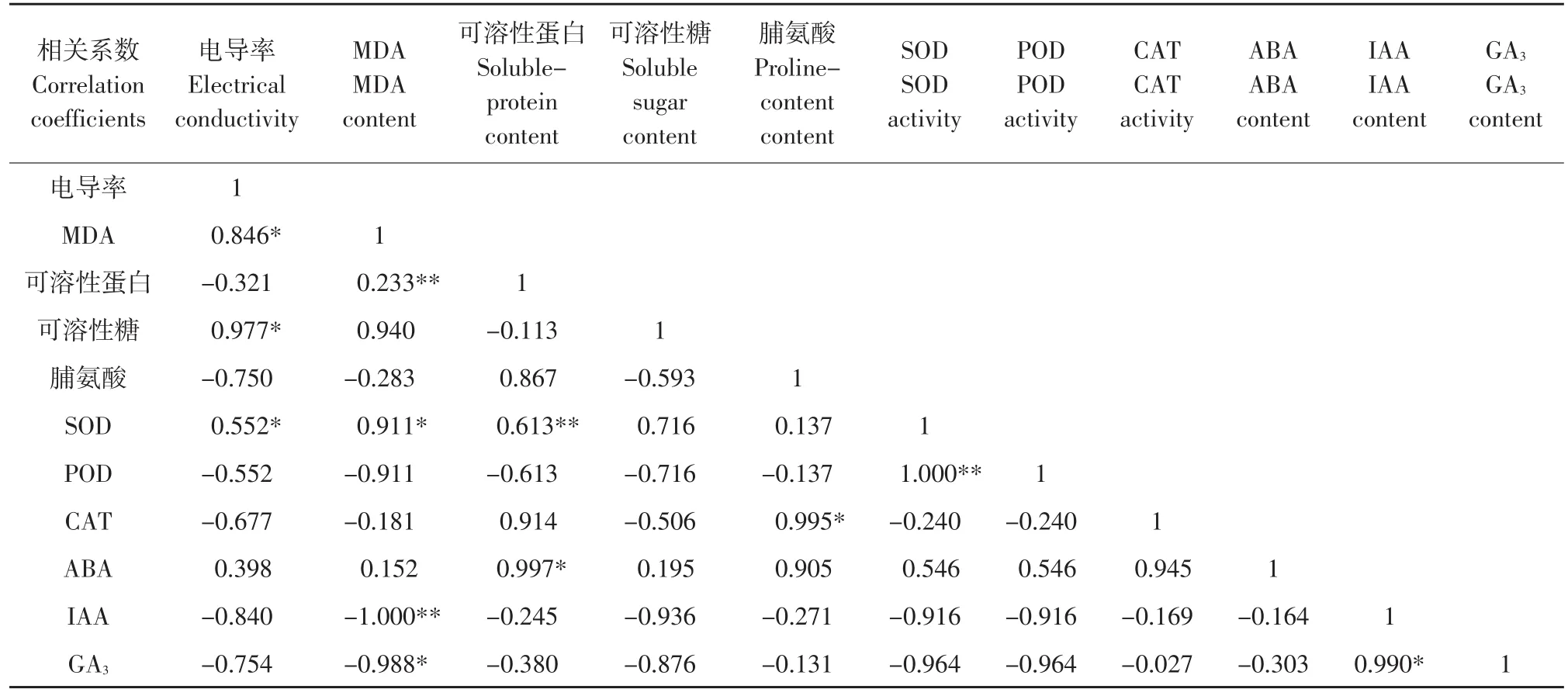
表3 各项生理指标相关性分析Table 3 Correlation analysis of various physiological indices
2.6 越冬期间香鳞毛蕨叶片超微结构变化
2.6.1 叶绿体超微结构的变化
叶片最重要的功能是进行光合作用,而叶绿体正是光合作用发生的场所。由于香鳞毛蕨叶片从12月至翌年3月初均处于萎蔫状态,所以本试验对2011年10~12月的香鳞毛蕨叶片进行超微结构观察。通过对香鳞毛蕨叶片叶肉细胞的超微结构观察,叶肉细胞内的叶绿体皆紧贴细胞壁分布,一般呈纺锤形,环绕在叶肉细胞四周,叶绿体中含有数量和大小不等的淀粉粒和嗜锇颗粒。
2011年10月的香鳞毛蕨叶片中叶绿体为椭圆形或近圆形,被膜清晰,类囊体多,类囊体基粒和片层排列整齐,片层间隙有大小不一的淀粉粒和嗜锇颗粒,整个叶绿体结构清晰,见图版I-a、b。随着温度的降低,叶绿体位置并未发生变化,仍整齐地单行排列在细胞壁周围,但叶绿体内淀粉粒聚集变少并且变小,基粒片层排列基本整齐,只有少部分有断裂。到11月时,叶绿体超微结构遭到严重破坏,基粒片层不清晰,体积膨胀变形,排列位置发生变化,出现在细胞中央,见图版I-d,e,但是并未解体,见图版I-g,此即香鳞毛蕨叶片在随后的12月到翌年3月仍有部分呈绿色的原因。
嗜锇颗粒随着温度的降低先聚集增多后逐渐减少,见图版I-a、d。嗜锇颗粒是锇酸与酚类作用形成的物质,故嗜锇颗粒的积累说明细胞中有大量酚类物质存在,植物多酚是一类广泛存在于植物体内的次生代谢物质,具有较强的氧化活性,可清除植物在逆境条件下细胞中产生的自由基。
2.6.2 线粒体超微结构的变化
植物可通过激活细胞内ATP酶的水解活性,增强能量释放抵御寒冷。线粒体在能量转换中起着其他细胞结构无法取代的作用,它与植物低温适应性有密切关系。
线粒体发育正常时呈圆球形,位于叶绿体之间或叶绿体与质膜的连接处,数量不多,具有完整的膜结构,嵴的数量较多,见图版I-c。在越冬期间,随温度的降低,香鳞毛蕨叶片中的线粒体部分形状发生变化,呈椭圆形,内脊数量明显减少,但膜结构完整。2011年11月时线粒体已经没有明显的内脊,双层膜破坏严重,膜边界模糊,见图版I-f。在2011年11~12月份,线粒体严重膨胀,其线粒体膜遭到破坏,最后解体消失见图版Ⅰ-g)。

图版Ⅰ 自然越冬期间香鳞毛蕨叶片超微结构变化PlateⅠ Change of leaf ultrastructure of Dryopteris fragrans during the winter
3 讨论
3.1 自然越冬对香鳞毛蕨质膜相对透性和膜脂过氧化的影响
生物膜系统与植物耐低温性关系密切,电解质渗透率可以作为一种反映植物细胞膜受低温伤害程度的指标;膜脂过氧化产物MDA是另一种反映细胞膜受伤害程度的指标,严重损伤细胞膜,这种损伤主要是因为MDA与膜中蛋白质结合而引起蛋白质分子内和分子间的交联,引发膜脂过氧化程度加剧,细胞膜透性增大,膜伤害程度增大[15]。香鳞毛蕨在越冬期间相对电导率与MDA含量均呈现先上升后下降的变化趋势,与温度呈负相关关系。本试验结果与沈静研究结果[16]一致。
3.2 自然越冬对香鳞毛蕨保护酶活性的影响
低温下植物活性氧代谢的强弱与植物低温适应性关系密切。低温胁迫时,植物体内会产生大量的活性氧自由基,导致膜质过氧化程度增加,造成膜系统的伤害,及时清除体内的活性氧有利于植物抗低温胁迫,相关作用的酶类主要有SOD、POD和CAT。本试验结果表明,酶活性的提高和降低与植物耐低温性的强弱呈一定相关性。自然越冬期间香鳞毛蕨SOD活性随着温度的变化而变化,呈正相关,与戴金平等对黄瓜、已经改良过的番茄幼苗、耐寒性强的葡萄、白三叶的SOD活性的报道相符合,SOD活性与低温呈正相关关系[17-20]。但是香鳞毛蕨中的POD和CAT活性变化曲线均呈“N”型,可能是因为香鳞毛蕨植物组织耐低温力的大小与自身维持活性氧代谢平衡的能力有关。但随着温度的继续降低,各种酶活性开始逐渐下降,植物体内的氧代谢失调,细胞内自由基产生和消除的平衡受到破坏而出现自由基积累,并引发或加剧细胞膜过氧化,MDA含量增多,导致香鳞毛蕨酶活性表现出表达量低的现象,从2011年12月到2012年2月一直维持在较低水平。
3.3 自然越冬对香鳞毛蕨渗透调节物质含量的影响
在植物抗低温胁迫过程中,体内会大量积累各种渗透调节物质,赋予植物多种渗透调节的能力。崔红等研究表明,香鳞毛蕨在低温条件下,通过抗氧化酶和内源激素的调节,细胞内主动积累可溶性糖、可溶性蛋白质和游离脯氨酸,使细胞渗透势下降,提高细胞液浓度,增加束缚水含量,降低冰点,可缓和细胞质过度脱水,保持细胞不致遇冷凝固,提高香鳞毛蕨低温适应性。本试验结果与崔红等研究结果[21]一致,但同种植物不同生长阶段对低温的适应性有很大差异。香鳞毛蕨野生植株中蛋白质含量变化不明显,其他两种物质含量在越冬期间呈“N”型变化,并不随环境温度降低而持续升高,随着温度的继续降低,酶活性逐渐下降,由此引起香鳞毛蕨渗透调节物的代谢失衡,出现下降趋势,从2011年12月到2012年2月一直维持在较低水平。
3.4 自然越冬对香鳞毛蕨叶片内源激素含量的影响
植物内源激素被大多数研究者认为是植物对抗寒基因表达的启动因子,特别是脱落酸ABA对植物抗寒力的调控以及对维持细胞膜结构功能起重要作用[22]。IAA和GA3为促生长类激素,对植物生长发育主要起促进作用,逆境条件下植物一般需要降低生长速度以度过不良环境。杨广东等研究结果表明,低温适应性强的植物品种比低温适应性弱的植物品种GA3含量低;温度越低,抗性较强的辣椒品种ABA含量越高[23]。本研究中,香鳞毛蕨在自然越冬低温胁迫时ABA含量升高,而GA3和IAA含量随着温度的降低而降低。研究结果说明低温环境下香鳞毛蕨能够通过调节自身的内源激素减轻低温伤害,维持植物体正常生长及生理代谢功能,表现出一定的耐低温性。植物生理过程很大程度上受激素的促进作用和抑制作用的平衡调节,如ABA与GA3有共同的合成前体,二者的许多生理作用相互拮抗,已知植物的生长与休眠主要由ABA和GA3调节。沈漫利用露地栽培的常春藤为材料进行研究,结果表明露地栽培的常春藤具有较强的低温适应性,其ABA含量显著高于温室栽培的常春藤,GA3含量低于温室栽培的常春藤,ABA/GA3比值与温度呈负相关[24];黄涛等研究发现在低温适应性中ABA/GA3的作用比ABA或GA3的绝对含量更重要,抗性强的水稻品种ABA/GA3比抗性弱的品种变化幅度大[25]。本文结果同时表明,随温度的降低,野生香鳞毛蕨叶片中ABA/GA3比总体变化为先升高后降低,并且温度越低,变化幅度越大,与曲凌慧等研究结果[26]相似。以上结果表明,内源激素ABA、IAA、GA3及ABA/GA3比与香鳞毛蕨低温适应性呈正相关,初步认为其可作为香鳞毛蕨低温适应性的鉴定指标。
3.5 自然越冬对香鳞毛蕨叶片超微结构的影响
香鳞毛蕨叶片中椭球形或圆形的叶绿体结构清晰,随着入冬季节温度的持续降低,细胞壁周围的叶绿体超微结构遭到严重破坏,淀粉粒聚集变少并且变小,光合作用产物减少,基粒片层组织逐渐模糊,组织结构遭到破坏,随着基粒片层位置的移动,细胞内其他物质的变化,叶绿体并没有解体消失。线粒体在植物的生长过程中不断的提供能量,随着温度的降低,线粒体的位置和形状发生变化,重要的结构嵴由数量变少,最后被严重破坏,解体消失。本试验结果与赵明明对几种冬青属植物抗寒性进行比较研究的结果[27]一致,认为随着胁迫温度的降低,细胞内细胞器逐渐损伤,嗜锇颗粒增多,叶绿体也逐渐变形扭曲,且位置发生变化,细胞器结构的稳定性同植株的抗低温能力呈正相关,即冷害引起的各类细胞器结构的变化及其破坏程度,取决于植物的耐低温性[27-28]。
4 结论
香鳞毛蕨在越冬期间相对电导率与MDA含量均呈现先上升后下降的变化趋势,与温度呈负相关关系。自然越冬期间香鳞毛蕨保护酶SOD活性随着温度的变化而变化,呈正相关,POD和CAT活性变化呈“N”型。自然越冬期间香鳞毛蕨渗透调节物质中可溶性蛋白质含量变化不明显,可溶性糖和游离脯氨酸含量呈“N”型变化。自然越冬期间香鳞毛蕨内源激素ABA含量随着温度的下降而上升,GA3、IAA含量与ABA变化趋势相反,与温度呈负相关。通过观察香鳞毛蕨叶片越冬期间的超微结构,叶绿体基粒片层逐渐不清晰,但未消失,线粒体随温度的降低,脊数量明显减少,双层膜结构破坏严重,解体消失。
[1]王建中.东北蕨类植物的分类研究[J].木本植物研究,1989(9): 73-82.
[2]Ito H,Muranaka T,Mori K,et al.Dryofragin and aspidin PB,piscicidal components from Dryopteris fragrans[J].Chem Pharm Bull, 1997,45(10):1720-1722.
[3]沈志滨,金哲雄,张德连,等.香鳞毛蕨治疗银屑病的药理作用研究[J].中草药,2002,33(5):448-449.
[4]沈志滨,金哲雄,张德连,等.香鳞毛蕨的生药学研究[J].中草药, 2002,33(7):661-663.
[5]樊锐锋,黄庆阳,常缨.香鳞毛蕨抑菌特性比较研究[J].东北农业大学学报,2012,43(3):81-84.
[6]Gana J A,Sutton F,Kenefick D G.cDNA structure and expression patterns of a low-temperature-specific wheat gene tacr7[J].Plant Molecular Biology,1997,34:643-650.
[7]Minami A,Nagao M,Ikegami K,et al.Cold acclimation in bryophytes:Low temperature-induced freeing tolerance in Physcomitrella patens is associated with increases in expression levels of stress-related genes but not with increase in level of endogenous abscisic acid[J].Planta,2005,220:414-423.
[8]Liu Y Y,Li J Z,Chen L,et al.Effect of low temperature stress on peroxidation product of membrane lipids and activity of related enzymes in wheat seedling leaves[J].Journal of Triticeae Crops, 2006,26(4):70-73.
[9]汤章诚,魏家绵,陈因,等.现代植物生理学实验指南[M].北京:科学出版社,1999.
[10]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2005.
[11]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12]王晶英,敖红,张杰,等.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003.
[13]吴红京,张春玲,赖钟雄.高效液相色谱法测定龙眼胚芽中的细胞分裂素[J].福建分析测试,2005,14(1):2096-2100.
[14]洪涛,姚骏恩,李文镇,等.生物医学超微结构与电子显微镜技术[M].北京:科学出版社,1984.
[15]周建,尤扬,袁德义.低温胁迫对广玉兰生理特性的影响[J].西北林学院学报,2008,23(6):38-42.
[16]沈静.野牛草响应低温胁迫的生理机制和蛋白质组学初步研究[D].兰州:甘肃农业大学,2010.
[17]戴金平,沈征言.低温锻炼对黄瓜幼苗几种酶活性的影响[J].植物学报,1991,23(8):627-632.
[18]蔡素雯,郭桂云,张红梅,等.磁场处理种子后番茄幼苗在低温胁迫下保护酶的变化[J].植物研究,1996,16(2):219-223.
[19]刘伟,曲凌慧,刘洪庆.低温胁迫对葡萄保护酶和氧自由基的影响[J].北方园艺,2008(5):21-24.
[20]安莹,陈雅君,赵伟,等.低温对白三叶膜质过氧化及保护酶活性的影响[J].草原与草坪,2009,13(43):8-11.
[21]崔红,于晶,苍晶,等.3个紫斑牡丹品种的抗寒生理特性研究[J].东北农业大学学报,2009,40(7):24-27.
[22]刘洪雨,张吉立,李新,等.低温对园林植物生物膜及内源激素的影响[J].湖南农业科学,2011(5):111-113.
[23]杨广东,郭瑜敏.低温胁迫对青椒苗期和花期脱落酸含量的影响[J].山西农业科学,1998,26(2):45-48.
[24]沈漫.常春藤质膜透性和内源激素与抗寒性关系初探[J].园艺学报,2005,32(1):141-144.
[25]黄涛,陈大洲,夏凯,等.抗冷与不抗冷水稻在低温期间叶片ABA与GA1水平变化的差异[J].华北农学报,1998,13(4):56-60.
[26]曲凌慧,车永梅,刘新,等.ABA和IAA等激素参与葡萄对低温胁迫的应答[J].青岛农业大学学报:自然科学版,2010,27(1):36-41.
[27]赵明明.几种冬青属植物抗寒性比较研究[D].南京:南京林业大学,2012.
[28]韦如萍,胡德活,王润辉,等.自然低温条件下南洋楹抗寒生理研究[J].广东林业科技,2008,24(1):10-15.
Study onDryopteris fragrans(L.)Schott live through natural winter in Wudalianchi of erdos/
CHANG Ying,LI Yan,AN Yuting,ZHANG Zhimei,WANG Hemeng, ZHANG Wei(School of Life Sciences,Northeast Agricultural University,Harbin 150030,China)
The overwintering mechanism ofDryopteris fragrans(L.)Schott in Wudalianchi Heilongjiang Province and its physiological and biochemical characteristics as well as ultrastructure were carried out in this study.The results showed thatD.fragransrelative electrical conductivity and content of MDA increased at first and decreased,activity of POD,CAT both generally rised to form into the"N" curve,activity of SOD declined and then increased,content of proline,soluble sugar and soluble protein all presented as the"N"curve.The ratio of ABA/GA3was related closer with low temperature adaptability.The volume of leaf chloroplast expanded into deformation,the granum lamella gradually fuzzied,but not all became collapsed.The number of mitochondria ridge obvious reduced,and double membrane structure were serious destoried.Membrane border fuzzied until they were severely damaged and collapses into disappear finally.
Dryopteris fragrans(L.)Schott;natural overwintering;physiological mechanism;protective enzyme;cold resistance
S828;Q782
A
1005-9369(2014)08-0041-08
2014-03-03
国家自然科学基金项目(31070291)
常缨(1970-),女,教授,博士,博士生导师,研究方向为植物资源学与植物分子生物学。E-mail:changying@neau.edu.cn
时间2014-7-26 14:32:52[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140726.1432.003.html
常缨,李艳,安玉婷,等.五大连池地区香鳞毛蕨自然越冬特性研究[J].东北农业大学学报,2014,45(8):41-48.
Chang Ying,Li Yan,An Yuting,et al.Study onDryopteris fragrans(L.)Schott live throughnatural winter in Wudalianchi of erdos[J].Journal of Northeast Agricultural University,2014,45(8):41-48.(in Chinese with English abstract)
