添加外源菌剂对堆肥中反硝化菌多样性的影响
2014-01-14许修宏卢欣颖李洪涛陈会海
许修宏,卢欣颖,姜 虎,李洪涛,陈会海
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江省环境保护科学研究院,哈尔滨 150060)
添加外源菌剂对堆肥中反硝化菌多样性的影响
许修宏1,卢欣颖1,姜 虎2,李洪涛1,陈会海1
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江省环境保护科学研究院,哈尔滨 150060)
一氧化二氮还原酶是堆肥发酵中反硝化菌代表性的酶,可较准确地反映出堆肥中反硝化菌的活动状态及反硝化作用状态。文章采用PCR-DGGE方法研究堆肥中反硝化菌群落的变化,结果表明,添加菌剂的堆肥(堆肥Ⅰ和Ⅱ)中反硝化菌的数量与种类都有所增加(尤其是在堆肥Ⅱ中)。通过对DGGE图谱上的条带进行克隆测序,发现测序条带多为假单胞菌。
PCR-DGGE;nosZ-F;生物多样性
堆肥过程中的反硝化菌主要是兼厌氧和微嗜氧菌,反硝化专性厌氧菌极少。厌氧/少氧是反硝化的必要条件[1]。但近年研究表明,有些细菌可以在好氧条件下进行反硝化反应[2]。反硝化作用主要发生在细菌对数生长期[3]。
因为一氧化二氮还原酶催化的是反硝化作用的最后一步,而不同反硝化菌之间nosZ基因簇变化不大[4],因此nosZ基因也常被作为分子标记用于检测可进行完全反硝化作用(终产物为N2)的微生物标记。
本试验采用PCR-DGGE技术,对添加外源菌剂的堆肥固体发酵过程中以一氧化二氮还原酶基因为代表的反硝化菌群落结构及其动态变化进行研究,旨在明确堆肥过程中反硝化菌群落的组成及其在不同阶段的变化规律,为研究堆肥中的氮素变化规律提供依据。
1 材料与方法
1.1 材料与设计
采用主动通风方式进行牛粪与稻草秸秆的固体发酵堆肥试验,堆肥初始C/N比为32.35,湿度为60%,试验地点为东北农业大学园艺实验站。设置堆体高1 m,直径约为1 m,呈垛形。堆肥Ⅰ在建堆之初就加入外源菌剂,而堆肥Ⅱ在建堆时加入外源菌剂的一部分,发酵进行到第15天时加入剩余的外源菌剂。堆肥时间控制在1个月左右,每天上午9:00定时测定堆体温度、环境温度,第9天和第19天进行翻堆通风。
1.2 样品采集及基因组总DNA的提取
试验分别在堆肥发酵的第0、6、9、12、15、20、30天取样,分上、中、下层随机取样,分别距堆体顶端30、60、100 cm处分五点采集样品,取得的样品混合均匀,四分法保留200 g,用保鲜袋密封、-20℃冷冻保存,以备分析测定用。样品粗DNA采用碱裂解法提取,参照文献[5-7]。粗提DNA用OMEGA纯化试剂盒进行纯化。
1.3 PCR-DGGE
采用通用简并引物用于氧化亚氮还原酶的片断扩增:

3'[6],其中GC钳是为满足DGGE的温度而加,由北京华大基因合成。
PCR扩增程序为:
94℃,3 min;94℃,1 min,56.5℃,1 min,72℃,1 min,35个循环;72℃,10 min。PCR反应体系为无菌双蒸水6.8 μL,2×PCR反应缓冲液12.5 μL,2.5 mmol·L-1dNTP溶液2.5 μL,10 mmol·L-1引物NosZ-F、Nos-1622RGC各0.1 μL,Taq酶0.5个单位,纯化后的样品DNA为模板0.5 μL,反应体系总体积25 μL。
DGGE采用8%聚丙烯酰胺凝胶,其中尿素浓度40%~70%。电泳采用D-code DGGE系统(Bio-Rad),电泳缓冲液为1×TAE,在130 V固定电压下电泳15~16 h,进行硝酸银染色。
1.4DGGE数据多样性分析
多样性指数可采用Shannon-Weaver指数表示,Shannon-Weaver指数由下式计算:式中,Dsh为Shannon-Weaver指数;Pi为第i个DGGE条带出现概率;Ni为第i个RAPD条带扩增量;N为土壤微生物群落DNA的DGGE条带扩增总量微生物多样性指数是度量生物多样性高低及空间分布特征的数值指标。分析软件为Tanon GIS凝胶成像系统,试验数据采用Excel分析。
2 结果与分析
2.1 堆肥过程中温度的变化
三个处理的堆体温度变化趋势相同,都经历升温期、高温期、降温期和腐熟期四个过程,其中0~14 d为堆肥一次发酵时期,15~31 d为堆肥二次发酵期。堆肥Ⅰ和堆肥Ⅱ均在3 d使堆温升至50℃以上,而堆肥CK在第5天达到50℃以上,此时期为堆肥升温期。其中堆肥Ⅰ和堆肥Ⅱ在第5天达到最高温度分别为69和70℃,堆肥CK在第8天达到最高温度65.5℃。可见,接种微生物促进最初堆料中微生物大量繁殖,使堆温迅速升至理想高度。堆肥Ⅰ和堆肥Ⅱ的高温期(大于50℃)均维持23~24 d,而堆肥CK维持13 d,堆肥Ⅰ和Ⅱ温度变化基本一致,说明接种时间的差异对堆肥温度没有太大影响;然而,在14~22 d时间段内堆体Ⅰ的温度显著高于堆体Ⅱ,这可能是由于二次发酵阶段添加的FLD导致生物活性的提高从而使堆体温度上升。接种菌剂后,堆体温度上升要快于自然堆肥且最高温度高于自然堆肥,可能的原因是,接种外源微生物后提高堆肥初期微生物的数量,缩短堆肥化进入高温期的时间,有对堆肥加速启动的作用;之后开始逐渐降温,当堆肥化进行到25 d,堆体温度缓慢下降,不再有明显变化,说明堆肥化已基本进入腐熟阶段。接种菌剂后高温期持续时间比自然堆肥长,说明接种菌剂后的堆体中微生物活动剧烈,由于微生物活动产生的热量持续时间久,可更有效杀死堆肥中的病原微生物,有利于堆肥化腐熟和无害化。
2.2PCR-DGGE分析
2.2.1 基因组总DNA
堆肥细菌基因组DNA长度大于23.1 kb,均以获得较完整的基因组DNA片段,但是提取结果有拖尾现象,说明片段中还有大量杂质,例如腐殖酸类物质[8]。为不影响后续的PCR反应,需要对粗提DNA进行纯化。本试验采用OMEGA凝胶回收试剂盒对基因组DNA进行纯化,扩增得目的片段大约450 bp(见图1)。
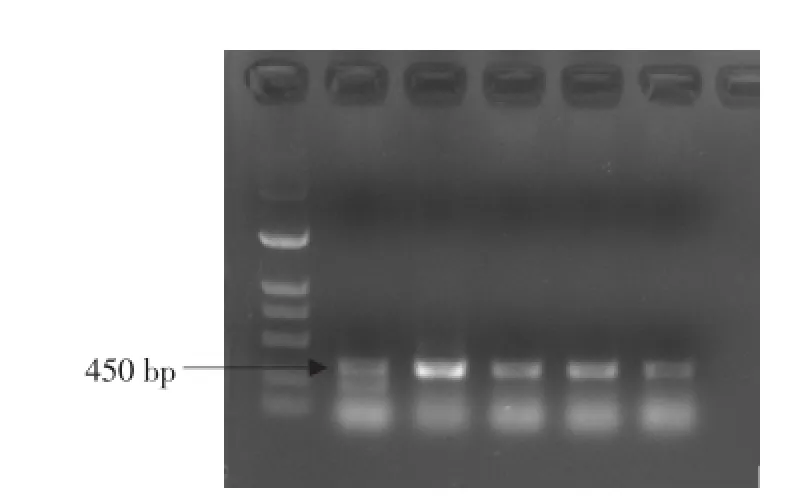
图1 PCR扩增结果Fig.1 Results of PCR amplification
2.2.2 DGGE图谱分析
DGGE结果显示接种处理的堆肥Ⅰ和Ⅱ中的代表反硝化菌的条带数量多于自然堆肥(见图2)。切胶后测序显示,条带A与Bacillus subtilis(枯草芽孢杆菌)相似度最高,可以达到99%,条带B和C都与Pseudomonas(假单胞菌属)最相似,条带D是Streptomyces(链球菌属),条带E、F均是未知菌属,条带G与P.stutzeri(斯氏假单胞菌)最相似,条带H属于Corynebacterium(棒状杆菌属),条带I是P.aeruginosa(绿色假单胞菌)。
2.2.2.1 DGGE相似性比较
本试验根据戴斯系数(Dice coefficient)[9]法计算各样品间相似度矩阵(见表1、2和3)发现,各泳道之间的条带相似性不高,并且呈现高低变化不均的趋势。表1、2和3分别为堆肥Ⅰ、Ⅱ和自然堆肥的DGGE图谱条带相似性分析表。表1中,堆肥第6天和第30天之间(见泳道2和7)的Cs值最低,为27.3%,第12天和15天之间(见泳道4、5)的Cs值最高,达69.5%;在表2中,堆肥第6天和第15天之间(见泳道9和12)的Cs值最低,为45.5%,第0天和9天之间(见泳道8、11)的Cs值最高,达78.8%;由表3可知,堆肥第15天和第30天之间(见泳道19和21)的Cs值最低,为28.3%,第9天和30天之间(见泳道17、21)的Cs值最高,达51.7%;三个堆肥处理的Cs值,取样时间越接近,DGGE条带相似性越高;取样时间越远,相似性越低。高温过程微生物群落演替迅速,每3 d取样一次进行研究,堆体中微生物组成和数量都发生明显改变,如要研究更详细的群落变化情况,可在堆肥初期进行每天取样分析。
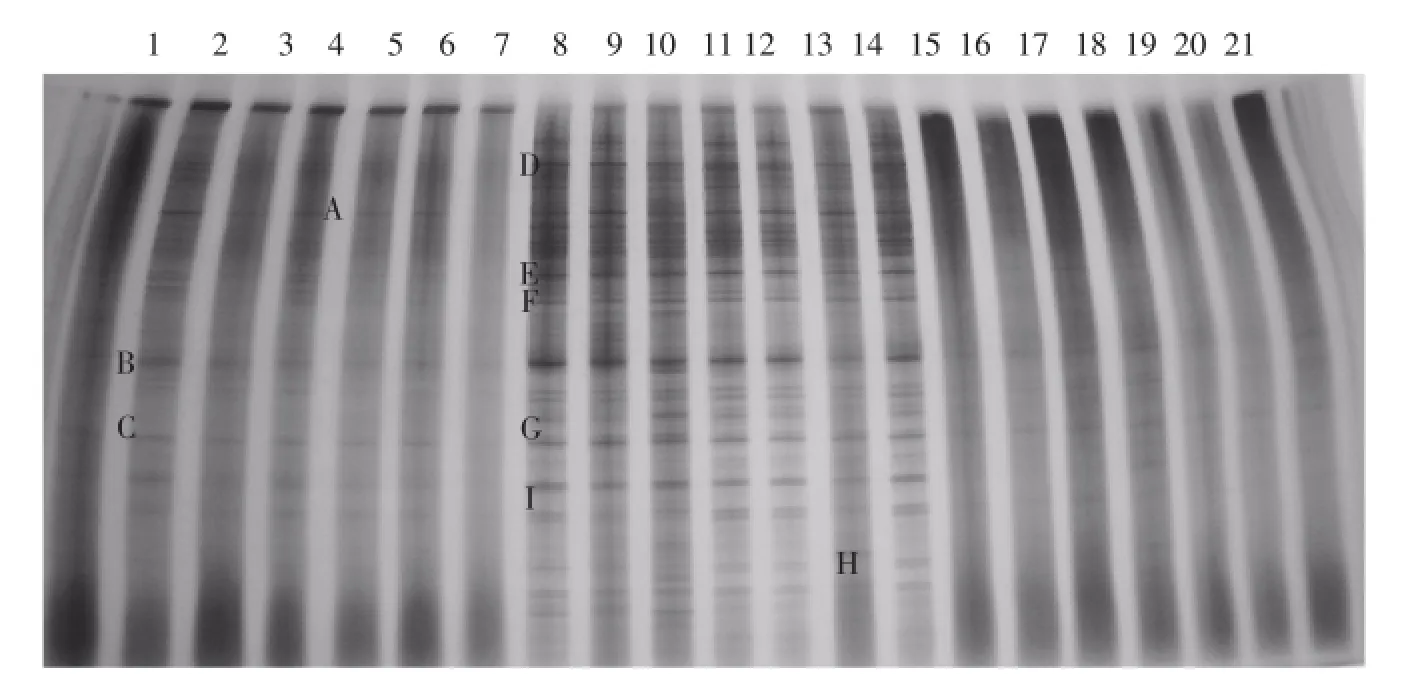
图2 堆肥Ⅰ、Ⅱ和自然堆肥DGGE电泳图谱Fig.2 DGGE electrophoresis of compostⅠ,Ⅱand natural compost
2.2.2.2 DGGE聚类分析(UPGAMA)
运用Quantity one图象分析软件对DGGE指纹图谱采用非加权算术平均法(UPGAMA)进行聚类分析:图3、4和5分别为堆肥Ⅰ、堆肥Ⅱ和自然堆肥的聚类分析图。可看出三组堆肥处理各泳道条带相似性普遍不高。原因可能是由于堆肥本身是一个微生物区系快速演替的过程。如图3所示,堆肥Ⅰ中聚类关系最近的是泳道4和5,最高0.69,泳道7与其他泳道聚类关系最远,最大相差0.36。但总体上,相邻泳道间的相似性较高,说明取样时间相隔越近,种群差异越小。由图4可知,堆肥Ⅱ中聚类关系最近的是泳道8和11,最高0.79,而泳道9与其他泳道聚类关系最远,为0.53。而图5则显示,各泳道之间聚类关系普遍偏低,最高的为泳道17和21,是0.52,泳道15和16聚类关系仅次于泳道17和21,为0.51。
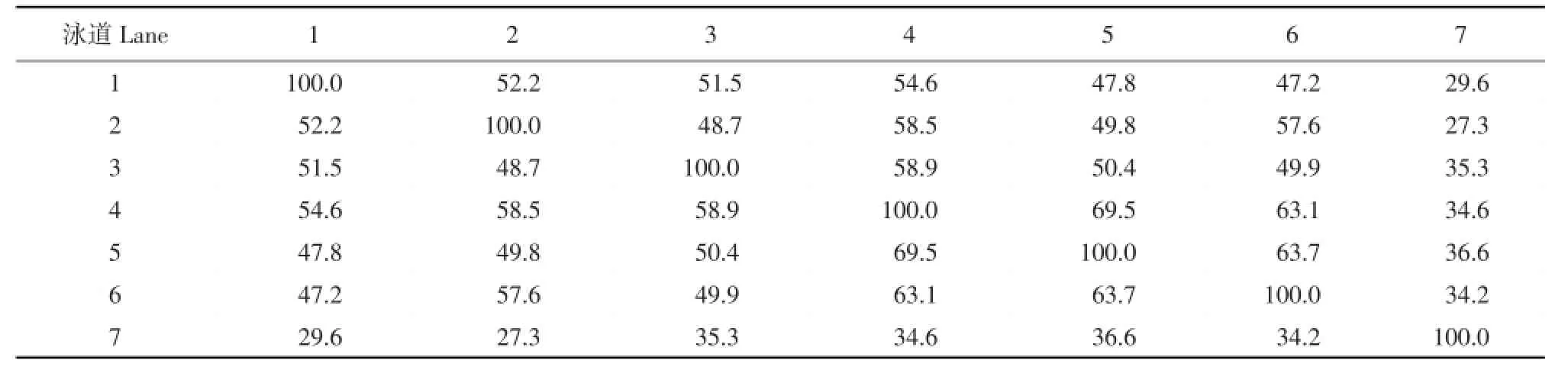
表1 堆肥ⅠDGGE图谱条带相似性分析Table 1 DGGE patterns with similarity analysis in compostⅠ
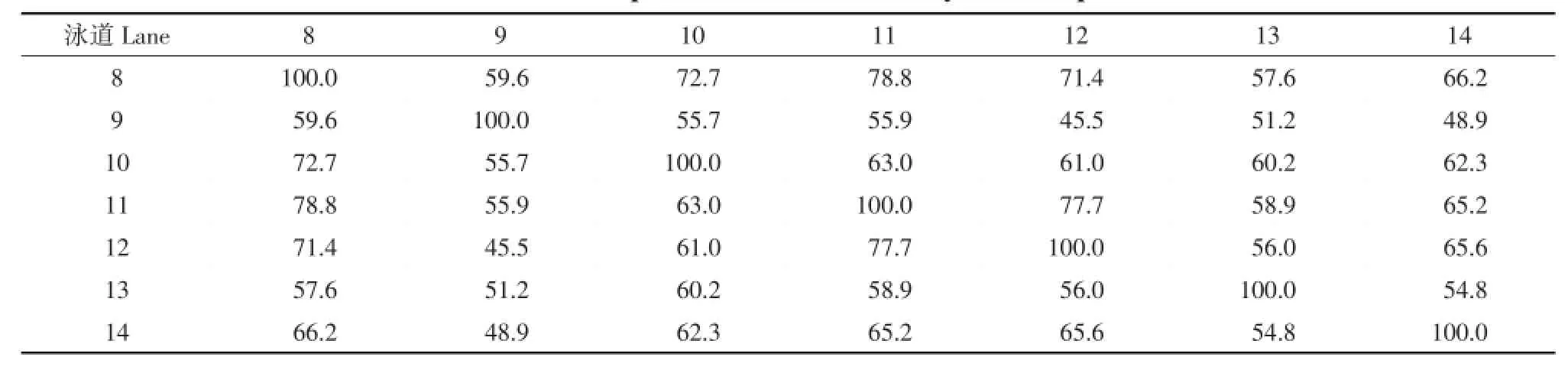
表2 堆肥ⅡDGGE图谱条带相似性分析Table 2 DGGE patterns with similar analysis in compost II
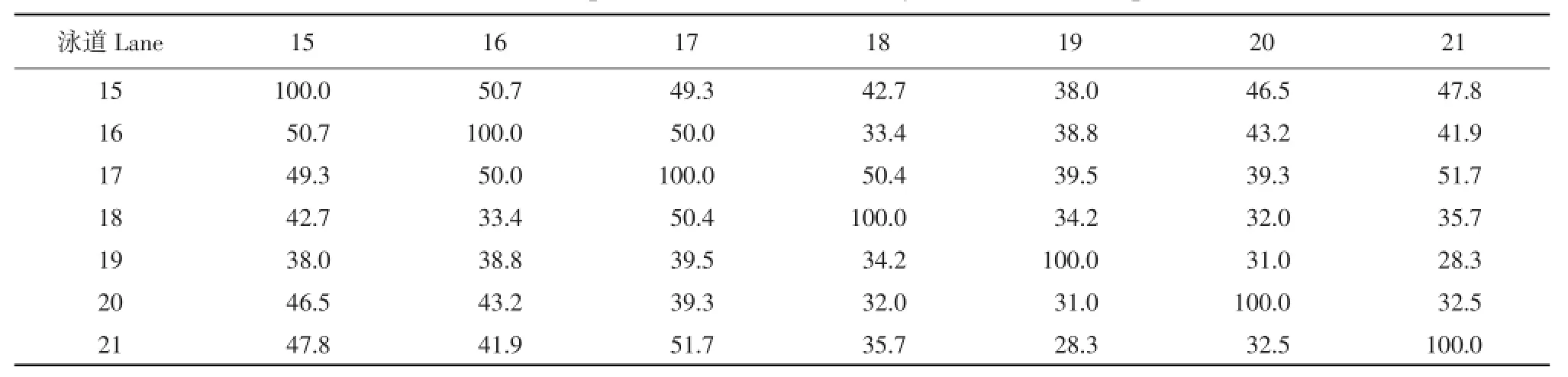
表3 自然堆肥DGGE图谱条带相似性分析Table 3 DGGE patterns with similar analysis in natural compost
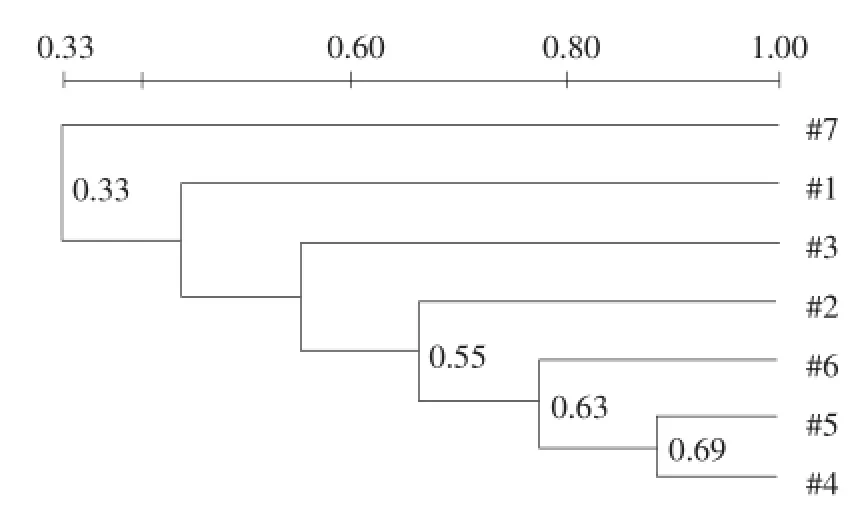
图3 堆肥ⅠDGGE聚类分析Fig.3 DGGE cluster analysis in compostⅠ

图4 堆肥ⅡDGGE聚类分析Fig.4 DGGE cluster analysis in compostⅡ
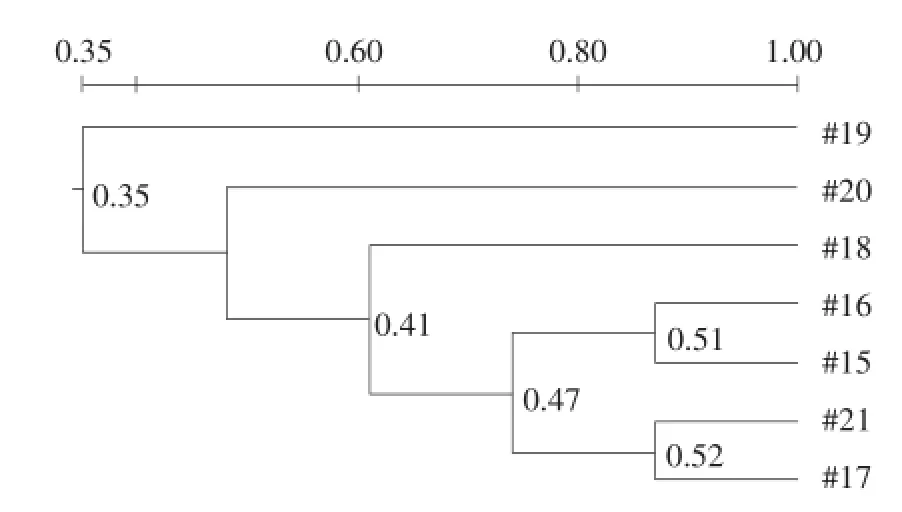
图5 自然堆肥DGGE聚类分析Fig.5 DGGE cluster analysis in natural compost
对于三堆堆肥而言,均有说明取样时间越相近,堆肥中微生物群落相似性相对更高,尤以堆肥Ⅰ最为明显。菌群经过一段时间运行,数量和优势种群增加,整个种群演替过程中既存在原有种属消亡,也有新种属增长。群落相似性随着运行时间的延长呈高低相间态势,最终形成稳定的群落类型。
2.2.2.3 DGGE多样性分析
由图6可知,自然堆肥在堆肥升温期及高温期的微生物多样性呈先增加后减少趋势,进入二次发酵后,其多样性又有所增加,最终趋于平稳。而堆肥Ⅰ的微生物多样性在一次发酵,即0~14 d内变化不大,应该是由于最初添加菌剂使堆肥中分解纤维素的菌群增加,从而使堆肥中可利用的有效碳素增加导致。而进入二次发酵后,微生物多样性呈先减少后增加而后再减少的状态,与自然堆肥发酵的一次发酵类似,应该与堆肥经过高温期,微生物群落发生迅速演替有关。对于堆肥Ⅱ而言,其微生物多样性没有明显变化,但是数值较高显示,微生物种类极其丰富,群落演替迅速,而且在二次发酵时,再次添加菌剂更是成为其如此表现的一个重要原因。
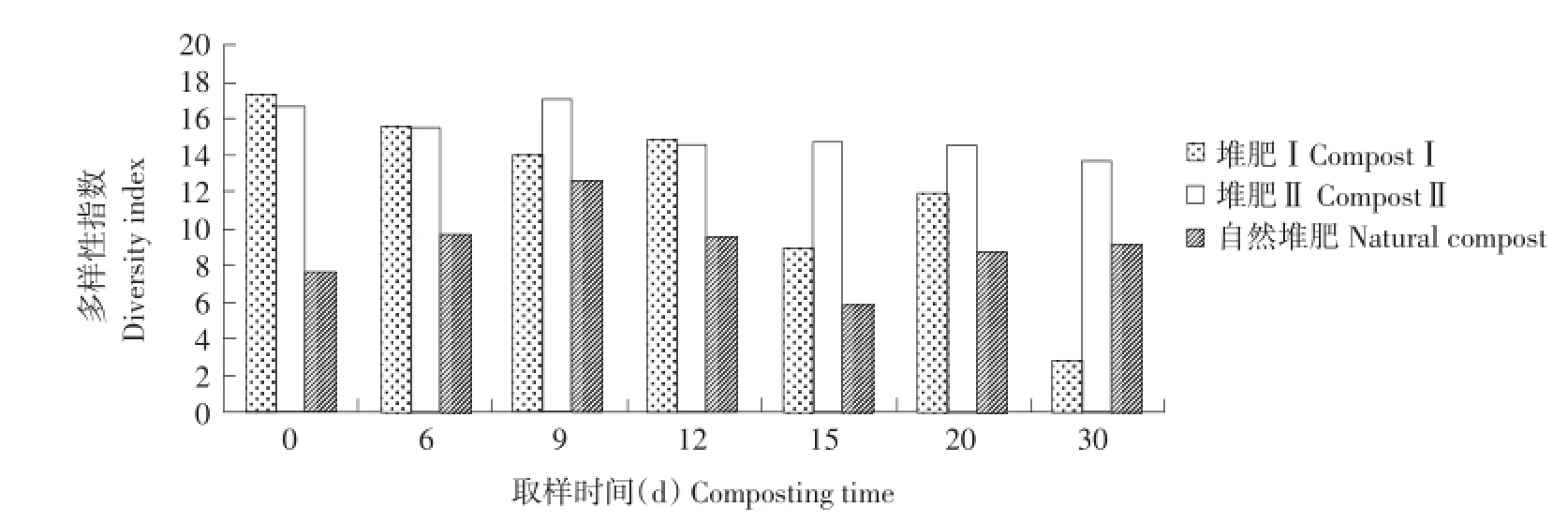
图6 堆肥Ⅰ、Ⅱ和自然堆肥微生物多样性指数Fig.6 CompostⅠ,Ⅱand natural compost microbial diversity index
3 讨论与结论
硝化过程和反硝化过程是自然界中氮素循环的重要过程,对氮素的转化和分布起重要作用。堆肥中的反硝化作用一般发生在堆肥过程的中后期,这时堆肥中已积累一定量的硝酸盐,且堆肥中温度已从高温转换为中温,无论从营养要素角度还是从环境条件上都适合反硝化细菌生长[5]。反硝化作用结果会导致堆肥中硝酸盐被还原,同时释放出氮气和氧化亚氮,是堆肥氮素通过气态方式回归自然的重要途径[10]。从资源利用的角度看,反硝化过程会造成资源浪费(减少堆肥中氮素含量)。从生态保护的角度看,反硝化作用会造成环境污染、加剧温室效应。因此,控制或减少反硝化过程对于氮素资源的利用和减少温室气体排放均具有实际意义,成为堆肥技术重要组成部分。本文从分子水平上反应驱动反硝化过程反硝化菌的多态性变化,可为堆肥控氮技术的研发和堆肥氮素循环研究提供科学数据。
反硝化菌生长速度较慢,传统方法分离培养费时费力,且有部分反硝化菌难于人工培养。因此,如何能借助生物技术快速研究反硝化菌是研究反硝化作用的关键。本研究利用一氧化二氮还原酶基因[4](nosZ基因),通过PCR-DGGE技术扩增得到堆肥中的反硝化菌群,并对其多态性进行研究,为堆肥中反硝化菌群的研究提供技术途径。
本研究中,三个处理的堆体温度变化趋势相同,都经历升温期、高温期、降温期和腐熟期四个过程,表明各堆肥处理均完成了堆肥的各阶段,具有一定代表性[10]。随着堆肥过程进行,自然堆肥在堆肥升温期及高温期微生物多样性呈先增加后减少趋势,进入二次发酵后,其多样性又有所增加,最终趋于平稳。而堆肥Ⅰ在一次发酵期间,微生物多样性变化不大,二次发酵变化与自然堆肥的一次发酵变化类似。堆肥Ⅱ的微生物多样性一直变化不大,但数值较高。通过对DGGE图谱的条带进行克隆测序,发现测序条带多为假单胞菌属。
[1]殷士学,陈丽敏.土壤中硝化、反硝化微生物的研究进展[J].土壤学报,2002,39(6):116-124.
[2]龙雯,陈存社,汪萍,等.一株好氧反硝化细菌的分离与鉴定[J].中国酿造,2006(8):28-30.
[3]刘晶晶,汪苹,王欢.一株异养硝化-好氧反硝化菌的脱氮性能研究[J].环境科学研究,2009,21(3):121-125.
[4]郭丽芸,时飞,杨柳燕.反硝化菌功能基因及其分子生态学研究进展[J].微生物学通报,2011,38(4):583-590.
[5]Bishop P L Godfrey C.Nitrogen transformations during sludge composting[J].Biocycle,1983(5):34-39.
[6]Throbäck I N,Enwall K,Jarvis A,et al.Reassessing PCR primers targeting nirS,nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J].FEMS Microbiol Ecol,2004, 49:401-417.
[7]皮广洁,唐书源.农业资源环境监测原理与方法[M].成都:成都科技大学出版社,1998.
[8] 付丽丽.应用16SrDNA序列分析对砾石接触氧化反应器中细菌多样性[J].科技导报,2010,28(3):51-54.
[9]石鹏君,孟昆,伍宁丰,等.新疆一号冰川土壤细菌多样性的研究[J].微生物学通报,2006,33(4):58-63.
[10]Zeng G M,Zhang J C,Chen Y N.Relative contributions of archaea and bacteria to microbial ammonia oxidation differ under different conditions during agricultural waste composting[J].Bioresource Technology,2011,102:9026-9032.
Effect of inoculant on diversity of denitrifying bacteria in compostingXU
Xiuhong1,LU Xinying1,JIANG Hu2,LI Hongtao1,CHEN Huihai1(1.School of Resources and Environmental Sciences,Northeast Agricultural University,Harbin 150030,China;2.Heilongjiang Provincial Environment Protection Academy,Harbin 150060,China)
Nitrous oxide reductase is the representative of denitrifying bacteria accurately reflecting the state of the organisms and denitrification in compost.In this study,PCR-DGGE was used to study the structure and diversity of nitrous oxide reductase bacteria community in compost.The results showed that the number and species of denitrifying bacteria increased in compost(compostⅠandⅡ,especially in compostⅡ)inoculated with exogenous organisms.The cloning and sequencing of the DGGE bands revealed that they were affiliated toPseudomonas.
PCR-DGGE;nosZ-F;bio-diversity
S141.4
A
1005-9369(2014)03-0091-06
时间2014-3-20 17:49:00 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140320.1749.007.html
许修宏,卢欣颖,姜虎,等.添加外源菌剂对堆肥中反硝化菌多样性的影响[J].东北农业大学学报,2014,45(3):91-96.
Xu Xiuhong,Lu Xinying,Jiang Hu,et al.Effect of inoculant on diversity of denitrifying bacteria in composting[J].Journal of Northeast Agricultural University,2014,45(3):91-96.(in Chinese with English abstract)
2012-03-28
国家自然科学基金资助项目(31272484,31372351)
许修宏(1968-),男,教授,博士,博士生导师,研究方向为农业微生物。E-mail:xuxiuhong@neau.edu.cn
