猪卵泡抑素基因特异表达载体的构建及鉴定
2014-01-14刘娣尹雪张冬杰汪亮孙亚蒙张晓卉
刘娣,尹雪,张冬杰,汪亮,孙亚蒙,张晓卉
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院畜牧研究所,哈尔滨 150086)
猪卵泡抑素基因特异表达载体的构建及鉴定
刘娣1,2,尹雪1,张冬杰2,汪亮2,孙亚蒙1,张晓卉1
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院畜牧研究所,哈尔滨 150086)
采用RT-PCR方法扩增猪的FST基因完整编码区,采用双酶切和连接方法构建可在肌肉细胞中特异表达的真核载体,并转染C2C12细胞系进行验证。结果表明,猪FST基因全长1 032 bp,与网上已提交序列相似度为99.13%,成功构建可在肌肉细胞中特异表达的真核载体pEGFP-C1-α-actin-FST,转染C2C12细胞后,通过实时定量PCR检测,表明FST基因过表达可抑制MSTN基因表达。
猪;卵泡抑素基因;特异表达载体;实时定量PCR;过表达
卵泡抑素(Follistatin,FST)又名FSH抑制蛋白,是一种单链糖蛋白[1],FST基因全长约6 kb,含6个外显子和5个内含子,第1外显子编码一个长29个氨基酸的片段,4个外显子分别编码FST的4个功能区,一个卵泡抑素前体有344个氨基酸,但最后一个功能区编码27个氨基酸可能会脱去而形成另外含317个氨基酸的前体[2-3]。FST具有多种生物学功能,对转化生长因子(Transforming growth factor,TGF)β超家族成员成员具有拮抗作用,可与肌肉抑制素结合,调节肌肉细胞生成。肌肉抑制素基因是一种骨骼肌生长的负调控因子,降低该基因表达或者抑制该基因活性能够促进骨骼肌生长,应用到畜牧生产上可提高动物的产肉能力[4]。近年有研究发现FST过表达会导致动物肌肉产量增加[5],FST缺失导致肌肉发育不良[6]。Lee等将人的FST克隆到肌肉特异表达载体中,通过显微注射和胚胎移植得到转基因小鼠,这些小鼠都发生肌肉增生和肌肉肥大,肌肉重量是野生小鼠的194%~327%[7]。
鉴于FST基因对哺乳动物的肌肉细胞生长具有显著效应,本研究对猪的FST基因进行克隆测序,并构建可在肌肉细胞中特异表达的真核载体,以期为今后猪FST基因的功能研究及转基因猪培育提供帮助。
1 材料与方法
1.1 材料
1.1.1 质粒、细胞
pGL3-basic质粒、PEGFP-C1质粒、小鼠骨骼肌细胞(C2C12)均来自黑龙江省农业科学院畜牧研究所;pMD18-T购自TaKaRa公司。
1.1.2 主要试剂
rTaq聚合酶、KpnⅠ、HindⅢ购自TaKaRa公司;NheⅠ、AgeⅠ购自NEB公司;无内毒素高纯度质粒小提试剂盒、DNA凝胶回收试剂盒购自Tiangen公司;双荧光素酶检测试剂盒购自Promega公司。
1.2 方法
1.2.1 猪FST基因编码区的克隆测序
利用Primer5.0软件,根据GenBank上已提交的猪FST基因序列设计引物F1和R1(见表1),上下游引物两端分别添加KpnⅠ和HindⅢ酶切位点。利用常规PCR扩增目的片段,1%琼脂糖凝胶电泳检测后,回收目的片段,连入T载体,转化入大肠杆菌感受态细胞,LB固体培养及过夜培养,挑取单克隆菌落鉴定后,送交Invitrogen公司测序。
1.2.2 猪α-actin基因启动子核心区域的确定
猪α-actin基因启动子核心区域位于-1 089~-821 bp之间[8],本研究利用Primer 5.0软件,设计1对可用于扩增α-actin基因启动子核心区域的引物F2和R2,上下游分别引入NheⅠ和AgeⅠ酶切位点(见表1)。将该片段连入T载体,克隆测序证明序列正确后,经双酶切,连入pEGFP-C1载体,构建pEGFP-C1-α-actin质粒。以该质粒为模板,设计引物F3和R3,上下游分别引入KpnⅠ和HindⅢ酶切位点(见表1),扩增质粒上的CMV(巨细胞病毒)序列和引入的α-actin基因序列,将该片段再次连入T载体,构建pMD18-T-CMV-α-actin质粒,送交公司测序。将测序结果正确的质粒,使用KpnⅠ和HindⅢ双酶切后得到的CMV-α-actin片段连入pGL3-basic载体,构建pGL3-basic-CMV-α-actin质粒。将该质粒转染C2C12细胞,利用双荧光素酶报告基因检测试剂盒(Promega)检测报告基因的表达水平,RLA数值为3次重复,试验结果平均值±标准差,具体操作步骤参见Promega检测试剂盒说明书。
1.2.3 猪FST基因肌肉细胞特异表达真核载体的构建
以构建成的pMD18-T-FST和pEGFP-C1-αactin质粒为模板,使用KpnⅠ和HindⅢ分别进行双酶切,将目的片段回收后,使用T4连接酶,将猪的FST基因片段连入pEGFP-C1-α-actin质粒,构建pEGFP-C1-α-actin-FST质粒。
1.2.2FST基因真核表达载体的转染及相关基因的Real-time PCR检测
将pEGFP-C1-α-actin-FST质粒采用脂质体方法转染C2C12细胞,转染24 h后,收集细胞,提取RNA,反转录成cDNA。根据GenBank上已提交的鼠的生肌决定因子(MyoD),肌细胞生成素基因(MyoG),肌肉抑制素基因(MSTN),生长分化因子11(GDF11),管家基因(GAPDH)基因序列设计引物(见表1),利用相对定量Real-time PCR方法检测在C2C12细胞中过表达FST基因后上述基因表达变化情况。
2 结果与分析
2.1 猪FST基因序列
PCR克隆测序后显示,猪的FST基因完整编码区长1 032 bp,与网上已提交的猪FST基因序列相似度达99.13%。说明目的片段扩增正确。
2.2 猪α-actin基因启动子核心区域的双荧光素酶检测结果
在α-actin基因启动子核心区的前端引入CMV强启动子,连入pGL3-basic,转染C2C12细胞后,双荧光素酶检测结果显示,CMV+α-actin可有效启动荧光素酶的表达(见图1)。

表1 引物介绍Table 1 Primer introduction

图1 双荧光素酶活性测定结果Fig.1 Dual luciferase activity measured results
2.3 猪FST基因真核表达载体的鉴定结果
pEGFP-C1-α-actin-FST质粒经KpnⅠ和HindⅢ双酶切后,可获得1条长约1 000 bp片段,与已知的FST片段大小一致;pEGFP-C1-α-actin-FST质粒经AseⅠ和AgeⅠ双酶切后,可获得1条长约1 000 bp片段,与已知的CMV(594 bp)+α-actin(420 bp)片段大小一致(见图2),测序结果表明连入的片段正确。
2.4 相关基因的相对表达量
由图3可知,FST基因过表达后,MYOD、MYOG、MSTN、GDF11的表达也均上调,通过SPSS软件分析其中FST和MSTN表达量极显著升高(P<0.01),MYOD表达量显著升高(P<0.05),MYOG、GDF11表达量无显著变化。
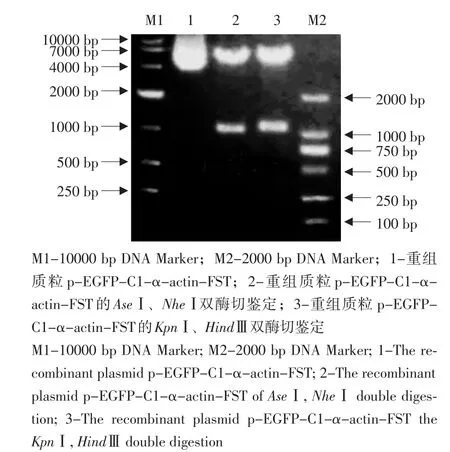
图2 p-EGFP-C1-α-actin-FST载体的酶切鉴定Fig.2 p-EGFP-C1-α-actin-FST carrier restriction endonuclease

图3 Real-time PCR检测相关基因的相对表达量Fig.3 Relative expression of related genes by Real-time PCR detection
3 讨论与结论
天然启动子种类繁多且各具特点。有些启动单基因转录,而另外一些与多个基因转录有关[9]。在进行基因重组体外表达研究时,可采用增加启动子的数目提高外源基因表达效率[10-12]。刘京鸽等研究发现,CMV或者是SV40可显著改善猪骨骼肌特异性表达基因α-actin启动子活性,其中启动子CMV效果尤其明显[8]。本试验构建组成型启动子CMV加α-actin基因启动子核心区域双启动子载体,通过双荧光素酶的检测证明双启动子载体的活性确实很高,这与刘京鸽等研究结果一致。本研究发现,在C2C12细胞中过表达猪FST基因后,MSTN基因表达显著升高,这与Kocamis、岳群华等研究结果相同[13-14]。原因是FST通过与MSTN直接结合而阻止MSTN行使生物学功能,这种FST对MSTN抑制作用是通过改变表达形式而发挥作用。但如果FST持续高表达,会通过负反馈机制引起MSTN表达增加,但FST增加仍会抑制增加的MSTN与受体结合及其生理功能,促进骨骼肌发育。因此,肌肉仍然表现旺盛生长状态,细胞电子体积增加。因此可通过调节FST基因表达促进骨骼肌生长。本研究成功构建一个可在猪肌肉组织中特异表达真核载体p-EGFPC1-α-actin-FST,人工合成双启动子的启动效率显著提高;在C2C12细胞中,FST基因过表达可显著提高MSTN基因的表达,促进骨骼肌细胞生长。
[1]Robertson D M,Klein R,Devos F L,et al.The isolation of polypeptides with FSH suppressing activity from bovine follicular fluid which are structurally different to inhibin[J].Biochem Biophys Res Commun,1987,149:744-749.
[2]Ueno N,Ling N,Ying S Y,et al.Isolation and partial characterization of FS:A single chain Mr 35,000 monomeric protein that inhibits the release of follicle-stimulating hormone[J].Proc Natl Acad Sci USA,1987,84:8282-8286.
[3]Shimasaki S,Koga M,Esch F,et al.Porcine follistatin gene structure supports two forms of mature follistatin produced by alternative splicing[J].Biochem Biophys Res Commun,1988,152: 717-723.
[4]贾明玉,佟慧丽,李树峰,等.牛肌肉抑制素前肽对牛肌卫星细胞增殖的影响[J].东北农业大学学报,2012,43(9):51-55.
[5]Medeiros E F,Phelps M P,Fuentes F D,et al.Overexpression of follistatin in trout stimulates in-creased muscling[J].Am J Physiol Regul Integr Comp Physiol,2009,297(1):235-242.
[6]Gilson H,Schakman O,Kalista S,et al.Follistatin induces muscle hypertrophy through satel-lite cell proliferation and inhibition of both myostatin and activin[J].Am J Physiol Endocrinol Metab, 2009,297(1):157-164.
[7]Lee S J.Regulation of muscle mass by myostatin[J].PNAS,2001, 98(16):9306-9311.
[8]刘京鸽.猪肌肉组织骨骼肌特异性基因α-actin启动子的克隆及功能验证[D].武汉:华中农业大学,2010.
[9]高刚,鲁艳芹,韩金祥,等.双启动子对增强型绿色荧光蛋白表达的影响[J].中国生物制品学杂志,2009,22(10):957-967.
[10]章倩倩,刘松财,戴建威,等.CMV与SP双启动子增强外源基因在小鼠骨骼肌中的表达效率[J].中国生物化学与分子生物学报, 2007,23(7):554-559.
[11]冯宇新,房欣,史国利,等.带有CMV、CEA启动子的腺病毒载体介导TK基因在肿瘤细胞中的表达特性[J].基础医学与临床, 1999,19(5):32-36.
[12]张韩杰.双启动子表达载体的构建以及酯酶B1基因的表达[D].泰安:山东农业大学,2004.
[13]Kocamis H,Gulmez N,Aslan S,et al.Follistatin alters myostatin gene expression in C2C12muscle cells[J].Acta Veterinaria Hungarica,2004,52(2):135-141.
[14]岳群华,袁建龙,郝斐,等.转卵泡抑制素基因对绵羊肌源性细胞中肌肉抑制素基因的调控[J].中国农业科学,2013,46(2): 385-393.
Pig follistatin gene-specific expression vector and identification/LIU Di1,2,
YIN Xue1,ZHANG Dongjie2,WANG Liang2,SUN Yameng1,ZHANG Xiaohui1(1.School of Animal Sciences and Technology,Northeast Agricultural University,Harbin 150030,China;2.Institute of Animal Husbandry,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China)
RT-PCR was used to amplify the entire coding region of theFSTgene pigs,With double enzymes and the connection method to build can be specific in the muscle cells of eukaryotic expression vector,and transfected C2C12cells for verification.The results showed that pigsFSTgene was 1 032 bp,with the online submitted was 99.13%sequence similarity,successfully constructed a specific expression in the muscle cells of the eukaryotic expression vector pEGFP-C1-α-actin-FST, transfected C2C12cells,by Real-time quantitative PCR,showed overexpressionFSTcould inhibitMSTN gene expression.
pig;FST;specific expression vector;Real-time PCR;overexpression
S828;Q782
A
1005-9369(2014)05-0083-04
2013-12-03
转基因生物新品种培育重大专项(2011ZX08006-003);国家生猪产业体系岗位科学家项目(CARS-36)
刘娣(1963-),女,教授,博士,博士生导师,研究方向为动物遗传育种与繁殖。E-mail:liudi1963@163.com
时间2014-5-12 9:02:03[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140512.0902.023.html
刘娣,尹雪,张冬杰,等.猪卵泡抑素基因特异表达载体的构建及鉴定[J].东北农业大学学报,2014,45(5):83-86.
Liu Di,Yin Xue,Zhang Dongjie,et al.Pig follistatin gene-specific expression vector and identification[J].Journal of Northeast Agricultural University,2014,45(5):83-86.(in Chinese with English abstract)
