IBV HH06株N基因原核表达及间接ELISA方法的建立
2014-01-14李广兴王新潘龙杜威威黄小丹孙刚杨贵君任晓峰
李广兴,王新,潘龙,杜威威,黄小丹,孙刚,杨贵君,任晓峰
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江职业学院,哈尔滨 150080;3.黑龙江省动物卫生监督所,哈尔滨 150090)
IBV HH06株N基因原核表达及间接ELISA方法的建立
李广兴1,王新1,潘龙1,杜威威1,黄小丹2,孙刚3,杨贵君1,任晓峰1
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江职业学院,哈尔滨 150080;3.黑龙江省动物卫生监督所,哈尔滨 150090)
鸡传染性支气管炎(Avian infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的一种急性、高度接触性传染病。试验根据NCBI发表的IBV基因序列设计引物,利用RT-PCR方法扩增病毒的N基因,并将其导入pET-30a(+)载体中,构建原核表达质粒。SDS-PAGE及Western-blot检测结果表明,重组蛋白得到表达并能与IBV阳性血清有很好的反应性。以纯化后的重组蛋白作为包被抗原,在包被量为2.5 μg·mL-1、血清1∶40倍稀释条件下,建立并优化间接ELISA检测方法。临床样品检测表明,该方法可高效检测出IBV抗体,并与IBV病毒作为包被抗原ELISA检测结果一致,为IB的快速诊断及流行病学研究奠定基础。
鸡传染性支气管炎病毒;N基因;原核表达;间接ELISA
Key words:Infectious bronchitis virus;N protein;prokaryotic expression;indirect ELISA
鸡传染性支气管炎(Avian infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的急性、高度接触传染性呼吸道疾病[1]。IBV是尼多病毒目冠状病毒科冠状病毒属成员之一。基因组为不分节段单股正链RNA,长27.6 kb,病毒粒子带有囊膜和纤突。IBV基因组有10个明显的开放阅读框,主要编码病毒的4种结构蛋白,即S蛋白、M蛋白、N蛋白、E蛋白以及一些非结构蛋白[2]。目前,IBV基因定位顺序为5' 1a-1b-S-3a-3b-E-M-5a-5b-N-PolyA 3'[3]。1930年在美国北达科塔州IB首次被发现,我国于1972年由邝荣禄等在广东首次发现本病。目前世界上已分离出30多个血清型。由于新的血清型不断出现,给IB的防治带来一定困难。Agustina等对阿根廷2001~2008年所分离的20株毒株相关蛋白核苷酸和氨基酸序列进行分析,仅发现5株分离株属于Massachusetts型或Connecticut型,其他毒株分成3个群,且生成群之间没有相关性和地理格局,这些结果可说明以Mass血清型疫苗免疫计划控制IB失败的原因[4]。目前对于IBV研究主要集中在病毒遗传变异和致病机制研究,其中以S蛋白在病毒与宿主细胞相互作用及其分子特征最为活跃,但是由于S蛋白高度变异使其在该病的快速准确诊断方面受限制。IBV N蛋白是病毒内核衣壳蛋白,是一种磷酸化蛋白,不能被糖基化,由409个氨基酸组成,分子质量为46 ku,在进化上最为保守。在IBV感染过程中,N蛋白刺激机体产生的ELISA抗体出现最早,效价最高,还可引起细胞介导免疫应答[5]。因此,N蛋白对IB的诊断防治和新型基因工程疫苗研究是稳定的免疫原。本研究将IBV分离株HH06的N基因克隆到原核表达载体pET-30a(+)中进行诱导表达,以纯化的重组蛋白作为包被抗原初步建立IBV抗体间接ELISA检测方法,为今后IB快速诊断和流行病学研究奠定基础。
1 材料与方法
1.1 病毒、质粒、菌株、血清及鸡胚
克隆载体pMD18-T(50 ng·μL-1)购自大连宝生物工程公司;pET-30a(+)为本实验室保存;大肠杆菌JM109、Rossetta感受态细胞由本实验室制备并保存;9~11日龄SPF鸡胚由哈尔滨兽医研究所SPF实验动物中心提供。大肠杆菌阳性血清及沙门氏菌阳性血清由哈尔滨兽医研究所刘思国研究员惠赠;AIV阳性血清由哈尔滨兽医研究所王秀荣研究员惠赠;IBV鸡阳性血清、NDV阳性血清由哈尔滨兽医研究所禽传染病研究室刘胜旺研究员惠赠;ALV阳性血清由本实验室保存;IBV血清临床样本由黑龙江省动物卫生监督所提供。
1.2 主要试剂
限制性内切酶EcoRⅠ和XhoⅠ、T4DNA连接酶、ExTaq酶、DNA Marker、低蛋白Marker(购自大连宝生物工程公司);HRP标记兔抗鸡IgG二抗(购自北京博奥森公司);质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒(购自北京索莱宝科技有限公司)。琼脂糖购自Biowest公司;溴化乙锭(Ethidium bromide,EB)、4-氯-1-萘酚、牛血清白蛋白(Albumin from bovine serum,BSA)均购自Sigma公司;96孔酶标板购自广州洁特生物过滤制品有限公司。
试验所用其他常规试剂均为分析纯。
1.3 引物的设计与合成
本试验共需两对引物,首先设计克隆引物,参考NCBI上发表的鸡传染性支气管炎病毒SC021202设计一对引物,上游引物HH06-N up:5'CGCT CAATCGCTGGTATG 3';下游引物HH06-N down:5'CGGCACTGGCGTCTTTAT 3',包含完整N基因阅读框;之后又根据测序结果设计一对针对N基因的亚克隆引物:上游引物S:5'CCGGAATTCATGGCA AGCAGTAAGGCA 3'(下划线处为EcoRⅠ酶切位点);下游引物P:5'CCGCTCGAGTCAAAGTTCA TTTTCACC 3'(下划线处为XhoⅠ酶切位点),两对引物均由哈尔滨博仕生物技术公司合成。
1.4 病毒基因组RNA提取及N基因扩增
将IBV HH06株接种于9~11日龄SPF鸡胚中,接种剂量0.1 mL·胚-1,弃去24 h内死亡胚,72 h后收集尿囊液。用Trizol方法提取病毒基因组RNA并进行反转录获得cDNA。以HH06-N up和HH06-N down为引物,cDNA为模板进行N基因的PCR扩增。PCR反应条件:94℃5 min;55.7℃30 s;72℃2 min,共30个循环。PCR产物经琼脂糖凝胶DNA回收试剂盒回收纯化,与pMD18-T载体连接,重组质粒命名为pMD18-T-N,转化大肠杆菌JM109感受态细胞,12 h后挑取形态规则、大小均一的菌落。用质粒小提试剂盒提取重组质粒,并用菌液PCR和EcoRⅠ、PstⅠ进行双酶切鉴定,鉴定正确的质粒进行测序。
1.5 N基因的亚克隆、N基因原核表达质粒pETN构建及鉴定
根据1.4测序结果,设计一对针对N基因的亚克隆引物,上游引物:5'CCGGAATTCATGGCAAG CAGTAAGGCA 3'(下划线处为EcoRⅠ酶切位点);下游引物:5'CCGCTCGAGTCAAAGTTCATTTTCAC C 3'(下划线处为XhoⅠ酶切位点),以pMD18-T-N阳性质粒为模板,进行PCR扩增,将纯化回收后的N基因及空载体质粒pET-30a(+)用EcoRⅠ、XhoⅠ进行双酶切,经胶回收试剂盒纯化回收。T4DNA连接酶进行连接,10 μL连接体系:10× T4DNA ligase buffer 1 μL,目的片段6 μL,pET-30a(+)2.5 μL,T4DNA ligase 0.5 μL,16℃连接过夜。连接产物转化大肠杆菌感受态细胞JM109,挑取单一菌落,用质粒小提试剂盒提取重组质粒,并用菌液PCR和EcoRⅠ、XhoⅠ双酶切鉴定,鉴定正确的质粒进行测序,阳性重组质粒命名为pET-30a-N。
1.6 N重组蛋白诱导表达及鉴定
将测序正确重组质粒转化入大肠杆菌Rossetta感受态细胞中,挑取单菌落至含有Kan+LB液体培养基中,37℃振荡培养过夜;按照1∶100比例转接于新含有Kan+LB液体培养基中,37℃振荡培养至OD600值达到0.4~0.6,加入终浓度1 mmol·L-1IPTG进行诱导。37℃诱导6 h后收集菌体沉淀,超声波裂解破碎细菌后,收集上清,沉淀用PBS悬起,按1∶1加2×上样Buffer煮沸10 min,用12%SDSPAGE进行电泳分析,考马斯亮蓝染色15 min后脱色观察电泳结果。将另一块SDS-PAGE转移至硝酸纤维素膜上,用IBV全病毒多抗(1∶800)为一抗,HRP标记羊抗兔IgG(1∶800)为二抗进行Western-blot分析,鉴定表达产物及其免疫原性。
1.7 重组蛋白的纯化
重组蛋白的纯化按照Ni-NTA试剂盒说明书提供的方法进行,将表达的菌体离心,沉淀用Lysis Buffer悬起,超声波裂解后,12 000 r·min-1离心3 min,收集上清。将上清与已经平衡的Ni离子纯化树脂在4℃充分结合2~3 h,然后分别用Washing buffer和Elution buffer洗脱液分步洗脱,收集各步洗脱液,测定蛋白浓度同时进行SDS-PAGE分析目的蛋白的纯化效果。
1.8 间接ELISA检测方法的初步建立
1.8.1 抗原包被浓度及血清稀释度的确定
将纯化后的N蛋白作为诊断抗原,用包被液(0.05 mol·L-1碳酸盐缓冲液,pH 9.6)将诊断抗原分别稀释至40、20、10、5、2.5、1.25 μg·mL-1,每孔100 μL包被酶标板,4℃过夜。固定封闭液浓度及时间,IBV阳性血清和阴性血清用PBS分别稀释至1∶40、1∶80、1∶160、1∶320,固定血清作用时间、二抗浓度及时间、显色时间。常规ELISA方法进行多孔测定,结果取平均值并计算P/N值,确定最佳抗原包被浓度和血清稀释度。
1.8.2 封闭试剂的选择
在确定最佳抗原包被浓度和最佳血清稀释度的基础上,分别用5%脱脂乳、1%BSA、3%BSA和5%BSA作为封闭液,200 μL·孔-1,37℃封闭2 h。同时设立两个复孔,测定OD490值,并分析P/N值变化情况。
1.8.3 一抗孵育时间的确定
根据以上筛选条件,固定抗原包被浓度、血清稀释度、封闭液浓度、二抗稀释度及时间、显色时间设定血清作用时间分别为0.5、1、1.5、2 h。同时设立2个复孔,常规ELISA方法测定P、N值,计算P/N值,确定血清最佳作用时间。
1.8.4 二抗最佳稀释度的选择
将二抗按1∶500、1∶800、1∶1 000、1∶2 000稀释,其他条件为优化条件,同时设立两个复孔,测定P、N值,根据P/N值确定二抗最佳稀释度。
1.8.5 二抗作用时间的确定
根据选择的最佳条件,固定显色时间,将二抗作用时间分别设为0.5、1、1.5、2 h。同时设立两个复孔,测定OD490值,根据P/N值确定二抗最佳作用时间。
1.8.6 最佳底物显色时间的确定
根据筛选条件,将底物显色时间设为5、10、15、20 min。同时设立两个复孔,测定P、N值,并计算P/N值,确定底物显色最佳时间。
1.8.7临界值的确定
随机抽取96份SPF阴性血清,按上述确定间接ELISA方法检测,计算96份SPF鸡血清的OD490平均值()和标准差(SD),阴阳性临界值的判断方法为:临界值=+3SD。当待检样本OD490值≥+3SD时,在99.9%水平上判定为阳性。
1.9 重复性试验
1.9.1 板内重复性试验
用同一批制备的蛋白包被酶标板,随机取30份血清,每份血清做3个重复,在同一条件下按照间接ELISA的程序进行检测,结果进行统计学分析。
1.9.2 板间重复性试验
用同批次制备的蛋白包被3块酶标板,控制相同反应条件,3块酶标板分别检测30份不同血清样本,在同一条件下按照间接ELISA的程序进行检测,结果进行统计学分析。
1.9.3 特异性试验
按上述间接ELISA操作流程,在同一条件下对禽流感病毒、新城疫病毒、禽白血病病毒、大肠杆菌、沙门氏菌的阳性血清进行测定,以IBV阳性和阴性血清作为对照,进行特异性试验,检测该间接ELISA方法是否存在交叉反应。
1.9.4 敏感性试验
将IBV阳性血清作1∶50、1∶100、1∶200、1∶300、1∶400、1∶500、1∶600、1∶700倍比稀释,每个稀释度做3个重复,用建立的间接ELISA方法测定其OD490值。
1.9.5 临床样品的检测
应用建立的间接ELISA方法,对鸡场采集的血清进行检测,检测是否存在IBV抗体。
2 结果与分析
2.1 pMD18-T-N重组质粒的酶切鉴定
重组质粒经EcoRⅠ单酶切鉴定,可酶切约4 442 bp的片段;经EcoRⅠ、PstⅠ双酶切鉴定,可酶切约1750bp的目的片段和pMD18-T载体片段,表明目的片段已插入pMD18-T载体,与预期相符(见图1A)。
2.2 重组表达质粒的鉴定
重组表达质粒pET-30a-N经EcoRⅠ单酶切鉴定和EcoRⅠ、XhoⅠ双酶切鉴定,单酶切大小约为6 650 bp;双酶切可酶切约1 230 bpN基因和5 422 bp pET-30a(+)载体片段,与预期结果相同。表明重组表达质粒pET-30a-N构建成功(见图1B)。

图1 重组质粒的酶切鉴定Fig.1 Identification of recombinant plasmid by restriction endonucleases digestion
2.3 重组蛋白的诱导表达
重组质粒pET-30a-N转入表达菌感受态细胞后,挑取单个菌落加入液体LB培养基,PCR鉴定的阳性菌液经IPTG诱导表达,取0~6 h菌液进行SDS-PAGE分析,结果显示在51 ku位置出现明显条带,而对照组在相应位置没有条带表达(见图2)。将诱导表达的菌体,超声处理后将上清、沉淀进行12%电泳分析,从图中可以看出此条带出现在上清中,说明蛋白是以可溶形式存在。
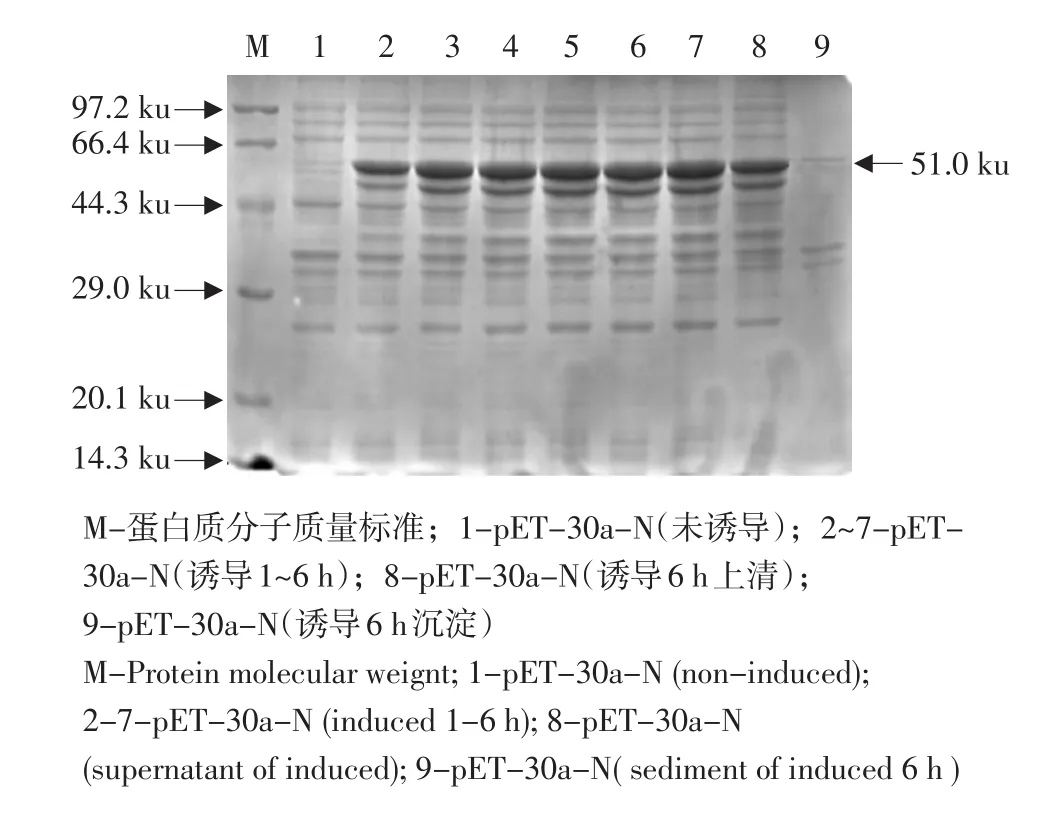
图2 蛋白诱导表达产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of expressed N protein
2.4 表达产物Western-blot鉴定
表达产物转移至硝酸纤维素膜上后,用IBV全病毒多抗对N融合蛋白进行Western-blot检测。N融合蛋白可与相应IBV全病毒多抗发生特异性反应(见图3)。

图3 重组蛋白的Western-blot鉴定Fig.3 Western-blot of the recombinant protein
2.5 重组蛋白的纯化
重组蛋白经镍柱纯化后,可获得单一目的条带,效果较好(见图4)。
2.6 间接ELISA方法的建立
2.6.1 最佳抗原包被浓度和最佳血清稀释度的确定
由表1的数据分析,抗原的最佳包被浓度为2.5 μg·mL-1,血清的最佳稀释度为1∶40,此时的OD490接近于1.0,且P/N值最大,结果见表1。

图4 重组蛋白的纯化Fig.4 Purification of recombinant protein
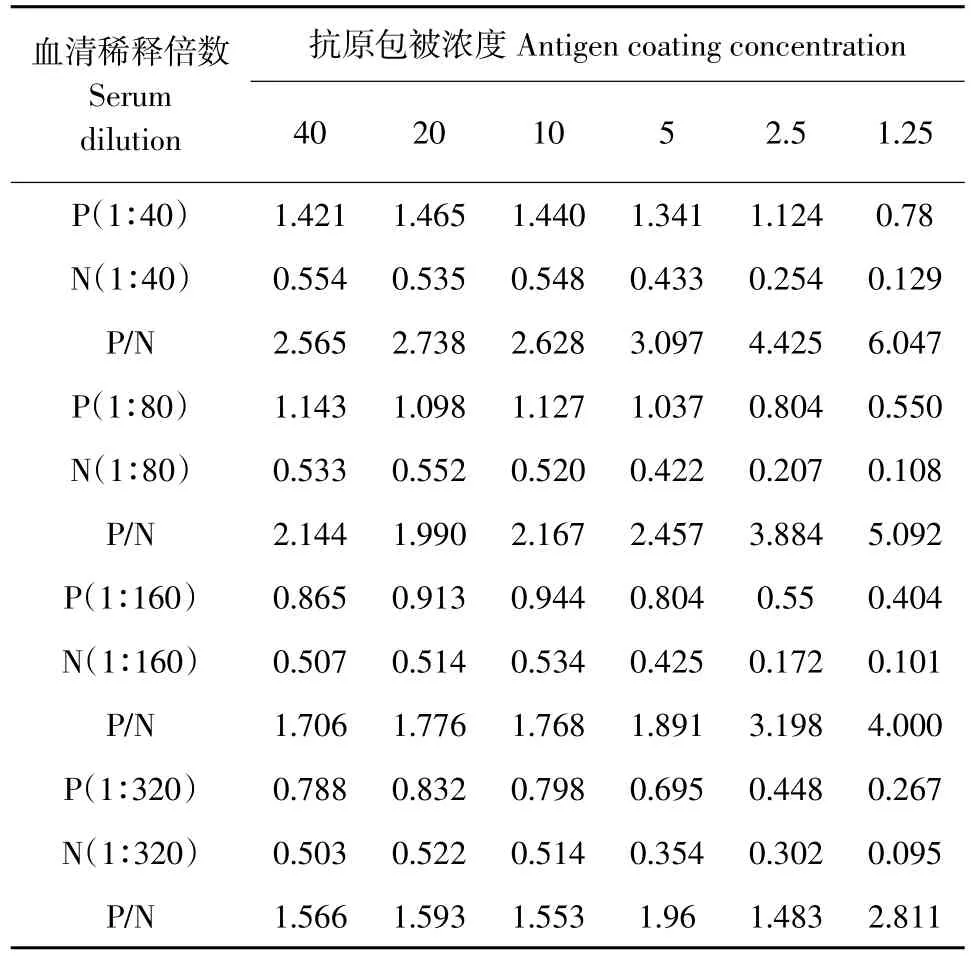
表1 血清稀释倍数与抗原包被浓度的确定Table 1 Optimization of serum concentration and antigen coating concentration (μg·mL-1)
2.6.2 最佳封闭液的选择及封闭时间的确定
由图5(A)的数据可以看出,1%BSA作为封闭液时P值接近于1,P/N值最大,所以最佳封闭液为1%BSA。由图5(B)可知,当封闭时间为120 min时,P值接近于1,P/N值最大,所以最佳封闭时间为120 min。
2.6.3 最佳血清作用时间的确定
由图5(C)的数据可知,当血清作用1 h时,P值接近于1,且P/N值最大,所以最佳血清作用时间为1 h。
2.6.4最佳二抗工作浓度及二抗作用时间的确定
由图5(D)的数据分析可以看出,二抗的工作浓度为1∶1 000时,P值接近于1,P/N值最大,所以最后选择1∶1 000为最佳二抗稀释度。由图5(E)可知,当二抗作用时间为1 h时,OD490值接近于1,P/N值最大,故二抗最佳作用时间为1 h。
2.6.5 最佳底物作用时间的确定
根据以上试验确定的条件,当底物显色时间为10 min时,P值接近于1,且P/N最大。因此最佳底物显色时间为10 min,结果见图5(F)。
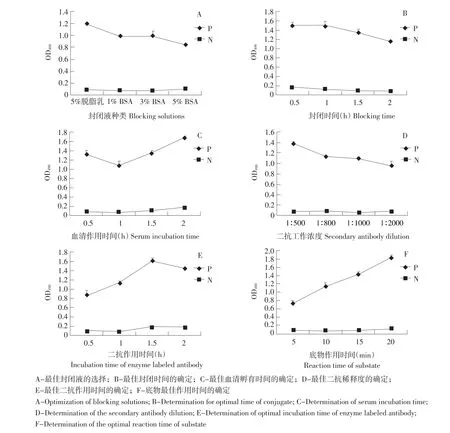
图5 最佳优化条件的确定Fig.5 Determination for optimal conditions of this ELISA
2.6.6 临界值确定
取96份SPF鸡阴性血清进行OD490值的测定,根据计算,96份阴性血清的OD490平均值为0.180,标准差为0.016,根据临界值的计算方法,临界值= 0.180+3×0.016=0.2 286。由此,当样品的OD490值≥0.2286时,可在99.9%可信度上判定为阳性,否则为阴性。
2.6.7 重复性试验
30份血清的板内CV最小值为0.6%,最大值为6.5%;板间CV最小值为1.6%,最大值为12.3%,均小于15%,表明建立的间接ELISA检测方法具有良好的重复性。
2.6.8 特异性试验
将禽白血病病毒、禽流感病毒、新城疫病毒、大肠杆菌、沙门氏菌的阳性血清和IBV阳性血清、阴性血清通过试验建立的间接ELISA检测方法作对比,通过数据分析显示,禽白血病病毒、禽流感病毒、新城疫病毒、大肠杆菌、沙门氏菌的阳性血清OD490值均小于判定IBV阳性临界值0.2 286,与IBV阳性血清均无交叉反应,表明该方法具有良好的特异性(见图6)。
2.6.9 敏感性试验
将IBV阳性血清作8个梯度稀释,用已建立的间接ELISA方法测定OD490值,由表2可知,当阳性血清1∶500倍稀释时,其结果为阳性,表明该方法具有良好的敏感性(见表2)。
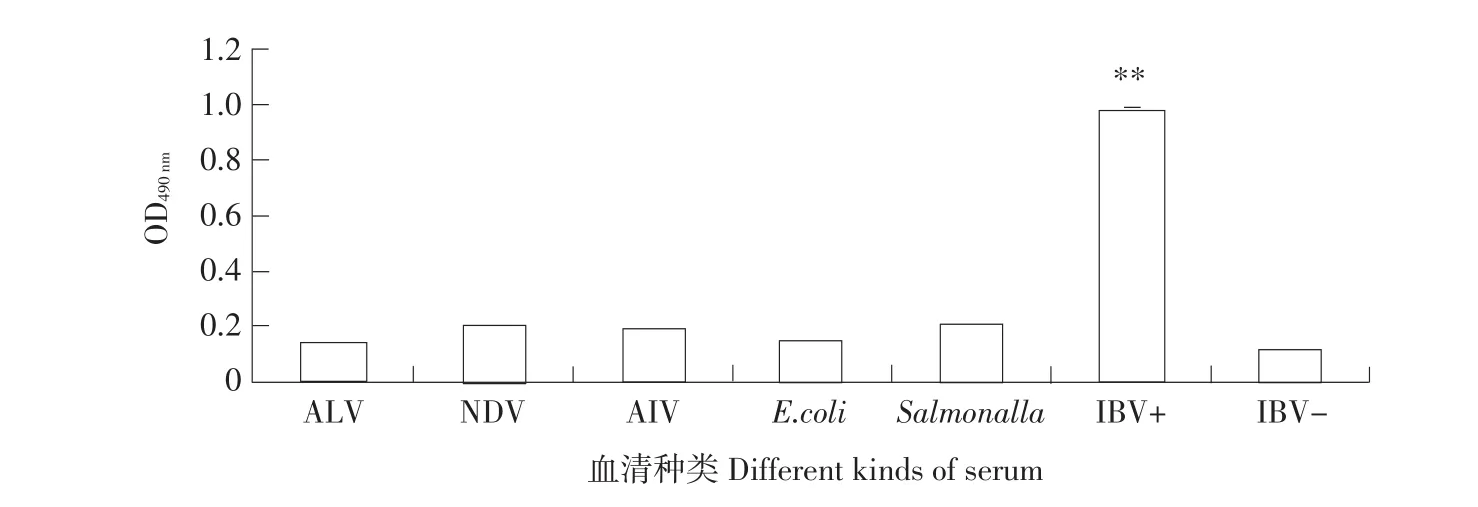
图6 特异性试验结果Fig.6 Result of specificity test of other avian viruses
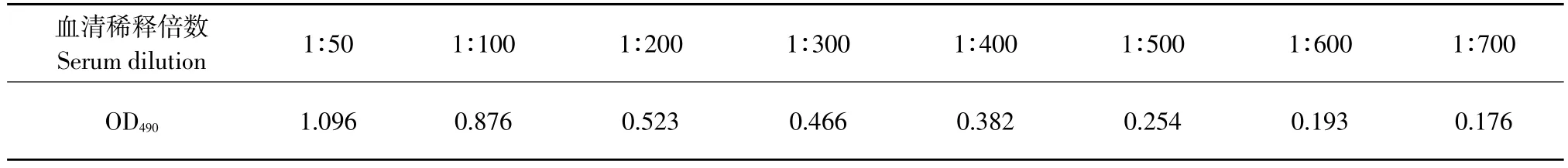
表2 间接ELISA的敏感性试验Table 2 Results of sensitivity test
2.6.10 临床样本的检测
应用所建立的间接ELISA方法对两个鸡场的血清样本进行IBV抗体检测,鸡场1共75份蛋鸡血清样本,71份为阳性,阳性率为94.7%,OD490值在0.351~1.738,与病毒作为包被抗原ELISA检测的符合率为94.7%;鸡场2共60份肉鸡血清样本,50份为阳性,阳性率为83.3%,OD490值在0.347~1.684,与病毒作为包被抗原ELISA检测的符合率为84.7%(见表3)。结果表明,两个鸡场经过三次IB疫苗免疫后,均产生较高的IBV抗体水平。

表3 临床样品检测结果Table 3 Results of clinical test
3 讨论与结论
本试验将IBV HH06株的N基因片段成功克隆,在大肠杆菌表达系统中表达N基因,SDSPAGE电泳结果证实N基因表达,且为可溶性表达,重组蛋白与IBV全病毒多抗发生特异性结合,具有良好的反应原性,为建立IBV抗体检测方法奠定基础。
根据IBV的HH06株的氨基酸序列可知,N蛋白的相对分子质量约为45 ku,pET-30a(+)载体本身融合蛋白大小约为6 ku,因此表达的蛋白实际分子质量约为51 ku。本试验在进行SDS-PAGE时,结果发现有两条带,其中一条约为51 ku,与预期大小一致,另一条带分子质量约为47 ku,Western-blot也出现相同结果。在IBV[6-8]、火鸡冠状病毒[9]等已有报道,本试验结果与之相似,故认为47 ku的蛋白可能是51 ku蛋白裂解产物。
N基因在遗传进化中最为保守,将本研究中测序后N基因核苷酸和氨基酸序列(GenBank:KC256943.1)在NCBI上与其他IBV代表毒株(包括典型呼吸型和肾病变型毒株)进行比对,核苷酸同源性高达88%以上,氨基酸同源性高达91%以上,也证明IBV N蛋白遗传稳定性。N蛋白在病毒复制过程中表达量高,刺激机体产生的ELISA抗体出现最早,效价最高[5],在病毒组装和机体细胞免疫等方面有重要作用,所以N蛋白是一种良好的诊断抗原,可用于IBV抗体检测。
ELISA方法检测IBV抗体与其他血清学诊断方法相比有灵敏度高、速度快、安全便捷,在短时间内可检测大量样品、结果可靠等优点,适于实验室血清学诊断及大规模疫病普查。Chen等将N基因在大肠杆菌和昆虫细胞中表达,纯化N蛋白作为包被抗原建立ELISA方法检测IBV抗体。由于没有病毒粒子,提高检测安全性[10]。郝春丽利用纯化后的可溶性的N蛋白建立间接ELISA方法,利用其建立的ELISA方法和商品化试剂盒检测血清样本,其阳性检出率略低于商品化试剂盒,两者符合率达85%[8]。本研究对N基因进行原核表达,且重组蛋白为可溶性表达,表达产量高,纯化较为方便,相较于真核表达系统省时省力。本试验以纯化重组的蛋白作为包被抗原,初步建立IBV抗体的间接ELISA检测方法,并对条件进行优化,可以对其他禽病原阳性血清进行特异性鉴别诊断;检测临床样品,平均阳性检出率为89%,与病毒作为包被抗原ELISA检测的平均符合率为89.7%,表明本试验获得N蛋白可替代IBV病毒来检测IBV抗体,具有良好的应用价值,可作为临床IBV快速诊断及免疫监测的重要工具。
[1]陈溥言.家畜传染病学[M].5版.北京:中国农业出版社,2009.
[2]王春玲,李晓红,王辉,等.鸡传染性支气管炎病毒的分子生物学研究进展[J].家禽科学,2005(7):45-48.
[3]Lai M M,Cavanagh D.The molecular biology of coronaviruses[J]. Virus Research,1997,48:98-100.
[4]Agustina R,Craig M I,Vagnozzi A.Molecular characterization of avian infectious strains from outbreaks in Argentina(2001-2008) [J].Avian Pathology,2009,38(2):149-153.
[5]Ignjatovic J,Galli L.Structural proteins of avian infectious bronchitis virus:role in immunity and protection[J].Advances in experimental medicine biology,1993,342:449-453.
[6]呼延蓉,郭伟伟,李明义,等.传染性支气管炎N基因克隆及在大肠杆菌中的可溶性表达[J].中国动物检疫,2010,27(4):35-38.
[7]Stern D F,Burgess L,Sefton B F.Structural analysis of vivion proteins of the avian coronavirus infectious bronchitis virus[J]. Journal of Virology,1982,42(1):208-219.
[8]郝春丽.鸡传染性支气管炎病毒S1基因和NP基因的表达及NP-ELISA方法的建立[D].郑州:河南农业大学,2007:6.
[9]Breslin J J,Smith L G,Guy J S.Baculovirus expression of turkey coronavirus nucleocapsid protein[J].Avian Diseases,2001,45: 136-143.
[10]Chen H Y,Coote B,Atree S,et al.Evaluation of a nucleoproteinbased enzyme-linked immunosorbent assay for the detection of antibodies against infectious bronchitis virus[J].Virus Research, 2003,32(5):519-526.
Prokaryotic expression ofNgene of IBV HH06 strain and develop-ment of indirect IBV N protein-mediated ELISA
LI Guangxing1,WANG Xin1, PAN Long1,DU Weiwei1,HUANG Xiaodan2,SUN Gang3,YANG Guijun1,REN Xiaofeng1(1.School of Veterinary Medicines,Northeast Agricultural University,Harbin 150030,China;2.Heilongjiang Polytechnic,Harbin 150080,China;3.Heilongjiang Veterinary Sanitation and Epidemic Prevention Station,Harbin 150090,China)
Avian infectious bronchitis(IB)is an acute and highly contagious disease which caused by infectious bronchitis virus(IBV).In the study,according to IBV gene sequences published in GenBank,specific primers were designed to cloneNgene by RT-PCR,and then this gene was inserted into pET-30a(+)vector resulting in a prokaryotic expression plasma pET-30a-N.The results of SDS-PAGE and Western-blot analysis showed that the recombinant protein was expressed successfully and had good reactivity with IBV positive serum.Using purified recombinant N protein as coating antigen,we established and optimized the indirect ELISA protocol,in which N protein was 2.5 μg·mL-1of concentration,sample serum of 1∶40 dilution.For clinical specimen,the IBV antibodies could be detected by this method efficiently,and got nearly the same results as those of IBV-mediated ELISA.It will provide a good tool for rapid diagnosis and epidemiological study of avian infectious bronchitis.
Q786;R526.2+1
A
1005-9369(2014)05-0075-08
李广兴,王新,潘龙,等.IBV HH06株N基因原核表达及间接ELISA方法的建立[J].东北农业大学学报,2014,45(5):75-82.
Li Guangxing,Wang Xin,Pan Long,et al.Prokaryotic expression ofNgene of IBV HH06 strain and development of indirect IBV N protein-mediated ELISA[J].Journal of Northeast Agricultural University,2014,45(5):75-82.(in Chinese with English abstract)
2013-12-16
国家自然科学基金项目(31172295,31272569)
李广兴(1968-),男,教授,博士,博士生导师,研究方向为动物病理学。E-mail:ligx@neau.edu.cn
时间2014-5-20 9:39:20[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140520.0939.001.html
