CT灌注成像用于急性脑梗死患者的预后评估
2014-01-11张卫华刘楠陈辉张微微朱光明
张卫华,刘楠,陈辉,张微微,朱光明
CT灌注成像用于急性脑梗死患者的预后评估
张卫华1,2,刘楠1,陈辉1,张微微1,朱光明1
目的:探讨CT灌注成像(PCT)得到的梗死核心、缺血半暗带与急性脑梗死患者临床预后的相关性。方法:回顾性分析78例急性前循环脑梗死患者。利用PCT评估梗死核心体积、缺血半暗带体积。随访90 d的mRS评分,利用多因素线性回归分析判定PCT与临床预后的相关性。结果:年龄是预后最重要的预测因素(<0.01)。基线NIHSS评分(=0.021)和HMCAS(=0.038)与预后呈负相关。与ICA(和M1)闭塞相比,M1闭塞相对预后较好(=0.012)。血管再通与否也是预后的显著影响因素(=0.010)。PCT得出的梗死核心体积并不能准确预测预后(=0.145),PCT测出的半暗带体积与预后呈正相关(=0.044)。结论:PCT有利于急性脑梗死超早期的治疗决策及早期预后的评估。
灌注CT;缺血半暗带;急性脑梗死;临床预后
急性脑梗死后出现缺血半暗带是一个动态过程,根据再灌注的情况可出现两种转归,一部分缺血区血流恢复,可逐步转变为正常脑组织;反之则形成永久性梗死灶。灌注CT(perfusion CT,PCT)可迅速获得脑灌注情况,了解梗死核心及缺血半暗带体积,快速定量评价梗死程度和预测临床转归,从而制订治疗策略[1]。“时间就是大脑”的概念正逐渐被“影像就是大脑”所替代[2]。一些医院已将灌注技术用于指导急性脑梗死的超早期溶栓治疗。然而,近年来多个随机双盲对照的临床研究在灌注技术用于指导超早期溶栓治疗的作用上并未取得一致[3,4]。有研究认为利用常规CT(normal CT,NCT)加上血管CT(CT angiography,CTA)可以排除出血,了解闭塞血管和侧支循环情况[5]。本研究对急性脑梗死患者进行急诊多参数CT评估,观察PCT下的缺血半暗带与梗死灶体积对于临床预后评估的作用。
1 资料与方法
1.1 一般资料
选择2005年1月至2012年12月在北京军区总医院神经内科收治的急性脑梗死患者。入选标准:①急性前循环脑梗死;②颈内动脉(internal carotid artery,ICA)或大脑中动脉水平段(M1)急性闭塞;③完整的急性卒中CT筛检(基线期,包括NCT、PCT及CTA);④发病至影像扫描时间<12 h;⑤48 h内(访视1)接受血管再通影像学的评估,此评估可为经股动脉数学血管减影术(digital subtraction angiography,DSA)、MRA和CTA;⑥有完备的临床资料,包括年龄、性别、治疗方案(未溶栓、静脉溶栓及血管内治疗)、发病至基线影像时间、发病至再灌注治疗时间、发病至血管再通影像时间、基线期美国国立卫生研究院卒中量表(the NIH stroke scale,NIHSS)评分、90 d的改良Rankin量表(modified Rankin scale,mRS)评分(访视2,可门诊或电话随访)。
1.2 方法
1.2.1 PCT扫描 采用Philips Brilliance64排CT,先行头颅CT平扫,根据平扫结果确定PCT的感兴趣层面。平扫发现早期梗死灶者,以梗死最大层面作为PCT扫描中心层面;平扫无明显异常者,以基底核层面作为PCT扫描中心层面。双筒高压注射器以4~5 mL/s的流率经肘静脉团注入非离子型对比剂40~50 mL。在对比剂开始注射时进行感兴趣层面同步动态CT横轴位扫描,扫描参数为:80 kV、100~200 mA,扫描速度为0.75 s/圈,间隔时间1.5 s,循环32次,层厚5 mm,覆盖范围5 mm×8=40 mm。
1.2.2 CTA扫描 完成脑PCT扫描10 min后,再追加非离子型对比剂进行头颈部的CTA检查。覆盖范围从主动脉弓至颅顶,采取螺旋扫描方式。使用CT双筒高压注射器以5 mL/s的速率经肘静脉团注入非离子型对比剂80 mL。具体扫描参数为120 kV、300 mA,螺距0.923∶1,层厚1 mm。
1.2.3 图像分析流程 所有的影像学资料均导入Mac Pro工作站进行后处理。①NCT影像分析:影像资料导入Osirix 5.6(32位,Mac)软件进行Alberta早期卒中CT评分(Alberta Score Program Early CT Score,ASPECTS)和有无大脑中动脉高密度征(hyperdense middle cerebral artery CT sign,HMCACS)的评估。ASPECTS评分为0~10分,满分10分即为CT未见早期急性卒中征象。HMCACS阴性记录为0,阳性记录为1。②PCT影像分析:利用Philips脑灌注分析软件4.5.2进行梗死灶及缺血半暗带体积的测量。手动选择输入动脉和输出静脉,一般选择健侧大脑前或大脑中动脉作为输入动脉,上矢状窦作为输出静脉,由分析软件自动获得感兴趣区及动态时间-密度曲线(time-density curve,TDC),利用SVD+去卷积算法,生成脑血容量(cerebral blood volume,CBV)、脑血流量(cerebral blood flow,CBF)、平均通过时间(mean transit time,MTT)。利用 MTT相对值(relative MTT,rMTT) 和 CBV绝对值(absolute CBV,aCBV)的阈值定义梗死核心与缺血半暗带的大小。梗死核心:患侧的rMTT大于对侧145%,且aCBV<2.0 mL/100 g。缺血半暗带:患侧的rMTT大于对侧145%,且aCBV>2.0 mL/100 g。分析软件自动计算相应的体积并生成伪彩图。③CTA影像分析:影像资料导入Osirix 5.6(32位)软件分析动脉闭塞部位与严重程度、侧支循环评分(collateral flow score,CS)、ICA狭窄程度评分。动脉闭塞部位记录为:ICA、M1、ICA和M1。动脉闭塞严重程度(基线期和访视1两次)利用TIMI(thrombolysis in myocardial infarction)评分进行评估:0分为完全闭塞;1分为严重的狭窄,远端动脉几乎无血流;2分为轻中度狭窄,远端动脉有血流供应,但较正常差;3分为正常血流。血管再通被定义为2次的TIMI差值≥2,即TIMI访视1-TIMI基线≥2(访视1的TIMI可能通过DSA或MRA的影像获得,评分标准与CTA一致)。NASCET评分标准用于评估颈内动脉的狭窄程度。CS评分定义为0~4分,0分为动脉支配区完全无血流灌注;1分为仅有少量血流灌注;2分为有一定的血流灌注,但较正常差;3分为正常灌注;4分为过度血流灌注。
1.3 统计学处理
采用SPSS 20.0(Mac)软件进行逻辑回归统计学分析,计量资料与等级变量以(x± s)表示,计数资料记录其频数及百分率。其中因变量为90 d的mRS评分,90 d的mRS评分≤2分定义为预后好;90 d的mRS评分>2分定义为预后差。将所有自变量(影响因素)均引入多因素回归模型进行分析,<0.05的因素为有显著性意义;自变量筛选采用最大似然估计的逐步回归分析法(Stepwise LR)。
2 结果
2.1 人口学资料
共计纳入78例患者,男40例(52.3%),女38例(48.7%);年龄42~81岁,平均(62.3±8.9)岁;①预后好(90 d mRS评分≤2分)35例,女17例(48.6%);年龄(60.8±7.1)岁;发病至基线影像时间(6.5± 8.4)h,发病至再灌注治疗时间(8.7±5.9)h,发病至血管再通影像时间(25.7±16.0)h;基线NIHSS评分(11.4±4.2)分;ASPECTS评分为(7.0±2.6)分;HMCAS阳性 21例(60.0%);血管闭塞为ICA6例(17.1%),M1段25例(71.5%),ICA+M1段4例(11.4%);侧支循环评分为(1.8±1.1)分;PCT核死灶体积为(27.4±36.3)mL,PCT半暗带体积为(45.9±17.8)mL;无血管再通治疗14例(40.0%),静脉溶栓18例(51.4%),动脉溶栓 3例(8.6%);血管再通成功 18例(51.4%);②预后差(90 d mRS评分>2分)43例,女21例(48.8%);年龄(65.4± 10.1)岁;发病至基线影像时间(7.4±6.3)h,发病至再灌注治疗时间(9.2±3.6)h,发病至血管再通影像时间(29.4±13.8)h;基线NIHSS评分(16.5±4.3)分;ASPECTS评分为 (6.9±2.9)分;HMCAS阳性 30例(69.8%);血管闭塞为ICA 6例(14.0%),M1段28例(65.1%),ICA+M1段9例(20.1%);侧支循环评分为(1.7±1.1)分;PCT核死灶体积为(31.9±41.3)mL,PCT半暗带体积为(32.7±21.3)mL;无血管再通治疗17例(39.6%),静脉溶栓20例(46.5%),动脉溶栓6例(13.9%);血管再通成功17例(39.6%)。
2.2 多因素分析结果
多因素逻辑回归分析表明,年龄是预后最重要的预测因素,年龄越大,患者的预后越差(<0.01);基线 NIHSS评分 (= 0.021)和HMCACS(=0.038)与患者的预后呈负相关,NIHSS评分高和HMCACS阳性均提示预后差;与ICA(和M1)闭塞相比,M1闭塞相对预后较好(=0.012);血管再通与否也是预后的显著影响因素(=0.010),血管成功再通后预后好的概率比预后差要高6.58倍;PCT得出的梗死核心体积并不能准确预测预后(=0.145),PCT测出的半暗带体积与预后呈正相关,半暗带的体积大,预后较好(=0.044),见表1。

表1 多因素逻辑分析显示与患者预后相关的影响因素
2.3 模型拟合效果判断
模型拟合效果显示,35例预后好的患者中,有6例错判为预后差(判断正确率82.8%);43例阴性结果患者中,有9例错判为阳性结果(判断正确率79.1%),总体预测正确率80.8%,见图1、2。

图1 时间窗内静脉溶栓的1例预后差的急性脑梗死患者
3 讨论
缺血半暗带是指梗死区周围的脑组织,其神经元功能发生紊乱但可能恢复。缺血半暗带不稳定,具有动态变化性[6]。脑PCT是1991年由Miles等[7]首先提出的概念,半定量测定脑组织的血流灌注量,有效反映脑组织血流灌注量的变化,从而获得脑组织功能方面的信息。目前抢救缺血半暗带的关键是超早期溶栓治疗。研究发现,PCT能在超早期发现脑缺血的部位和病变范围,可在出现症状后立即显示异常病灶,从影像学角度证实缺血半暗带,并能真正反映脑缺血的范围[8]。
本研究提示年龄是预后最重要的预测因素,年龄越大,患者的预后越差。这与大规模临床研究的结果一致[9,10],高龄患者伴有多个危险因素,并发症也较多,临床预后亦较差。本研究应用相同的病例样本,进行影像学预后的评估发现,年龄与最终的梗死体积并无相关性,同样也支持以上的观点。基线NIHSS评分和HMCAS与患者的预后呈负相关。与ICA(和M1)闭塞相比,M1闭塞相对预后较好。血管再通与否也是预后的显著影响因素。这些结果均与文献相似[11,12]。
本研究显示,PCT得出的梗死核心体积并不能准确预测预后,而PCT测出的半暗带体积虽然与预后有相关性,但预测能力也并不强。分析原因如下:①DWI仍是急性梗死灶判定的金标准,PCT得出的梗死核心与CBV的设定阈值有关,但什么样的阈值能真实反映梗死灶,目前仍存在很多争议;②急性脑梗死患者的临床预后不仅与最终梗死体积有关,同样也与脑功能区的受累情况有关,相同梗死体积下,内囊区或优势半球受累的患者临床预后会较差;③缺血半暗带体积的大小不能提示最终梗死体积的大小,最终梗死体积取决于梗死核心大小、缺血半暗带与血管再通三者的关系。如图1的患者,缺血半暗带很小而梗死灶巨大,虽处于时间窗内且静脉溶栓治疗血管有再通,临床预后仍很差。如图2所示,患者处于溶栓治疗时间窗内且PCT提示梗死核心小而缺血半暗带巨大,静脉溶栓后血管再通,患者预后较好。由此可见,单独应用梗死灶、缺血半暗带及血管再通情况中的某一个因素去预测临床预后失之偏颇。因此,一个完善的急性卒中早期影像评估,应能提供梗死灶、缺血半暗带及血管闭塞部位等信息。
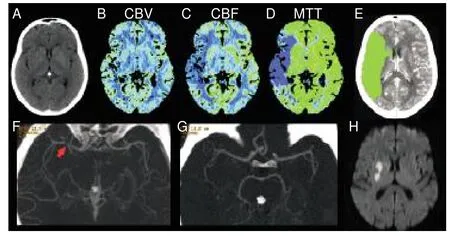
图2 时间窗内静脉溶栓的1例预后好的急性脑梗死患者
综上所述,急性缺血性脑血管病是一个多因素、多环节的病理生理过程。由于危险因素、血管病变程度、病变部位、侧枝循环建立、缺血耐受能力的不同,即使发病时间相同,缺血脑组织的病理生理特征也有巨大的个体差异。PCT有助于临床医师确定脑组织缺血损伤的程度和范围,评价可逆性和不可逆性缺血区,有利于超早期的治疗决策及早期预后的评估。本研究存在的局限性有以下几点:回顾性研究,未双盲、随机分组;临床资料不够完备;一些患者的治疗方案是根据多参数CT的结果制订的,回顾分析这些病例对统计分析会产生一定的影响。
[1]Zhu G,Jovin T,Aghaebrahim A,et al.Does perfusion imaging add valuecompared with plain parenchymal and vascular imaging[J].J Neurointerv Surg,2012,4:246-250.
[2]Gonzalez RG.Imaging-guided acute ischemic stroke therapy:From"time is brain"to"physiology is brain" [J].AJNR Am J Neuroradiol,2006,27: 728-735.
[3]Hacke W,Furlan AJ,Al-Rawi Y,et al.Intravenous desmoteplase in patients with acute ischaemic stroke selected by MRI perfusion-diffusion weighted imaging or perfusion CT(DIAS-2):a prospective,randomised,double-blind,placebo-controlled study[J]. Lancet Neurol,2009,8:141-150.
[4]Murphy BD,Fox AJ,Lee DH,et al.Identification of penumbra and infarct in acute ischemic stroke using computed tomography perfusion-derived blood flow and blood volume measurements[J].Stroke, 2006,37:1771-1777.
[5]Miteff F,Levi CR,Bateman GA,et al.The independent predictive utility of computed tomography angiographic collateral status in acute ischaemic stroke [J].Brain,2009,132:2231-2238.
[6]Firlik AD,Rubin G,Yonas H,et al.Relation between cerebral blood flow and neurologic deficit resolution in acute ischemic stroke[J].Neurology,1998, 51:177-182.
[7]Miles KA,Hayball M,Dixon AK.Colour perfusion imaging:a new application ofcomputed tomography[J].Lancet,1991,337:643-645.
[8]Michel P,Bogousslavsky J.Penumbra is brain: no excuse not to perfuse[J].Ann Neurol,2005,58: 661-663.
[9]Fonarow GC,Reeves MJ,Zhao X,et al.Age-related differences in characteristics,performance measures,treatment trends,and outcomes in patients with ischemic stroke[J].Circulation,2010,121:879-891.
[10]Kruetzelmann A,Kohrmann M,Sobesky J,et al. Pretreatment diffusion-weighted imaging lesion volume predicts favorable outcome after intravenous thrombolysis with tissue-type plasminogen activator in acute ischemic stroke[J].Stroke,2011,42:1251-1254.
[11]Kharitonova T,Mikulik R,Roine RO,et al.Association of early National Institutes of Health Stroke Scale improvement with vessel recanalization and functional outcome after intravenous thrombolysis in ischemic stroke[J].Stroke,2011,42:1638-1643.
[12]Mazighi M,Meseguer E,Labreuche J,et al.Dramatic recovery in acute ischemic stroke is associated with arterial recanalization grade and speed[J].Stroke, 2012,43:2998-3002.
Application of Perfusion CT in Predicting Clinical Outcome of Patients with Acute Cerebral Infarction

Objective:To investigate the correlation between the variables conducted by Perfusion CT(PCT)and clinical outcome of acute cerebral infarction.Methods:In all,78 patients with anterior circulation acute cerebral infarction were enrolled in this observation.Their infarct core and penumbra were accessed by PCT.Modified Rankin scale (mRS)was used to followe up the participants 90 days after onset.The correlation between Perfusion CT and clinical outcome was analyzed by multi-variables linear regression analysis.Results:Age was the most important factor to predict the clinical outcome (<0.01).Both NIHSS and HMCAS were negatively correlated with 90-days mRS(=0.021 and 0.038).When compared with the ICA occlusion,patients with M1 occlusion had relatively better prognosis(=0.012).Recanalization of vessels was a significant factor affecting the prognosis(=0.010).The infarct volume in PCT could not accurately predict the prognosis(=0.145),and the penumbra volume in PCT was positively correlated with prognosis(=0.044).Conclusion:PCT is useful in deciding the therapeutic strategy and predicting the outcome in early stage of acute cerebral infarction patients.
perfusion CT;penumbra;acute cerebral infarction;clinical outcome
R741;R741.04
A DOI 10.3870/sjsscj.2014.02.014
1.中国人民解放军北京军区总医院神经内科北京 100700 2.廊坊市长征医院神经内科河北 廊坊 065000
2013-07-31
朱光明zhugmdc@aliyun. com
