MR-HG在剖宫产术后子宫瘢痕憩室诊断中的初步应用
2014-01-11王文晶孙明华朱家樑龚华荣汪希鹏
王文晶 孙明华 朱家樑 张 军 龚华荣 梅 雯 汪希鹏
由于各种因素,近年来我国剖宫产率持续上升,随之而来的剖宫产术后相关妇科疾病的发生率也逐年升高。这是一类新型的剖宫产源性妇科疾病,主要包括瘢痕内膜异位症、子宫瘢痕妊娠、慢性盆腔痛及剖宫产术后子宫瘢痕憩室 (cesarean scar diverticulum, CSD) 等。CSD又称为子宫切口瘢痕缺损,其发生率约为4%~9%[1],并呈逐年增高趋势。CSD可导致经期延长、憩室内妊娠等,影响患者生活质量,并且可能带来严重危害。CSD的早期发现、诊断日益引起临床医师的重视。本文应用MR子宫造影(MR-hysterography,MR-HG)观察CSD的影像学表现,并与超声结果对照,探讨MR-HG在CSD诊断中的价值。
方 法
1.临床资料
2014年2月至6月本院收治的既往有剖宫产病史的临床诊断CSD的患者28例,年龄23~45岁,平均32.64±4.68岁。8例患者剖宫产次数为2次,其余均为1次。患者均以月经淋漓不尽、经期延长为主要临床表现,经期延长至12~23d,平均(15.25±3.22)d。所有患者均已经过超声检查。
2.MRI扫描设备及扫描参数
本研究使用GE1.5T Optima MR360磁共振扫描系统,8通道Body array线圈。患者取仰卧位,先行常规磁共振扫描:横轴位T1WI序列及T2WI脂肪抑制序列,层厚6mm,间隔2mm;矢状位T2WI序列,层厚5mm,间隔1mm。矢状位T2 CUBE序列,层厚3.2mm,间隔1.6mm。初步观察图像后,行MR-HG检查,患者取截石位,消毒铺巾。暴露宫颈后,以一次性伞状头导管封堵宫颈外口,向宫腔内注射10ml生理盐水。之后再次行矢状位T2 CUBE序列扫描,扫描期间导管留置于宫颈外口以防生理盐水漏出。
3.图像观察与数据测量
基于T2 CUBE序列观察CSD的矢状位形态,并对MR-HG后的图像进行三维重建。
通过MPR重建图像,测量CSD底部与浆膜层距离、造影前后CSD长径、宽度及深度(图1),计算CSD近似体积(长径×宽度×深度)。同时记录患者的超声诊断中CSD的近似体积(三个测量径线的乘积)以及CSD底部与浆膜层的距离。
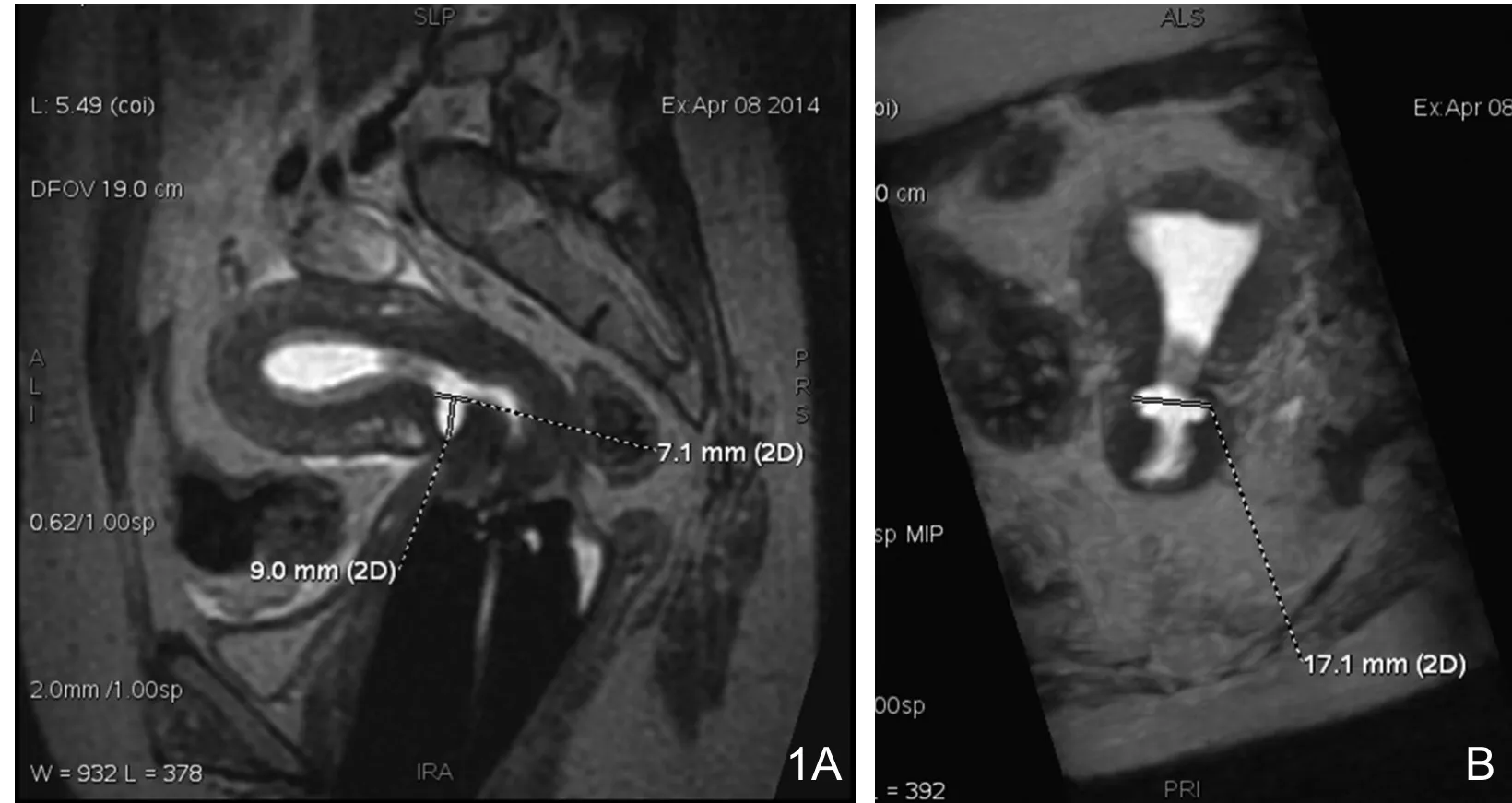
图1 CSD。图像经MPR重建对CSD各径线进行测量。A.CSD长径及深度。B.CSD宽度。
4.统计学分析
相关数据分析采用SPSS 16.0软件。采用配对t检验,比较超声及MR测量的浆膜层距离,同时两两比较超声、MR-HG前和MR-HG后CSD的近似体积,P<0.05为差异有统计学意义。
结 果
1.CSD的磁共振影像学表现
磁共振可见CSD位于子宫前壁下段,局部肌层缺损、变薄(部分患者局部无明显肌层信号,代之以低信号瘢痕组织),呈现与宫腔相通的龛影样改变。憩室信号表现为:T1WI为等或高(憩室内积血)信号,T2WI为高信号,T2 CBUE序列中,MR-HG之前为稍高信号,之后CSD为生理盐水填充,呈现明显高信号,部分CSD在MR-HG之后可见混杂高信号(憩室内积血)。本组研究所见CSD的矢状位形态大致分为浅凹陷、三角形、小囊形及囊袋形四种,三维重建可全面观察CSD的完整形态(图2)。
2.数据及统计
28例患者中,有3例患者超声检查未提示CSD的存在,故该3例患者的CSD超声近似体积计为零,其底部距离浆膜层距离不计入统计。MR及超声检查获得的CSD参数见表1。配对t检验显示常规MR与超声检查获得的CSD底部距离浆膜层距离间无显著性差异(t=0.882,P=0.392)。
常规MR、MR-HG及超声检查获得的CSD近似体积两两进行配对t检验提示(表2):各组间均存在显著差异(P<0.01)。常规MR测得的CSD近似体积大于超声,造影后CSD的体积进一步增大。
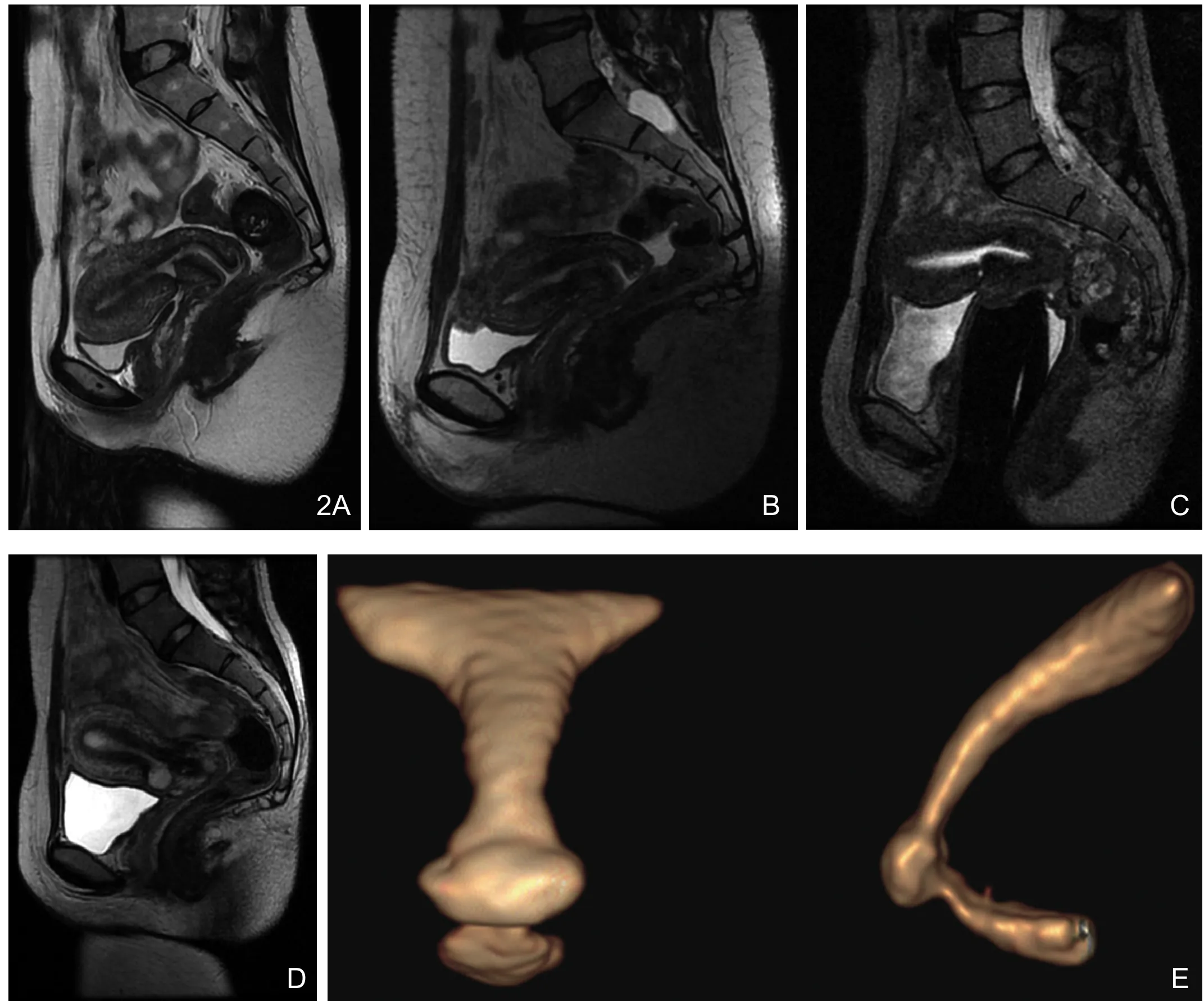
图2 CSD形态。A.三角形;B.浅凹陷;C.小囊样;D.囊袋形;E.MR-HG以高信号的生理盐水填充整个宫腔及CSD,得以重建三维图像进行多方位观察。

表1 CSD参数
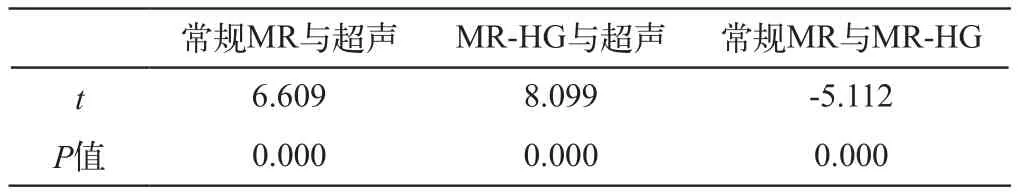
表2 不同检查方法所得CSD近似体积比较的P值
讨 论
剖宫产术后CSD为后天性憩室,发生的危险因素主要包括[2]:①子宫切口位置;②子宫切口的缝合方法;③剖宫产切口部位的感染;④多次剖宫产和后屈子宫。
CSD主要表现为月经淋漓不尽及不孕,可伴慢性下腹痛或经期腹痛[3]。①月经紊乱:经期延长是CSD最主要的临床表现。国内外文献报道,术前月经周期规律的患者剖宫产术后转经后前来就诊的主要原因为经期延长、淋漓不尽,持续时间一般为10~20d[4]。子宫肌层的不协调收缩导致憩室聚集部分经血,憩室内的残留经血排除缓慢,导致月经淋漓不尽。②不孕:CSD患者不孕的原因主要是月经淋漓的状态妨碍了精子通过宫颈管,并且干扰胚胎的宫腔内种植[5]。③憩室内妊娠:既往剖宫产病史人群中的发病率约为0.15%,其破裂风险主要根据憩室大小、距离浆膜层厚度而定[6]。
CSD的主要诊断依据为患者的临床表现及剖宫产病史。常用的辅助诊断方式有超声检查、宫腔镜、子宫输卵管造影(hysterosalpingography, HSG)。①超声检查包括经阴道超声诊断和生理盐水超声造影(saline infusion sonohysterography,SIS):子宫前壁下段剖宫产切口可见宫腔内凸向肌层或浆膜层的三角形或囊样液性暗区,通过憩室深度/肌层厚度比(≤50%)[7]或残余肌层厚度[8]评估憩室严重程度。残余肌层厚度≤2.2mm(普通超声)和≤2.5 mm(超声造影)的憩室定义为大缺损。超声造影检查使CSD边界更加清晰,较普通超声检查能更好地发现、评估CSD。②宫腔镜检查:随着宫腔镜技术的成熟及广泛的运用,越来越多的经超声诊断的CSD通过宫腔镜直视下进一步确诊,被认为是其诊断的“金标准”[9]。宫腔镜下CSD常表现为,宫颈管从子宫前壁向外膨出,其下方是切口瘢痕的纤维区,可能包裹着毛细血管、息肉、子宫腺肌症和异物肉芽肿。③HSG[10]:CSD表现为在子宫下段或宫颈管前壁囊样凸起或带状龛影,能较准确地观察憩室的大小和形态。但由于存在电离辐射,较少应用于CSD的常规检查,多为造影过程中偶然发现。
MRI作为一种无创、无辐射的检查方式,有助于了解CSD各个径线的大小,测量残余肌层厚度或憩室距离浆膜层的距离[11],较早前亦有学者应用MRI子宫输卵管造影(MR-hysterosalpingography,MR-HSG)评估输卵管通畅程度[12]。而本研究参考超声造影,在常规MRI扫描的基础上,以生理盐水充盈宫腔,观察CSD的形态并测量各项参数。通过MPR及三维重建,MR-HG对CSD形态、各径线的观察测量较超声更直观。本研究获得的CSD底部距离浆膜层距离与超声检查无显著差异,而MR-HG前后获得的CSD近似体积均明显大于超声检查。可能与患者进行超声检查的“时间窗”有关,通常超声检查于患者月经干净后数天内进行,但月经淋漓时是超声检查的最佳时期,随着憩室月经的排净,部分患者的憩室也随之消失[5]。MR-HG的检查时间无需十分严格,随着生理盐水充盈宫腔,宫腔及憩室内T2信号增高,能很好地显示CSD充盈前后的形态变化,模拟生理状态下CSD随着月经周期变化的规律。且后处理三维重建亦能使临床医生更直观地了解憩室的整体形态,对手术方案的制定提供帮助。与超声造影相比,MR-HG能对盆腔进行完整观察,特别是子宫周围结构,如膀胱、附件等,亦能为临床医生制定治疗方案提供更多信息。
综上所述,随着剖宫产率的上升,CSD的发生越来越多。MR-HG作为一种无创、无辐射的检查方式,可为CSD的诊治提供直观详细的影像学依据,充分满足临床医师的要求,具有广阔的前景。
[1] Wang CB, Chiu WW, Lee CY, et al. Cesarean scar defect: correlation between Cesarean section number, defect size, clinical symptoms and uterine position. Ultrasound Obstet Gynecol, 2009, 34: 85-89.
[2] 姚 敏, 汪希鹏. 剖宫产术后子宫切口瘢痕憩室的诊治. 现代妇产科进展, 2013, 22: 408-411.
[3] Tower AM, Frishman GN. Cesarean scar defects: an underrecognized cause of abnormal uterine bleeding and other gynecologic complications. J Minim Invasive Gynecol, 2013, 20: 562-572.
[4] Thurmond AS, Harvey WJ, Smith SA. Cesarean section scar as a cause of abnormal vaginal bleeding: diagnosis by sonohysterography. J Ultrasound Med, 1999, 18: 13-16.
[5] Fabres C, Aviles G, De La Jara C, et al. The cesarean delivery scar pouch: clinical implications and diagnostic correlation between transvaginal sonography and hysteroscopy. J Ultrasound Med,2003, 22: 695-700.
[6] Seow KM, Huang LW, Lin YH, et al. Cesarean scar pregnancy:Issues in management. Ultrasound Obstet Gynecol, 2004, 23: 247-253.
[7] Ofili-Yebovi D, Ben-Nagi J, Sawyer E, et al. Deficient lower-segment cesarean section scars: prevalence and risk factors. Ultrasound Obstet Gynecol, 2008, 31: 72-77.
[8] Vikhareva Osser O, Jokubkiene L, Valentin L. Cesarean section scar defects: agreement between transvaginal sonographic findings with and without saline contrast enhancement. Ultrasound Obstet Gynecol, 2010, 35: 75-83.
[9] Gubbini G, Casadio P, Marra E. Resectoscopic correction of the“isthmocele” in women with postmenstrual abnormal uterine bleeding and secondary infertility. J Minim Invasive Gynecol,2008, 15: 172-175.
[10] Surapaneni K, Silberzweig JE. Cesarean section scar diverticulum:appearance on hysterosalpingography. AJR, 2008, 190: 870-874.
[11] Marotta ML, Donnez J, Squifflet J, et al. Laparoscopic repair of post-cesarean section uterine scar defects diagnosed in nonpregnant women. J Minim Invasive Gynecol, 2013, 20: 386-391.
[12] Wiesner W, Ruehm SG, Bongartz G, et al. Three-dimensional dynamic MR hysterosalpingography: a preliminary report. Eur Radiol. 2001, 11: 1439-1444.
