响应面法优化酶法辅助提取熟地黄多糖的工艺研究
2014-01-09施伟梅张赛男陈建福吴龙火
施伟梅 ,张赛男 ,陈建福 ,詹 思 ,吴龙火 *
(1.赣南医学院 药学院,江西 赣州 341000;2.漳州职业技术学院农产品深加工及安全福建省高校应用技术工程中心,福建 漳州 363000)
响应面法优化酶法辅助提取熟地黄多糖的工艺研究
施伟梅1,张赛男1,陈建福2,詹 思1,吴龙火1*
(1.赣南医学院 药学院,江西 赣州 341000;2.漳州职业技术学院农产品深加工及安全福建省高校应用技术工程中心,福建 漳州 363000)
为优化纤维素酶法辅助提取熟地黄中多糖的提取方法,在单因素试验基础上,选取pH、酶解温度、提取时间、酶用量为自变量,多糖得率为响应值,采用中心组合(Box-Behnken)试验设计方法,研究各自变量及其交互作用对多糖得率的影响.采用Design-Expert软件,建立多糖得率与提取过程中各因素的二次多项式模型,并通过响应面优化法确定在pH为6的条件下熟地黄多糖提取最佳工艺为:酶解温度57℃、酶解时间 2 h、酶用量1.8%,在此修正条件下,提取多糖的预测值为7.05%.经过试验验证,熟地黄多糖的得率为7.18%,与预测值的相对误差为1.84%,验证了数学模型的有效性.
熟地黄;多糖;响应面法;纤维素酶辅助提取
0 引言
熟地黄(Radix Rehmanniae Preparata)又名熟地,为玄参科植物地黄的新鲜或干燥块茎经加工炮制而成[1-2],具有益精填髓、滋阴补血、抗肿瘤、抗氧化、抗衰老、提高记忆力、调节免疫力等多种药理作用,可应用于目昏耳鸣、腰膝酸软、肝肾阴虚、月经不调、骨蒸潮热、崩漏下血、心悸怔忡等症状[3-6].熟地黄多糖是熟地黄中特有的活性成分之一,药理研究表明,熟地黄多糖有增强免疫力、抗突变、抗肿瘤、抗氧化、补血等生理功能[7].近年来,有关熟地黄多糖的提取工艺[8-9]已有报道,而关于利用纤维素酶辅助提取熟地黄多糖的提取工艺却鲜见报道,纤维素酶能有效破坏植物组织细胞,降低植物颗粒到溶剂中的阻力,促进多糖物质的溶出,具有能耗低、环境污染小、易实现产业化等优点[10-13],在天然功能性产物提取中受到越来越广泛的重视.为此,本研究以熟地黄多糖得率为指标,采用响应面法优化其纤维素酶法辅助提取工艺,为熟地黄资源的深加工及熟地黄多糖功能性食品、保健品的开发提供新的有效途径.
1 材料与方法
1.1 试剂与仪器
熟地黄:赣州市章贡区药房,在60℃烘箱中干燥至恒质量后粉碎,过60目筛,置于干燥皿中密封保存备用;葡萄糖对照品:中国药品生物制品检定所;纤维素酶(30 000 U/g):江苏淮安百麦绿色生物能源有限公司;其他试剂均为分析纯.
Lambda35紫外可见分光光度计:美国珀金埃尔默公司;DHG-9070电热鼓风干燥箱:上海一恒科学仪器有限公司;TDL-50B台式离心机:上海安亭科学仪器厂;Q-250B高速多功能粉碎机:上海冰都电器有限公司;AB135-S电子分析天平:上海树信仪器仪表有限公司.
1.2 试验方法
1.2.1 标准曲线的建立
采用苯酚-硫酸法,以葡萄糖为标准样品绘制标准曲线.称取葡萄糖1 g用蒸馏水溶解,并定容于100 mL容量瓶中,配成质量浓度为10 mg/mL的葡萄糖标准溶液备用.吸取10 mg/mL葡萄糖标准溶液 0.5、0.8、1.0、1.2、1.4、1.6、1.8 mL,分别用蒸馏水定容至100 mL,摇匀,再分别取0.2 mL溶液于6个干燥比色管中,向各管中分别加入0.5 mL 5%苯酚、2.5 mL浓硫酸,摇匀,室温下放置20 min,以不加标准溶液的相应溶液作空白,在波长490 nm处分别测定吸光度并绘制葡萄糖质量浓度与吸光度的标准曲线.所得回归曲线方程为:y=6.460 2 x-0.158 2,相关系数r2=0.999 2,其中y为提取液的吸光度,x为提取液中多糖质量浓度(mg/mL).结果表明葡萄糖质量浓度在0.05~0.18 mg/mL范围内与吸光度A之间有良好的线性关系.
1.2.2 熟地黄多糖的提取工艺
熟地黄→烘干→粉碎→称量→95%乙醇脱单糖、低聚糖→挥干溶媒后称量→加水→调节pH→加纤维素酶→水浴→80℃灭酶30 min→脱蛋白→醇沉→抽滤→重溶于水→离心→测定吸光度.
1.2.3 校正因子的测定
准确称取经处理的熟地黄粉末1 g,用95%乙醇80 mL在100℃条件下回流1 h,所得药渣挥干溶剂后,在料液比1∶30条件下加水浸泡0.5 h,调pH为6.0,加入质量分数为2%的纤维素酶,于55℃下反应2 h,提取熟地黄中的多糖,提取结束后,于80℃的条件下灭酶30 min,脱蛋白后得多糖提取液,醇沉、抽滤,用95%乙醇多次洗涤,烘干,得多糖,称量后溶解于50 mL水中,以3 500 r/min离心 5 min,取0.4 mL提取液,按一定比例稀释,根据标准曲线的测定方法,于490 nm下测定其吸光度,其吸光度为0.563 7,校正因子F计算公式为:

式中:W为所称取多糖的质量,mg;A为所测多糖溶液的质量浓度,mg/mL;B为稀释因素,mL.
经计算得F=0.51.
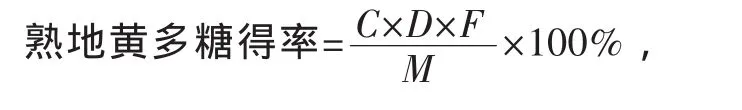
式中:C为稀释后多糖提取液中多糖的质量浓度,mg/mL;D为提取液的稀释因素,mL;F为校正因子,即0.51;M为称取的熟地黄的质量,mg.
1.3 试验设计
1.3.1 单因素试验
采用单因素试验研究pH、提取温度、提取时间和酶量对提取熟地黄多糖的影响.
1.3.2 响应面试验设计
在单因素试验的基础上,采用响应曲面法对熟地黄多糖的提取工艺进行优化,通过拟合二次多项式的方程,计算出最佳工艺组合及在此条件下多糖的最大得率理论值.
应用Design-Expert 7.0软件采用Box-Behnken Design(BBD)进行试验设计.以提取温度(X1)、提取时间(X2)及酶量(X3)为自变量,熟地黄多糖得率为指标,进行响应曲面分析.响应曲面因素与水平见表1.

表1 响应曲面因素与水平
1.3.3 验证与比较试验
通过软件分析获得最佳提取工艺条件后,按照优化条件进行提取测定,比较试验结果和方程计算值的差异.
2 结果与分析
2.1 单因素试验
2.1.1 pH对熟地黄多糖得率的影响
固定料液比1∶30、提取温度55℃、提取时间1 h、酶量1%,考察不同pH对多糖得率的影响,结果如图1所示.

图1 pH对多糖得率的影响
从图1可以看出,随着pH的增大,熟地黄多糖的得率迅速上升,当pH 6时,多糖得率达到最大,但当pH继续增大时,多糖得率反而降低.这是因为在适当的 pH条件下,静电作用可以维持酶活性中心的最佳三维构象,促进酶和底物的结合,酶催化的反应速率达到最大,得率相应也较高;而pH值发生改变,会使酶与底物所带电荷不同,酶的立体构象以及酶与底物的亲和力不同,催化速度也就不同.因此,最适宜pH应为6.
2.1.2 提取温度对熟地黄多糖得率的影响
固定料液比 1∶30、pH 6.0、提取时间 1 h,、酶量1%,考察不同温度对多糖得率的影响,结果如图2所示.

图2 提取温度对多糖得率的影响
从图2可以看出,随着提取温度升高,熟地黄多糖的得率逐渐增大,当提取温度为55℃时,多糖得率达到最大,温度继续升高,熟地黄多糖得率则逐渐减小.这是因为酶是一类具有最适反应温度范围的物质,在较低温度时升温可以提高酶的活性,而温度过高则会导致酶受热变性而失活.因此最佳提取温度应控制在55℃左右.
2.1.3 提取时间对熟地黄多糖得率的影响
固定料液比1∶30、调pH 6.0、提取温度55℃、酶量1%,考察不同提取时间对多糖得率的影响,结果见图3.

图3 提取时间对多糖得率的影响
从图3可以看出,熟地黄多糖的得率随着提取时间的延长而迅速增大,当提取时间为2 h时,熟地黄多糖得率达到最大,再继续延长提取时间,熟地黄多糖得率则有所下降.这是因为随着反应时间延长,酶解越充分,多糖含量也就越高.而当酶量达一定值时,酶促反应时间的延长并不能使得率增加,甚至会使得率下降,这可能是由于提取时间太长会引起糖结构变化甚至使碳环裂解,导致多糖含量降低.因此适宜提取时间为2 h.
2.1.4 酶量对熟地黄多糖得率的影响
纤维素酶可以降解纤维素等多糖类物质,这些物质的水解会导致细胞壁的部分破损、细胞膜通透性增加,促使多糖类化合物的释放.固定料液比1∶30、调 pH 6.0、提取温度 55 ℃、提取时间 2 h,考察不同酶量对多糖得率的影响,结果见图4.

图4 酶量对多糖得率的影响
从图4可以看出,当酶量较小时随着酶量增大,熟地黄与纤维素酶接触机会增大,破壁效果增加,多糖得率也不断增大,当酶量为2%时,多糖得率达到最大,酶量继续增大,熟地黄多糖得率开始下降.可能是因为当酶量达到一定程度时,多糖的纤维降解物大量存在,使得多糖的溶解变得困难.因此最佳酶量选择为2%.
2.2 响应面试验结果
2.2.1 响应面试验结果及方差分析
根据Box-Benhnken的中心组合试验设计原理,在单因素的基础上采用3因素3水平试验设计,选取对熟地黄多糖得率影响较大的因素:提取温度(X1)、提取时间(X2)、酶量(X3)进行优化试验,并固定料液比为1∶30、pH值为6,因素和水平设计见表2,响应面分析方案见表3.

表2 响应曲面试验以及响应值

表3 方差分析
从表3可知,该模型极显著.由模型拟合得到的回归方程为:R1=-36.474 9+1.145 4X1+5.961 6X2+4.679 0X3+9.690 0E-003X1X2+0.023 97 X1X3-0.040 80X2X3-0.010-1.503-1.615 7.该回归模型的总决定系数R2=0.998 9,调整系数=0.997 5,说明该模型的拟合程度较好,试验误差小,因此该回归方程模型成立,方程中P<0.05的项代表显著项,包括 X1、X2、X3及二次项 X1X3、、、.方程的失拟项其F值为3.00,失拟项P=0.158 0>0.05,失拟项不显著,说明该回归方程可以较好地描述各因素与响应值之间的真实关系,可以用其确定最佳提取工艺条件.由此得到的最佳工艺条件为:提取时间 2.14 h、提取温度57.10℃、酶量1.84%,在此修正条件下,多糖得率最大预测值为 7.05%.
2.2.2 试验因素交互作用对响应值影响的3D分析
各试验因素交互作用对响应值影响的3D分析结果及等高面见图5.各因素及其相互作用对响应值的影响可以通过各图直观反映出来.由图5可知,主次因素顺序为酶量>提取温度>提取时间.

图5 提取温度、提取时间和酶量交互作用对多糖得率R1影响的相应曲面(3D)及等高曲线
2.2.3 最佳提取工艺的优化及验证
为检验模型的可靠性,采用最优提取条件进行熟地黄的提取试验,但考虑到实际操作的便利,将最佳工艺条件修正为:提取温度57℃,提取时间2 h,酶量1.8%,在此条件下进行3次平行试验,实际得率为7.18%,相对于预测值,误差为1.84%,与Design-Expert软件的预测值基本一致.因此,采用响应面法优化得到的提取条件参数可靠,得到的多糖提取条件具有实际应用价值.
3 结论
在单因素试验的基础上,应用响应面法优化纤维素酶法辅助提取熟地黄多糖的工艺,建立了熟地黄多糖得率与提取过程中的关键因素(提取温度、提取时间和纤维素酶用量)之间的二次多项式回归模型,经检验该模型合理可靠,同时利用该模型对熟地黄多糖纤维素酶辅助提取过程中的关键因素进行单因素及交互效应分析,得出熟地黄多糖纤维素酶辅助提取关键因素的优化条件为:酶解时间 2.14 h、酶解温度57.10℃、酶用量1.84%,在此修正条件下,多糖得率最大预测值为7.05%.考虑到实际操作的便利,将最佳工艺条件修正为:提取温度57℃,提取时间2 h,酶量1.84%,在此条件下进行3次平行试验,实际得率为7.18%,验证了数学模型的有效性.响应面分析法对熟地黄多糖提取条件的优化是合理可行的,该方法为提高熟地黄多糖的得率及工业化生产提供了理论支持.
[1] Oh K O,Kim SW,Kim JY,et al.Effect of rehmannia glutinosa libosch extracts on bone metabolism[J].Clinica Chimica Acta,2003,334(1-2):185-195.
[2]Sasaki H,Nishimura H,Mitsuhashi H,et al.Hydroxycinnamic acid esters of phenethylalcohol glycosides from Rehmannia glutinosa var.purpurea[J].Phyto-chemistry,1989,28(3):875-879.
[3] Kim H M,An C S,Jung K Y,et al.Rehmannia glutinosa inhibits tumour necrosis factoralpha and interleukin-1 secretion from mouse astrocytes[J].Pharmacological Research,1999,40(2):171-176.
[4]Kim S S,Son Y O,Chun J C,et al.Antioxidant property of an active component purified from the leaves of paraquat-tolerant Rehmannia glutinosa[J].Redox Report,2005,10(6):311-318.
[5]Zhang X L,Zhang A H,Jiang B,et al.Further pharmacological evidence of the neuroprotective effect of catalpol from Rehmannia glutinosa[J].Phytomedicine,2008,15(6-7):484-490.
[6]Zhang R X,Zhou J H,Jia Z P,et al.Hypoglycemic effect of Rehmannia glutinosa oligosaccharide in hyperglycemic and alloxaninduced diabetic rats and its mechanism[J].Journal of Ethnop-harmacology,2004,90(1):39-43.
[7]Kiho T,Watanabe T,Nagai K,et al.Hypoglycemic activity of polysaccharide fraction from rhizome of Rehmannia glutinosa Libosch.f.hueichingensis Hsiao and the effect on carbohydrate metabolism in normal mouse liver[J].J ournal of the P harmaceutkal Society of Japan,1992,112(6):393-400.
[8] 崔瑛,王晓宁,刘菊.熟地黄粗多糖提取与初步纯化工艺研究[J].时珍国医国药,2010,21(10):2570-2571.
[9] 陈传福,张培正.两种不同提取熟地黄多糖工艺研究[J].中国食物与营养,2008(11):42-44.
[10]Zhang J,Jia S Y,Liu Y,et al.Optimization of enzyme-assisted extraction of the Lycium barbarum polysaccharides using response surface methldology[J].Carbohydrate Polymers,2011,86(2):1089-1092.
[11]Wang H B.Cellulase-assisted extraction and antibacterial activity of polysaccharides from the dandelion taraxacum officinale[J].Carbohydrate Polymers,2014,103(3):140-142.
[12]陈文娟,陈建福.纤维素酶提取漳州血柚皮总黄酮的工艺研究[J].北京工商大学学报:自然科学版,2012,30(5):32-37.
[13]Qian Z G.Cellulase-assisted extraction of polysaccharides from Cucurbita moschata and their antibacterial activity[J].Carbohydrate Polymers,2014,101(3):432-434.
OPTIMIZATION OF CELLULOSE-ASSISTED EXTRACTION OF POLYSACCHARIDES FROM RADIX REHMANNIA PREPARATA USING RESPONSE SURFACE METHODOLOGY
SHIWei-mei1, ZHANG Sai-nan1, CHEN Jian-fu2, ZHAN Si1, WU Long-huo1
(1.College of Pharmacy, Gannan Medical University, Ganzhou 341000, China; 2.Applied Technical Engineering Center of Further Processing and Safety of Agricultural Products,Higher Education Institutions In Fujian Province, Zhangzhou Institute of Technology, Zhangzhou 363000, China)
In order to optim ize the cellulose-assisted extraction of polysaccharides from Radix Rehmannia Preparata, we designed Box-Behnken central composite experiments by selecting pH value, extraction temperature,extraction time and cellulose amount as independent variables and selecting polysaccharide yield as response value to study the effects of each variable and their interaction effect.We constructed a quadratic multinomialmodel between the polysaccharide yield and each variable in the extraction process by Design-Expert software,and determ ined the optimum polysaccharide extraction conditions by response surface methodology when the pH value was kept at 6.The results showed that the optimum conditions were as follows:extraction temperature 57 ℃,extraction time 2 h,cellulose amount 1.8%;and the predictive value of the polysaccharide yield was 7.05% under the modified conditions.The experimental verification results showed that the polysaccharide yield of Radix Rehmannia preparata reached 7.18%,and has a 1.84%relative error in comparison w ith the predictive value,so that themathematicalmodel was effective.
Radix Rehmannia Preparata;polysaccharides;response surface methodology;cellulose-assisted extraction
TS218;R284.2;O636
B
1673-2383(2014)05-0023-06
http://www.cnki.net/kcms/detail/41.1378.N.20141029.1723.005.html
网络出版时间:2014-10-29 17:23:36
2014-05-09
国家自然科学基金(81360277)
施伟梅(1985-),女,福建东山人,讲师,硕士,研究方向为天然产物成分与活性.
*
