CCNG2在神经胶质瘤组织中的表达及其临床意义*
2014-01-07陈祥龙何克菲陈筱婷
陈祥龙 何克菲 陈筱婷
神经胶质瘤以其高发病率、高复发率和高死亡率已成为临床亟待解决的难题。占神经胶质瘤一半的胶质母细胞瘤患者的平均生存时间仅约14.6个月,5年生存率低于3.3%[1]。由于神经胶质瘤细胞快速且浸润性生长,与正常脑组织无明显界限,多数发生不限于一个脑叶,手术无法彻底清除肿瘤病灶[2]。不同部位病理特征不同,其恶性程度也不同,单纯手术和放化疗不能阻止肿瘤复发和向周围脑组织发生侵袭性转移,复发率高达100%[3-4],其发生、发展机制目前尚未完全阐明。因此阐明影响神经胶质瘤发生、发展及预后的分子机制,为神经胶质瘤的临床治疗寻找新的靶点,已成为当今神经胶质瘤临床治疗学的热点课题之一。
细胞周期蛋白G2(cell cyclin,G2)由CCNG2基因编码,与cyclin G1同属于细胞周期蛋白G家族[5]。CCNG2基因定位于染色体5p3.3,编码基因含有8个外显子,其cDNA长度约8.60 kb,相对分子量为40×103。人类CCNG2与CCNG1显示了较低的同源性,仅有60%的核苷酸序列及53%的氨基酸序列一致;而与cyclin A的氨基酸序列则只有26%的一致性[6]。目前的研究发现CCNG2可能参与神经胶质瘤发生发展和化疗耐药过程[7]。为了验证神经胶质瘤组织中CCNG2的表达情况及其与临床预后的关系,本研究应用QRT-PCR及免疫组织化学的方法对临床神经胶质瘤标本进行检测。
1 材料与方法
1.1 材料
收集2007年1月至2012年8月在本院行手术切除的神经胶质瘤组织标本149例,选择资料完整的神经胶质瘤病例109例进行研究,手术标本部分经40 g/L中性甲醛固定,石蜡包埋,3 μm厚连续切片,进行免疫组织化学染色。部分手术标本放入液氮冷冻后,用锡纸包裹,在研钵中充分研磨,研磨后用Trizol反复洗涤研磨的碎末,用经DEPC水处理后的冻存管收集,放入液氮,用时提取RNA进行检测。所有病例术前均未行放化疗。本研究经珠江医院伦理委员会批准,所有患者均签署知情同意书。随访:全部109例患者出院后均随访,随访方式为电话随访和复查随访,随访内容包括一般情况、临床症状及影像学检查。随访起点为确诊日期,末次随访时间为2013年5月31日,至随访截止日,依然生存46例,死亡63例,无失访病例。
1.2 方法
1.2.1 总RNA的提取及实时荧光定量PCR 按照试剂说明书,通过Trizol提取试剂盒从神经胶质瘤组织标本中提取总RNA,操作按照说明书进行。测量总RNA浓度,取1 μg RNA按逆转录合成试剂盒说明合成cDNA,然后以该cDNA为模板,PCR仪中扩增从神经胶质瘤组织标本中提取的总RNA进行逆转录和实时荧光定量PCR。CCNG2及内参照GAPDH的引物序列见表1。逆转录反应及PCR扩增参照试剂盒说明进行,以CCNG2基因的上下游引物进行PCR扩增,PCR反应在实时定量PCR反应仪上进行。重复实验3次。数据运用公式RQ=2-ΔΔCt的方法进行分析。△△Ct=(待测样品的目的基因的Ct的平均值-待测样本的管家基因的Ct的平均值)-(对照样品的目的基因的Ct的平均值-对照样本的管家基因的Ct的平均值)。

表1 CCNG2及内参照GAPDH的引物序列Table1 Primer sequence of CCNG2 and GAPDH
1.2.2 免疫组织化学染色 石蜡切片、脱蜡、水化,PBS冲洗3×3 min,高温高压抗原修复。加3%过氧化氢溶液,室温下孵育10 min,以阻断内源性过氧化物酶。PBS冲洗3×3 min,加第一抗体,一抗CCNG2为鼠抗人单克隆抗体。室温下孵育60 min,PBS冲洗3×5 min。加聚合物增强剂(试剂A),室温孵育20 min,PBS冲洗3×3 min。加酶标抗鼠聚合物(试剂B),室温下孵育30 min,PBS冲洗3×3 min。加新配制的DAB显色液,显微镜下观察,阳性显色为棕黄色。自来水冲洗,苏木素复染,0.1%盐酸分化,自来水冲洗,PBS冲洗返蓝。梯度酒精脱水干燥,中性树脂封片,所有标记均设阳性对照并用PBS缓冲液代替一抗行阴性对照。免疫组织化学的检测结果进行半定量判定。切片由两位病理学医师重复观察,结果有分歧时由第三人观片,讨论判定。随机选取5个高倍视野,按照细胞染色强度进行评分。如果阳性细胞数<10%为+,10%~29%为++,30%~49%为+++,≥50%为++++。
1.3 统计学方法
采用SPSS 13.0统计学软件进行数据分析。CCNG2在各级神经胶质瘤组织中的表达差异采用单因素方差分析的方法,CCNG2的表达与各临床病理参数之间的关系使用Chi-Square检验,采用Kaplan-Meier法分析CCNG2的表达与生存期的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 CCNG2基因在神经胶质瘤组织中的表达
QRT-PCR法检测CCNG2在非肿瘤组织(包括癌旁组织和正常脑组织)及神经胶质瘤各级组织标本中的表达,结果提示CCNG2基因的表达水平随着神经胶质瘤恶性程度的增高而降低,并且与神经胶质瘤病理级别呈负相关,差异具有统计学意义(P<0.05,图1)。

图1 QRT-PCR检测CCNG2基因在正常非肿瘤组织及各级神经胶质瘤组织标本中的表达(*P<0.05)Figure1 CCNG2 expression was examined in non-tumor tissues and in tissues from different stages of glioblastoma via QRT-PCR,*P<0.05
2.2 CCNG2蛋白在神经胶质瘤组织中的表达
免疫组织化学方法检测CCNG2在各级神经胶质瘤组织标本中的表达,结果提示CCNG2阳性细胞分布在细胞质和细胞膜着色(图2)。CCNG2表达水平随着神经胶质瘤恶性程度的增高而降低,并且与神经胶质瘤病理级别呈负相关,差异具有统计学意义(P<0.05)。
2.3 CCNG2的表达及其与临床参数的关系
患者中男性94例,女性15例。患者年龄36~86岁,中位年龄60岁,60岁以下患者54例,60岁以上患者55例。神经胶质瘤Ⅰ级患者19例,Ⅱ级29例,Ⅲ级26例,Ⅳ级35例。化疗敏感者(化疗后3个月未见肿瘤复发或疾病处于稳定状态)73例,化疗抗拒者(化疗后3个月内出现复发和转移)36例。放疗敏感者(放疗后3个月未见肿瘤复发或疾病处于稳定状态)44例,放疗抗拒者(放疗后3个月内出现复发和转移)65例。截止研究工作完成,生存病例46例,死亡病例63例。CCNG2蛋白的表达与患者性别、年龄无关(均P>0.05);而与肿瘤的分级、对放化疗的敏感性及总生存时间相关(均P<0.05,表2)。

图2 CCNG2在各级神经胶质瘤组织中的表达(SP×200)Figure2 CCNG2 expression was demonstrated in glioblastoma tissues
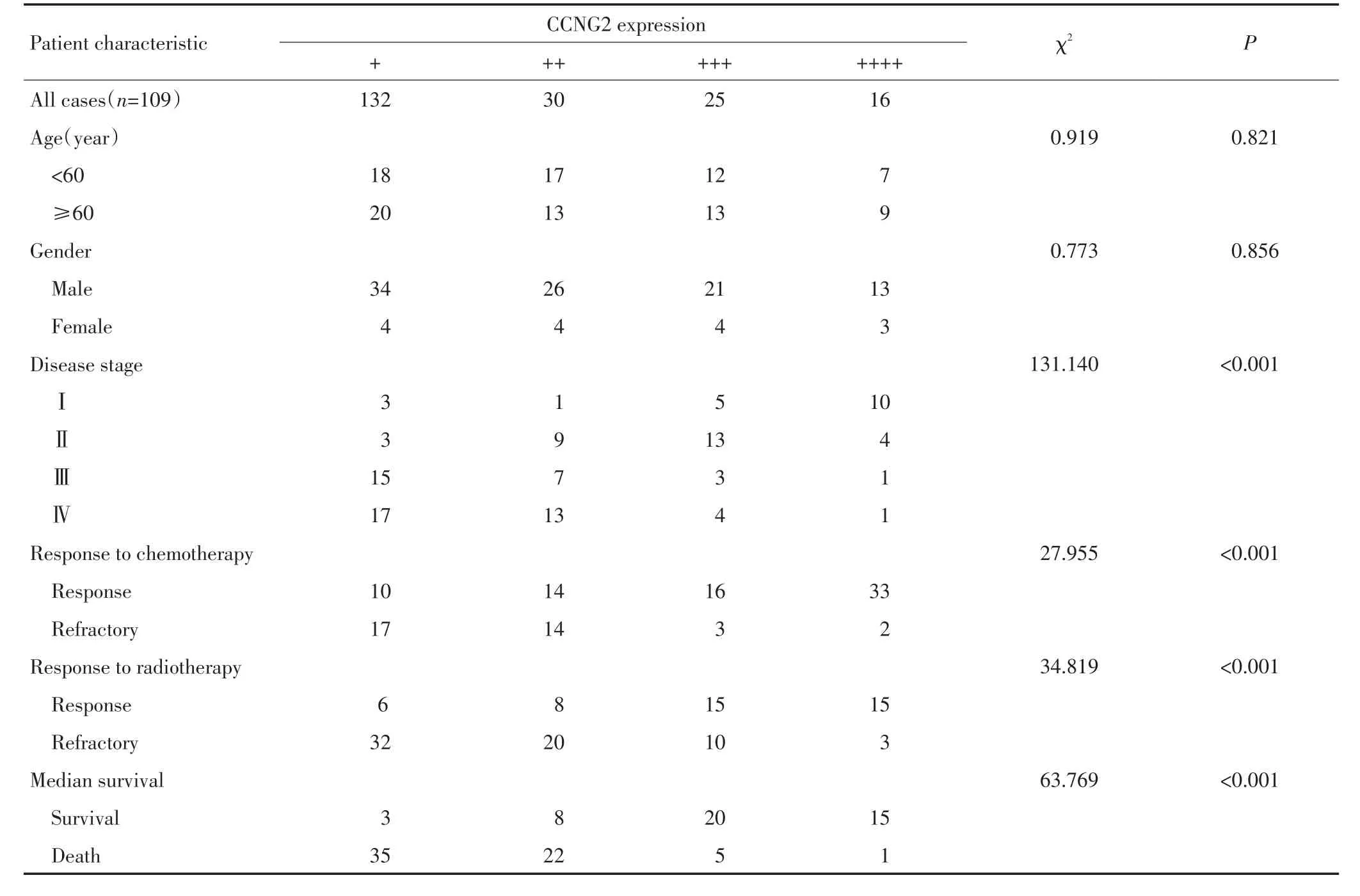
表2 神经胶质瘤中CCNG2的表达与临床参数的关系Table2 Association of CCNG2 in clinical tissue samples with the clinical parameters of glioblastoma
2.4 CCNG2及临床各参数对患者生存时间的影响
采用Kaplan-Meier法估计患者生存时间,结果发现CCNG2的表达、患者对放化疗的敏感性及肿瘤的分级与患者的生存时间密切相关,差异具有统计学意义(P<0.001),其中高表达CCNG2患者的生存时间较低表达者明显增加。肿瘤的病理分级越高,患者的生存时间越短,放化疗敏感者的生存时间较抗拒者的生存时间长,差异具有统计学意义(P<0.001,图3)。
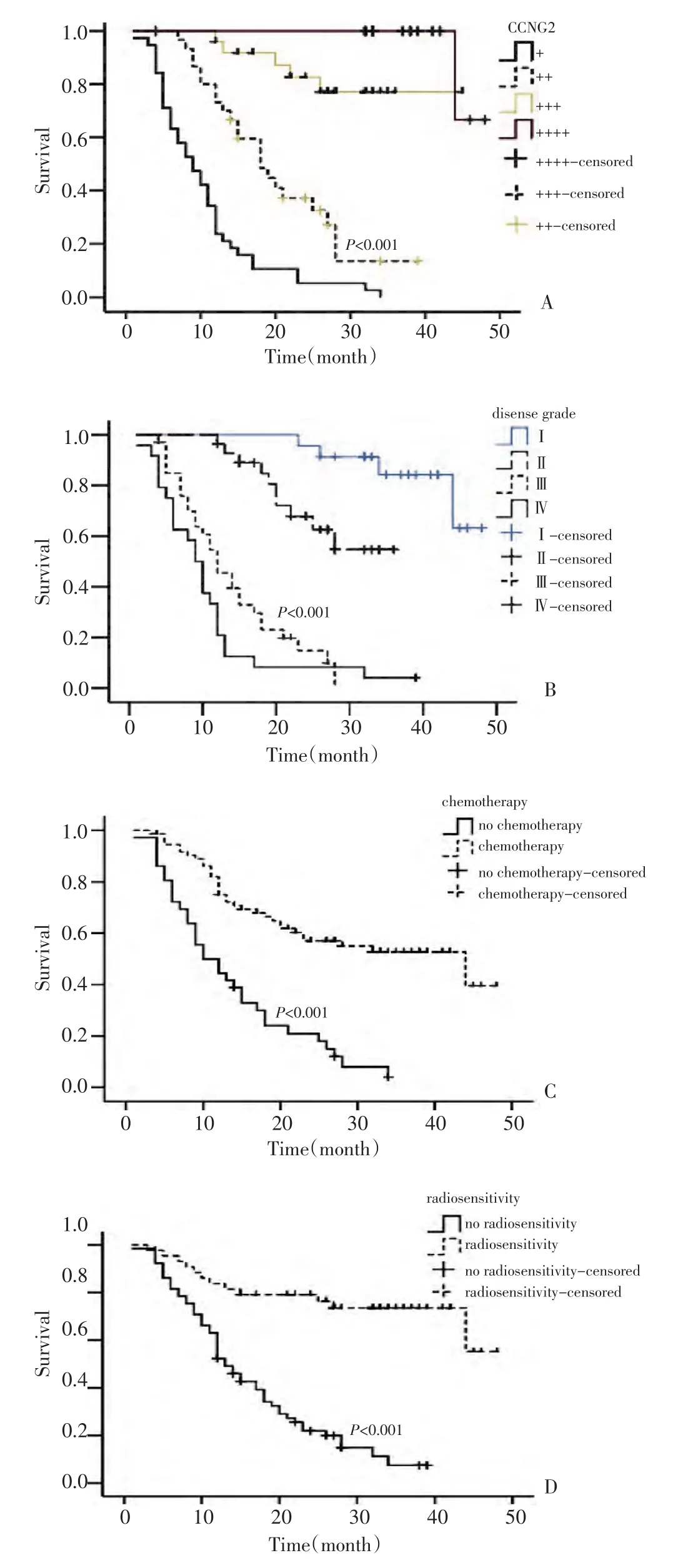
图3 Kaplan-Meier检验各临床参数对患者生存时间的影响Figure3 Influence of clinical parameters on glioblastoma survival
3 讨论
神经胶质瘤是最常见的中枢神经系统原发肿瘤,占颅内原发肿瘤的45%~50%,也是颅内肿瘤患者的主要死亡病因之一[8-10]。神经胶质瘤WHO分为Ⅰ~Ⅳ级。除Ⅰ级以外,几乎所有低级别神经胶质瘤最终均进展到高级别恶性神经胶质瘤,即Ⅳ级胶质母细胞瘤(glioblastoma,GBM)[11]。后者是最常见、恶性程度最高的神经胶质瘤。GBM患者的治疗方法是外科手术结合放疗、化疗,其中化疗以烷基化药物替莫唑胺(temozolomide,TMZ)为主,联合或未联合应用亚硝基脲类。尽管这些治疗方案有了长足的发展,但胶质母细胞瘤患者最终预后极差,目前中位生存期仍未超过14个月[12-13]。因此深入研究神经胶质瘤发生发展以及化疗耐药产生的分子机制对于胶质母细胞瘤的诊断与治疗具有十分重要的意义。
目前研究CCNG2功能的文献较少,主要集中在1)CCNG2是细胞周期负性调节因子,能够抑制细胞周期的进程[6,14-16];2)CCNG2是潜在的抑癌基因,其表达的缺失可能参与肿瘤发生发展的病理过程[17-19]。然而关于CCNG2在细胞周期中的表达调控机制尚未完全清楚。目前有研究报道CCNG2可能参与神经胶质瘤发生发展和化疗耐药过程[7,20]。为了验证神经胶质瘤组织中CCNG2的表达情况,本研究应用QRT-PCR及免疫组织化学的方法在收集到的临床神经胶质瘤标本上进行检测。结果表明,神经胶质瘤组织中存在CCNG2 mRNA下调现象,其中高级别(WHOⅢ~Ⅳ级)神经胶质瘤组织中CCNG2 mRNA转录水平明显下调,与低级别(WHOⅠ~Ⅱ级)神经胶质瘤相比差别显著(P<0.05)。本研究对109例免疫组织化学标本的分析表明,低级别神经胶质瘤细胞的细胞质中可见CCNG2蛋白染色,随着肿瘤级别的增高,CCNG2蛋白阳性率呈下降趋势。高级别神经胶质瘤组织阳性率明显低于低级别组(P<0.05)。Kaplan-Meier生存曲线提示CCNG2蛋白高表达患者预后好于低表达者,CCNG2的表达与患者性别、年龄无关(均P>0.05),而与肿瘤的分级、对放化疗的敏感性及总生存时间相关。本研究将有助于阐明神经胶质瘤发生、发展及放化疗抗拒的分子机制,为神经胶质瘤的临床治疗寻找新的靶点。
1 Chaudhry NS,Shah AH,Ferraro N,et al.Predictors of long-term survival in patients with glioblastoma multiforme:advancements from the last quarter century[J].Cancer Invest,2013,31(5):287-308.
2 Sia Y,Field K,Rosenthal M,et al.Socio-demographic factors and their impact on the number of resections for patients with recurrent glioblastoma[J].J Clin Neurosci,2013,20(10):1362-1365.
3 Chen J,Xu T.Recent therapeutic advances and insights of recurrent glioblastoma multiforme[J].Front Biosci(Landmark Ed),2013,18:676-684.
4 Marsh JC,Goldfarb J,Shafman TD,et al.Current status of immunotherapy and gene therapy for high-grade gliomas[J].Cancer Control,2013,20(1):43-48.
5 Horne MC,Donaldson KL,Goolsby GL,et al.Cyclin G2 is upregulated during growth inhibition and B cell antigen recep+12650-12661.
6 Cui DW,Cheng YJ,Jing SW,et al.Effect of cyclin G2 on proliferative ability of prostate cancer PC-3 cell[J].Tumour Biol,2013.[Epub ahead of print]
7 Zhao Z,Liu Y,He H,et al.Candidate genes influencing sensitivity and resistance of human glioblastoma to Semustine[J].Brain Res Bull,2011,86(3-4):189-194.
8 Hernández-Pedro NY,Rangel-López E,Vargas Félix G,et al.An update in the use of antibodies to treat glioblastoma multiforme[J].Autoimmune Dis,2013,2013:716813.
9 Nguyen NP,Nguyen ML,Vock J,et al.Potential Applications of Imaging and Image-Guided Radiotherapy for Brain Metastases and Glioblastoma to Improve Patient Quality of Life[J].Front Oncol,2013,3:284.
10 Omuro A,DeAngelis LM.Glioblastoma and other malignant gliomas:a clinical review[J].JAMA,2013,310(17):1842-1850.
11 Agnihotri S,Burrell KE,Wolf A,et al.Glioblastoma,a brief review of history,molecular genetics,animal models and novel therapeutic strategies[J].Arch Immunol Ther Exp(Warsz),2013,61(1):25-41.
12 Haskins WE,Zablotsky BL,Foret MR,et al.Molecular Characteristics in MRI-Classified Group 1 Glioblastoma Multiforme[J].Front Oncol,2013,3:182.
13 Sasaki T,Saito R,Kumabe T,et al.Transformation of adult cerebellar pilocytic astrocytoma to glioblastoma[J].Brain Tumor Pathol,2013.[Epub ahead of print]
14 Xu G,Bernaudo S,Fu G,et al.Cyclin G2 is degraded through the ubiquitin-proteasome pathway and mediates the antiproliferative effect of activin receptor-like kinase 7[J].Mol Biol Cell,2008,19(11):4968-4979.
15 Li WJ,Liu GL,Yu F,et al.CCNG2 Suppressor Biological Effects on Thyroid Cancer Cell through Promotion of CDK2 Degradation[J].Asian Pac J Cancer Prev,2013,14(10):6165-6171.
16 Sun GG,Hu WN,Cui DW,et al.Decreased expression of CCNG2 is significantly linked to the malignant transformation of gastric carcinoma[J].Tumour Biol,2013.[Epub ahead of print].
17 Choi MG,Noh JH,An JY,et al.Expression levels of cyclin G2,but not cyclin E,correlate with gastric cancer progression[J].J Surg Res,2009,157(2):168-174.
18 Kasukabe T,Okabe-Kado J,Honma Y.Cotylenin A,a new differentiation inducer,and rapamycin cooperatively inhibit growth of cancer cells through induction of cyclin G2[J].Cancer Sci,2008,99(8):1693-1698.
19 Martinez-Gac L,Marques M,Garcia Z,et al.Control of cyclin G2 mRNA expression by forkhead transcription factors:novel mechanism for cell cycle control by phosphoinositide 3-kinase and forkhead[J].Mol Cell Biol,2004,24(5):2181-2189.
20 Ragel BT,Couldwell WT,Gillespie DL,et al.Identification of hypoxia-induced genes in a malignant glioma cell line(U-251)by cDNA microarray analysis[J].Neurosurg Rev,2007,30(3):181-187;discussion 187.
