二氢杨梅素对H2O2诱导人脐静脉内皮细胞氧化损伤的影响
2014-01-05刘云霄潘晓琼胡臻
刘云霄,潘晓琼,胡臻
(温州医科大学附属第二医院 中医科,浙江 温州 325027)
藤茶作为一种民间古茶,可追溯至东晋时期[1]。目前,在我国广大农村,甚至在东南亚各国也享有盛誉。民间主要用以治疗糖尿病等多种疾病。现代研究表明,藤茶中主要含有黄酮类成分,以二氢杨梅素(dihydromyricetin,DMY)含量最高,具有消炎抗菌、抗肿瘤[2]、抗氧化[3]、保肝[4]、护胃[5]、降血糖[6]等作用。糖尿病以高血糖为主要特征,逐渐损伤血管和器官,最终出现威胁生命的并发症。在这些并发症的病理生理中,微小血管的改变起到十分重要的作用[7]。以往动物实验证实DMY具有降血糖、抗氧化作用,但缺乏对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVECs)的研究报道。本实验以体外培养HUVECs为基础,通过观察DMY对过氧化氢(H2O2)诱导的HUVECs损伤的作用,明确DMY对糖尿病血管内皮细胞的影响,并初步探讨其机制。
1 材料和方法
1.1 材料
1.1.1 细胞和试剂:HUVECs由中国科学院细胞库提供。胎牛血清、PRMI1640培养液、0.25%胰酶-EDTA为Gibco公司产品,青/链霉素、活性氧(ROS)、细胞内钙离子(Ca2+)、细胞凋亡-Hoechst33258染色试剂盒购于碧云天,MTT为sigma公司产品,DMY购于成都曼思特公司,D-葡萄糖为biosharp公司产品,超氧化物歧化酶(SOD)测试盒、微量丙二醛(MDA)测试盒购于南京建成。
1.1.2 仪器:CO2细胞培养箱,多功能酶标仪,细胞工作超净台,低速离心机,倒置显微镜,流式细胞仪。
1.2 方法
1.2.1 细胞株的培养:HUVECs复苏后,用含有10%胎牛血清的1640培养液置于37 ℃、5% CO2、相对湿度为95%培养箱里培养,隔天传代。取对数生长期的细胞用于本次实验研究。
1.2.2 实验分组:用不同浓度DMY(5μg·mL-1,20μg·mL-1,80μg·mL-1)预处理保护HUVECs 12 h,分别为DMY低、中、高剂量组,再用0.5 mmol·L-1H2O2[8]干预12 h后进行相应的处理。
1.2.3 Hoechst33258染色观察细胞核形态变化:按试剂盒说明书操作。
1.2.4 取上清液检测SOD、MDA:按说明书操作,分别于多功能酶标仪波长为550 nm、532 nm处,测各管SOD、MDA吸光度。
1.2.5 流式细胞仪检测细胞内ROS和细胞内Ca2+的变化情况:分别按试剂盒说明书处理后,避光保存,送流式细胞仪检测。
1.3 统计学处理方法 应用SPSS17.0统计学软件进行统计分析。所有数据均以 ±s表示,采用单因素方差分析,方差齐时采用LSD-t检验,方差不齐时采用Dunnett’s T3。P<0.05为差异有统计学意义。
2 结果
2.1 不同处理因素对HUVECs活力的影响 与正常组相比,每组差异均有统计学意义(P<0.05),其中DMY浓度与HUVECs细胞活性呈负相关,以5μg·mL-1保护作用最明显。DMY 80μg·mL-1时细胞活力反低于H2O2组,可能与细胞不能耐受高浓度的DMY及高浓度存在细胞毒性有关。见表1。

表1 不同处理因素对HUVECs活力的影响(n=15,±s)
2.2 Hoechst33258进行细胞核染色 正常HUVECs核呈弥散均匀低强度蓝色荧光,胞核较大,形态规则,呈圆形或者椭圆形状。H2O2组细胞核呈集中高强度蓝色荧光,偶有些颜色发白,胞核较小,形态不规则,呈固缩致密浓染,或呈碎块状致密浓染,出现细胞凋亡。DMY(低、中、高剂量)组细胞核荧光强度随浓度增加而增加,胞核由低强度逐渐趋于高强度荧光,形状由规则圆形或者椭圆形逐渐呈不规则固缩致密浓染化,细胞数逐渐减少,见图1。以上表明,DMY对H2O2诱导HUVECs损伤起保护作用,且呈剂量负相关性,其最佳药物浓度为5μg·mL-1。
2.3 DMY组能显著增加上清液SOD活性,降低MDA含量 与正常组相比,H2O2诱导HUVECs出现SOD活性下降,MDA含量升高,引起氧化损伤。DMY增强清除自由基的能力,减少过氧化作用的发生,增强抗氧化能力,从而起保护细胞的作用,以5μg·mL-1DMY低剂量组尤为明显。见表2。

图1 不同浓度DMY对H2O2诱导HUVECs细胞核形态学比较(×400)
2.4 流式细胞仪检测细胞内ROS和Ca2+浓度 与正常组相比,H2O2引起HUVECs出现细胞内ROS和Ca2+积累,两者呈正相关性,导致细胞凋亡。DMY为强抗氧剂,DCFH-DA探针对细胞内ROS反应较为敏感,故DMY(低、中、高剂量)组ROS量与DMY浓度呈正相关,DMY(低、中、高剂量)组ROS量反低于正常组。与正常组相比,DMY(中、高剂量)组细胞内Ca2+浓度差异有统计学意义(P<0.05),但ROS水平差异无统计学意义(P>0.05),故DMY(中、高剂量)组与正常组差异无统计学意义。总之,DMY低剂量组,能显著下调细胞内ROS水平和Ca2+浓度,且差异有统计学意义(P<0.05),故DMY低剂量组对H2O2诱导的细胞起最佳保护作用。见表3。
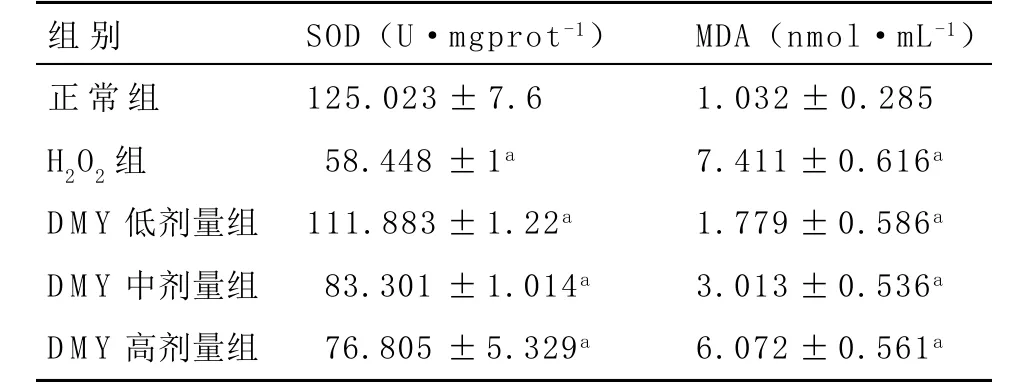
表2 DMY对细胞上清液SOD活性和MDA含量的影响(n=15,±s)
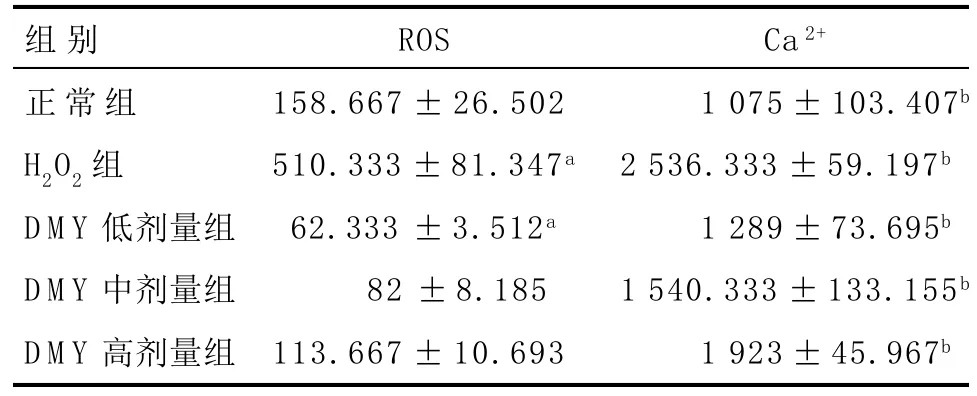
表3 DMY对细胞内ROS和Ca+浓度的影响(n=15,±s)
3 讨论
目前全球糖尿病患病率呈明显上升趋势,预计到2030年将达5.52亿。此外,在全球范围内有糖尿病前兆、糖耐量受损、胰岛β细胞功能失调人群,到2030年将达3.98亿。目前认为糖尿病及其并发症潜在的发生机制主要为氧化应激,内皮功能紊乱而引发糖尿病诱导血管性的疾病。研究表明内皮功能紊乱往往先于糖尿病临床症状出现[9-10]。糖尿病对微小血管的损伤导致血管硬化损伤是不可逆的。因此,通过早期诊断和优化血糖控制以预防微小血管的损伤,减少并发症[11]有着非常重要的作用。
SOD是细胞内重要的内源性抗氧化物酶,在人体内将超氧阴离子自由基转化成H2O2,从而减少超氧阴离子与一氧化氮反应生成有活性的过氧硝酸盐的可能性[12],可间接反映细胞内的抗氧化水平的情况。MDA是细胞内自由基作用于多不饱和脂肪酸发生过氧化反应后的产物,可间接反映脂质过氧化水平的情况[13]。由于SOD和MDA都是氧化损伤在不同层次上的反应,他们之间的表现有一致性。
ROS在糖尿病的发病和血管功能障碍的发展中扮演重要的角色。在糖尿病并发症的靶细胞里发现线粒体ROS生成增加[14]。而细胞内的Ca2+是细胞内重要的第二信使,钙稳态是细胞正常存在的基础。本研究使用H2O2模拟糖尿病内皮细胞损伤模型,H2O2具有强氧化性,低浓度可导致正常细胞出现凋亡,高浓度则出现坏死。H2O2引起细胞损伤的关键在于通过Ca2+作为第二信号,引发一系列细胞程序化死亡的信号传导。ROS对细胞内Ca2+有一定的调控作用。当Ca2+浓度升高超过正常细胞内Ca2+的阈值,Ca2+浓度升高可促进胞内ROS堆积,反之亦然,两者在细胞凋亡中起重要作用。
氧化应激的预防机制,有助于减少ROS的代谢产物及其衍生物的形成,包括SOD、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)等。这些抗氧化酶水平影响各种组织氧化应激的敏感性和糖尿病并发症的发生。糖尿病的发生会增加脂质过氧化反应的敏感性,这是导致糖尿病并发症的形成的重要原因。DMY是一种具有抗氧化、抗感染等功效的黄酮类化合物。目前鲜有有关从细胞学角度出发探讨DMY对糖尿病的研究报道。本实验研究DMY对H2O2诱导HUVECs的保护作用及其相关机制,证实DMY能增强细胞内SOD活性,降低MDA含量,通过降低细胞内ROS、Ca2+从而对HUVECs起保护作用,以低浓度5μg·mL-1DMY时效果最佳。关于其最佳保护药物浓度,笔者认为浓度越高,超过细胞本身负荷的能力,反造成细胞代谢的负担,产生细胞毒性。不同于DMY对抑制肿瘤细胞的增殖,出现剂量依赖性,浓度越高,抗肿瘤越强[15]。
[1] 陈绪维, 董柏平, 陈介眉, 等. 藤茶饮用药用价值研究[J]. 湖南农业科学, 2007(6): 180-181.
[2] 吴明彩, 蒋明, 毕富勇. 二氢杨梅素联合丝裂霉素对胃癌细胞的生长抑制作用[J]. 中国病理生理杂志. 2011, 27(7): 1424-1427.
[3] 张志坚, 张晓元, 李国林, 等. 二氢杨梅素对细胞等氧化伤害时的保护作用[J]. 湖南师范大学自然科学学报, 2007, 30(2): 99-102.
[4] 苏东林, 黄继红, 姚茂君. 二氢杨梅素的急性毒理学评价及对酒精性肝损伤的防治效果[J]. 湖南农业科学, 2009(11): 90-93.
[5] 陈立峰, 张琼, 董倩倩. 二氢杨梅素对大鼠免疫性慢性胃炎胃粘膜的保护作用及其机制[J]. 中国药理学与毒理学杂志,2009, 23(5): 381-387.
[6] 卢威, 秦晓改, 王跃虎, 等. 二氢杨梅素对四氧嘧啶性糖尿病小鼠的降糖作用研究[J]. 中药药理与临床, 2011, 27(4): 15-17.
[7] Barregard L. Cardiovascular disease and diabetes-effects of methyl mercury, cadmium, and lead[J]. Toxicology letters,2012, 211: S12.
[8] 王浩. 过氧化氢诱导人脐静脉内皮细胞凋亡时PPARβ表达及活性变化[D]. 中南大学, 2010: 1-36.
[9] Hemmingsen B, Lund SS, Gluud C, et al. Intensive glycaemic control for patients with type 2 diabetes: systematic review with meta-analysis and trial sequential analysis of randomized clinical trials[J]. BMJ, 2011, 343: 6898.
[10] Yudkin JS, Lipska KJ. Hard end points are needed for intensive glycaemic control in patients with type 2 diabetes[J].BMJ, 2012, 344: e708.
[11] Sawicki PT. Screening for diabetes: hope and despair[J].Diabetologia, 2012, 55(6): 1568-1571.
[12] Piconi L, Quagliaro L, Assaloni R, et al. Constant and intermittent high glucose enhances endothelial cell apoptosis through mitochondrial superoxide overproduction[J]. Diabetes, 2006, 22(3): 198-203.
[13]Zhao Y, Lu N, Li H, et al. High glucose induced human umbilical vein endothelial cell injury: involvement of protein tyrosine nitration[J]. Mol Cell Biochem, 2008, 311(1-2): 19-29.
[14]Yao D, Brownlee M. Hyperglycemia-Induced Reactive Oxygen Species Increase expression of the receptor for advanced glycation end products (RAGE) and RAGE ligands[J].Diabetes, 2010, 59(1): 249-255.
[15] 尹梅梅, 潘振伟, 蔡本志, 等. 二氢杨梅素诱导人肺癌腺细胞系AGZY-83-a凋亡的实验研究[J]. 中国药理学通报, 2008,24(5): 626-630.
