2-(2′-羟基苯基)吡啶并噻唑类化合物的合成、结构及光谱性质研究
2014-01-05吕小军傅文甫
覃 彪,陈 勇,吕小军,傅文甫*
(1.中国科学院 理化技术研究所,北京100190;2.中国科学院大学,北京100049)
激发态质子转移(ESIPT,包括分子内和分子间的)是一种在光化学和光生物过程中广泛研究的基本反应之一[1-4]。所谓激发态质子转移是指某些有机分子在光、热或电等条件的作用下,使分子跃迁到激发态,这时分子中某一基团上的氢核(即质子)通过分子内氢键或分子间的氢键桥,转移到分子内邻近的N、O和S等杂原子上,形成互变异构体的过程。2-(2′-羟基苯基)吡啶并噻唑(简称HPT)是一类具有激发态质子转移效应的有机分子,在外界光激励下到达激发态,经历一个非常快(~10-2s)的激发态质子转移过程形成光致互变异构体,并保持该互变异构体还处于激发态,能够发射光子回到基态。这类分子具有光学双稳态(烯醇式和酮式)、光致变色和光学非线性等特性,在光限幅、光存储和光开关等光学器件中具有广泛的应用前景[5-8],引起了人们极大的研究兴趣[9-11]。HPT分子通常以烯醇式的构型处于基态,当被紫外光激发后可发生激发态质子转移生成其异构体,即HPT的酮式结构。这时发生的荧光通常表现为两个发射带,荧光峰值波长较短的荧光带为正常荧光,荧光峰值有较大Stoks位移的的荧光带是互变异构体(酮式构型)发射的荧光,即转移荧光或反常荧光[12]。此类分子的激发态转移效应及其发光性质与溶剂的极性、pH值、溶剂的氢键特征和基态、激发态分子结构有密切的联系。本文旨在研究HPT化合物的反应形成过程、晶体结构和溶剂极性对ESIPT效应的影响。
1 实验部分
1.1 仪器与试剂
1HNMR采用瑞士 Bruker公司的 DPX 400 MHz核磁共振仪,TMS为内标;EI-MS质谱在Waters型GCT Premier质谱仪上获得;紫外-可见吸收光谱采用Hitachi UV-3100光谱仪;荧光光谱采用 Hitachi F-4500荧光光谱仪;X-ray单晶测试采用 Rigaku R-AXIS RAPID IP X-ray 单晶衍射仪;实验过程中所用试剂均为市售分析纯,购于梯希爱化成工业发展有限公司;所用溶剂均为北京化工厂生产;柱层析硅胶使用青岛海洋化工的产品(200~300目)。
1.2 目标化合物的制备
基于2-巯基-3-氨基吡啶的HPT类化合物的合成路线如下式所示,我们参考了文献的合成方法,但在合成氟硼化合物的时候,发现该条件下可以催化配体L1发生分子内关环反应,进而得到了关环配体L3和其氟硼化合物B1。我们采用同样的反应条件,得到了希夫碱配体L2和其氟硼化合物B2。
1.2.1 2-巯基-3-(2-羟基苯甲基亚胺)-吡啶的合成(L1)[13]
2-巯基-3-氨基吡啶(500mg,3.96mmol)溶于15mL甲醇溶液中,加入水杨醛(484mg,0.413mL),50℃搅拌反应4h。冷却至室温,过滤,在甲醇中重结晶得到黄色固体500mg(54%)。

HPT的合成路线
1HNMR (400MHz,CDCl3):12.53 (s,1H),8.65(s,1H),8.35(d,J=5.6Hz,1H),7.47~7.35(m,3H),7.15(dd,J=7.8,4.8 Hz,1H),7.06(d,J=8.5Hz,1H),6.97(t,J=7.5Hz,1H).EI-MS:m/z 230.0533 (C12H10N2OS)。
1.2.2 2-(2′-苯酚)-5-吡啶并噻唑(L3)和氟硼化合物B1的合成
将L1(200mg,0.43mmol)加入到装有10 mL无水二氯甲烷的25mL圆底烧瓶中,然后依次加入三乙胺0.22mL和三氟化硼乙醚0.6mL,室温搅拌反应1h,减压旋蒸除去溶剂,得到的固体用硅胶色谱柱分离,二氯甲烷作洗脱剂;分离得到L3 50mg(淡黄色固体),B1 100mg(黄绿色固体)。
L3:1HNMR (400MHz,CDCl3):12.27 (s,1H),8.59(d,J=3.2Hz,1H),8.21(dd,J=8.2,1.5Hz,1H),7.72(dd,J=7.9,1.4Hz,1H),7.44(ddd,J=15.6,8.4,3.1Hz,2H),7.11(d,J=9.2Hz,1H),6.99(t,J=7.6Hz,1H).EI-MS:m/z228.0193(C12H8N2OS)。
B1:1HNMR (400MHz,CDCl3):8.73 (d,J=4.6Hz,1H),8.62(d,J=8.5Hz,1H),7.75~7.59 (m,3H),7.24 (d,J=8.5Hz,1H),7.08 (t,J=7.6Hz,1H).EI-MS:m/z 276.0103(C12H7BF2N2OS)。
1.2.3 3-((3-羟基萘)-2-甲亚胺基)-2-巯基吡啶(L2)的合成
在单口烧瓶中加入30mL甲醇,再依次加入3-氨基-2-巯基吡啶(630mg,5mmol)和2-羟基-1-萘甲醛(861mg,5mmol),加热回流,反应液呈暗红色,反应4h后,冷却至室温,浓缩至10mL,过滤收集固体,甲醇洗,甲醇中重结晶得黄绿色固体L2 1g,产率71%。
1HNMR (400MHz,DMSO):14.62 (s,1H),9.96(s,1H),8.72(d,J=8.8Hz,1H),8.35(d,J=4.7Hz,1H),8.22 (d,J=7.0 Hz,1H),8.11(d,J=9.0Hz,1H),7.94(d,J=7.6Hz,1H),7.64(d,J=5.6Hz,2H),7.50~7.36 (m,2H),7.28 (d,J=9.0Hz,1H).ESI-MS m/z:279.1208(C16H12N2OS)。
1.2.4 氟硼化合物B2的合成
将L2(560mg,2mmol)加入到装有10mL无水二氯甲烷的25mL圆底烧瓶中,然后依次加入三乙胺1mL,三氟化硼乙醚1.2mL,室温搅拌反应1h,减压旋蒸除去溶剂,得到的固体用硅胶色谱柱分离,二氯甲烷作洗脱剂,分离得到红色固体B2 400mg,产率61%。
1HNMR (400MHz,CDCl3):8.70 (dd,J=14.7,7.2Hz,2H),8.53 (d,J=8.5Hz,1H),8.04(d,J=9.0Hz,1H),7.89(d,J=8.0Hz,1H),7.78~7.73(m,1H),7.63(dd,J=8.5,4.6Hz,1H),7.52 (t,J=7.9Hz,1H),7.36 (d,J=9.0Hz,1H).EI-MS:m/z 326.0370(C16H9BF2N2OS)。
2 结果与讨论
2.1 晶体结构
X-ray单晶测试及晶体结构解析:取大小合适的晶体进行测试,X射线衍射数据在Rigaku Saturn724CCD X-ray 单晶衍射仪上,113K 时,用Mo Kα辐射(λ=0.71073Å)以ω/2θ扫描方式收集,通过半经验等值法进行吸收校正[14]。结构用SHELXS 97程序直接法解出[15],非氢原子坐标及其各向异性温度因子用SHELXL 97程序精修[16],而氢原子由理论计算加入。通过deposit@ccdc.cam.ac.uk申请了单晶 L3的 CCDC 号为928905,B1的CCDC号为928906。
在实验中我们采用溶剂自然挥发法得到了L3的淡黄色晶体和B1的黄绿色晶体,L3和B1的晶胞参数见表1,晶体结构见图1。在L3的晶体结构中,分子内的所有原子几乎都在一个平面内,由于S原子和N原子的差别,噻唑环并不是一个标准的五元环,C4—N2—C6的键角为110.70°,C5—S1—C6 的 键角 为 88.82°,C5—S1 和C6—S1的键长几乎相同为1.740Å,C4—N2和C6—N2的键长分别为1.388Å和1.311Å,C12—O1键长为1.356Å,其他部分键长键角见表1。分子内O1上的H原子与N2形成较强的氢键,O1—H……N2的距离是2.612Å;而分子与分子之间通过弱氢键C14—H……O1形成一维链,C14—H ……1的距离为3.335Å;再通过C8—H……N2的氢键形成三维的结构,C8—H……N2的距离为3.344Å。两个平行的分子之间距离为3.245Å,存在18.14°的滑移角,分子之间
存在一定程度的π-π堆积作用(图2所示)。图3是L3分子沿b轴和c轴方向的堆积图,沿b轴方向可以看见两个分子采取头尾相对的方式排列,沿c轴方向分子间存在一定的交叉,采取近乎垂直的角度排列。
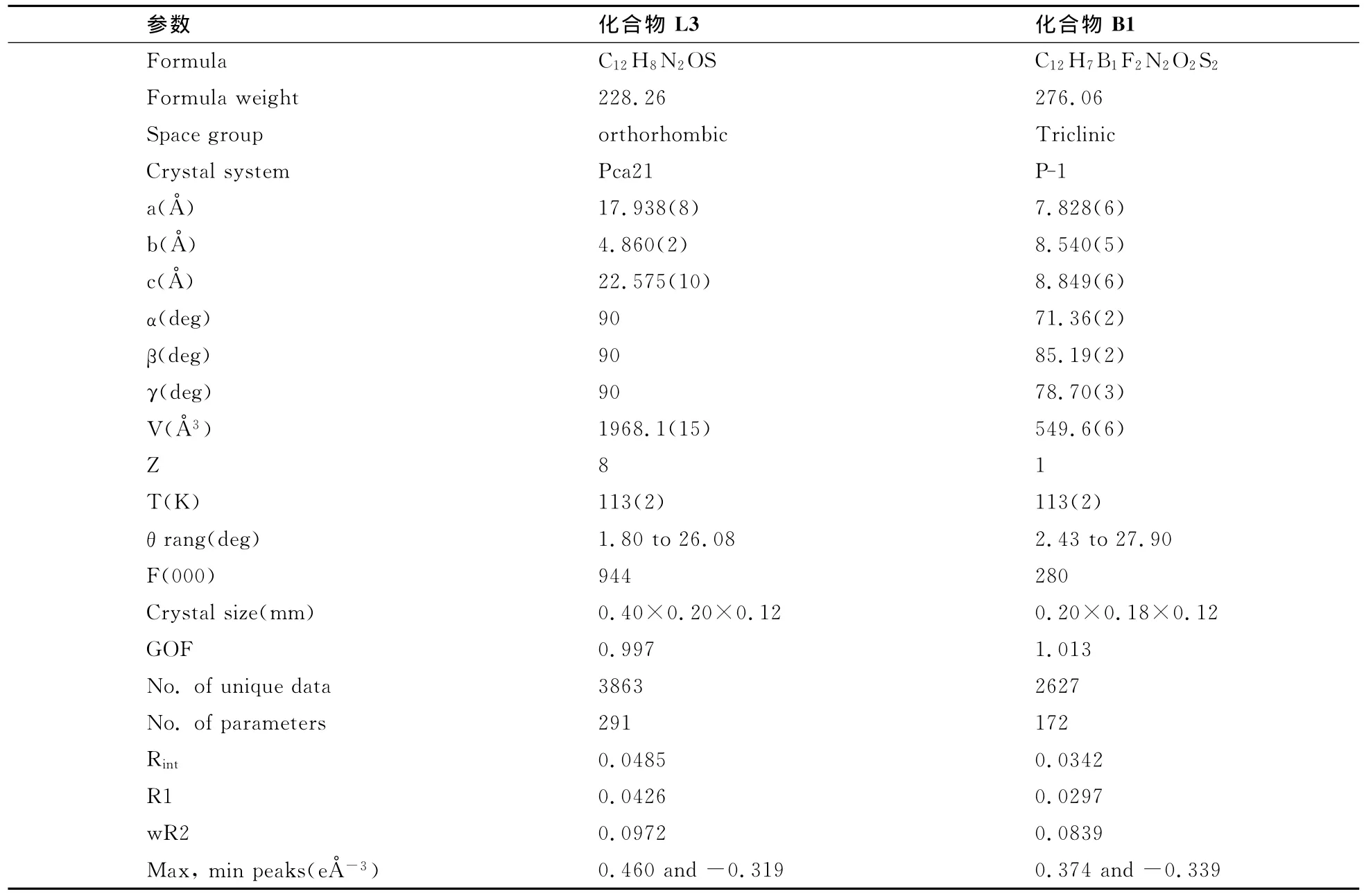
表1 L3和B1的X-射线衍射参数X-ray crystallographic data for L3and B1
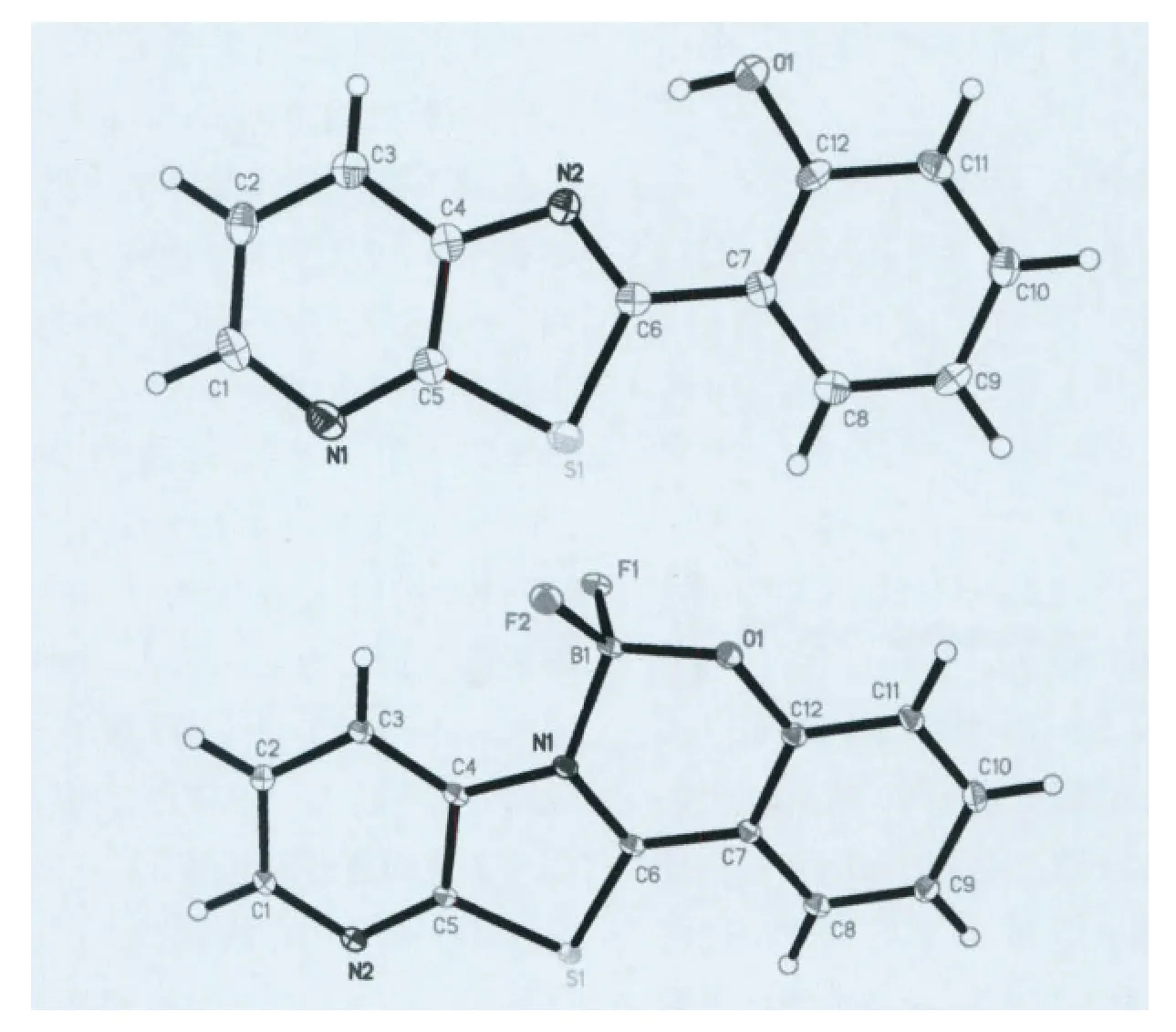
图1 化合物L3和B1的晶体结构
当L3与三氟化硼乙醚反应生成氟硼化合物B1后,从结构分析来看,形成氟硼过后,B原子并没有和配体L3的原子共平面,而是发生了一定的扭曲,两个F原子分布在配体分子平面的两侧。B原子到配体分子平面的距离为0.290Å,B—N键长为1.588Å,B—O 键长为1.443Å,N1—B1—O1的键角为109.16°。
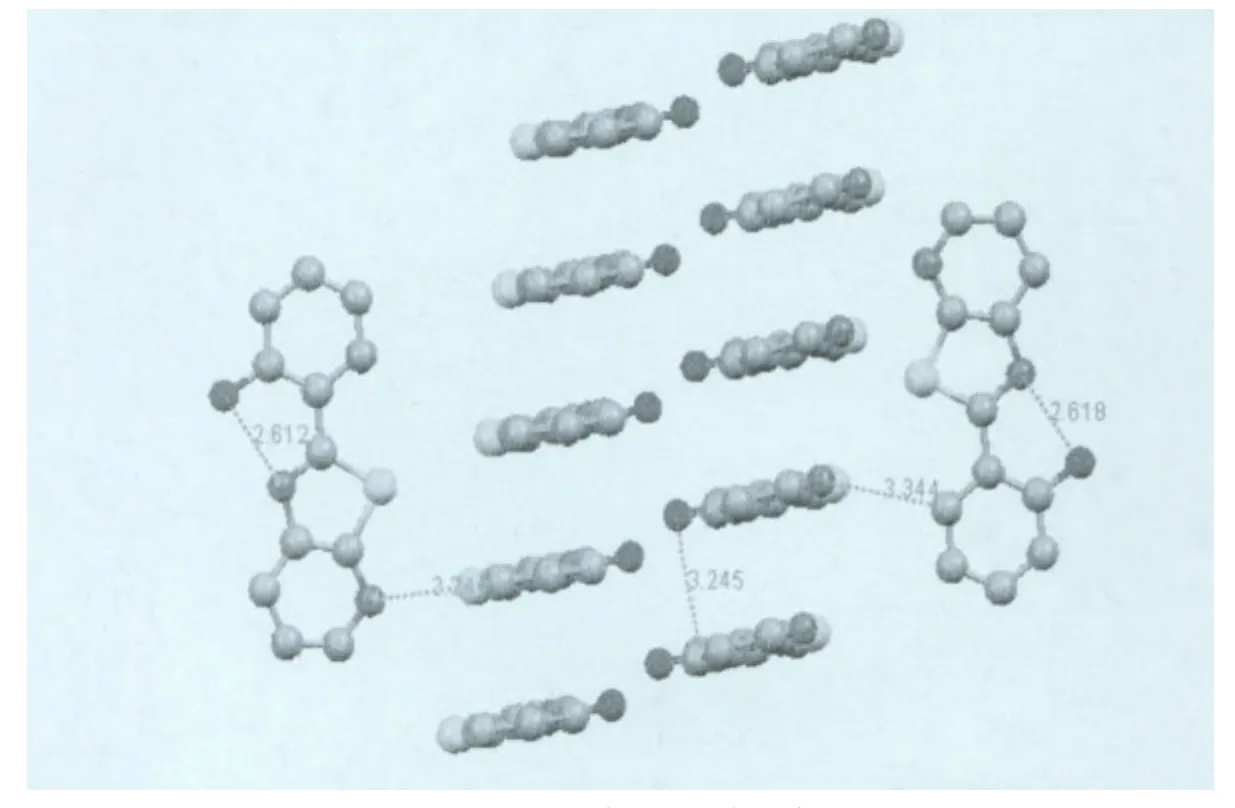
图2 L3分子内和分子间的氢键
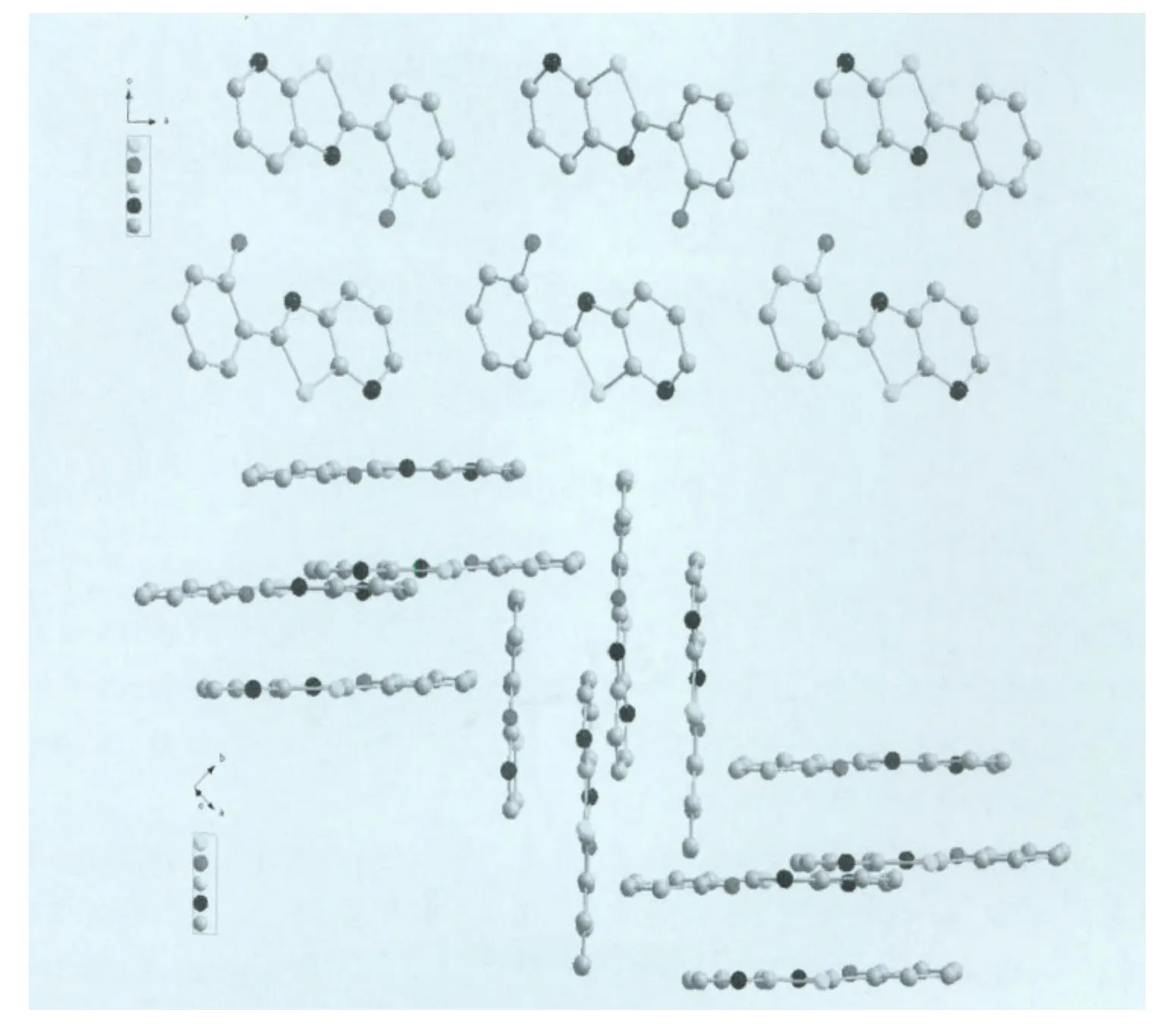
图3 L3分子沿b轴和c轴的分子堆积
B1分子采取头对尾的平行堆积方式形成二维结构,朝一个方向延展,在一对二聚体中发生了头对尾的π-π堆积,由于两个F原子的引入,使得分子与分子之间必须存在一定的错位才能避免相互排斥,两个分子平面间的距离为3.347Å,比L3的分子间距离有所增大,同一平面内也是采取头尾相对的排列方式,见图4。
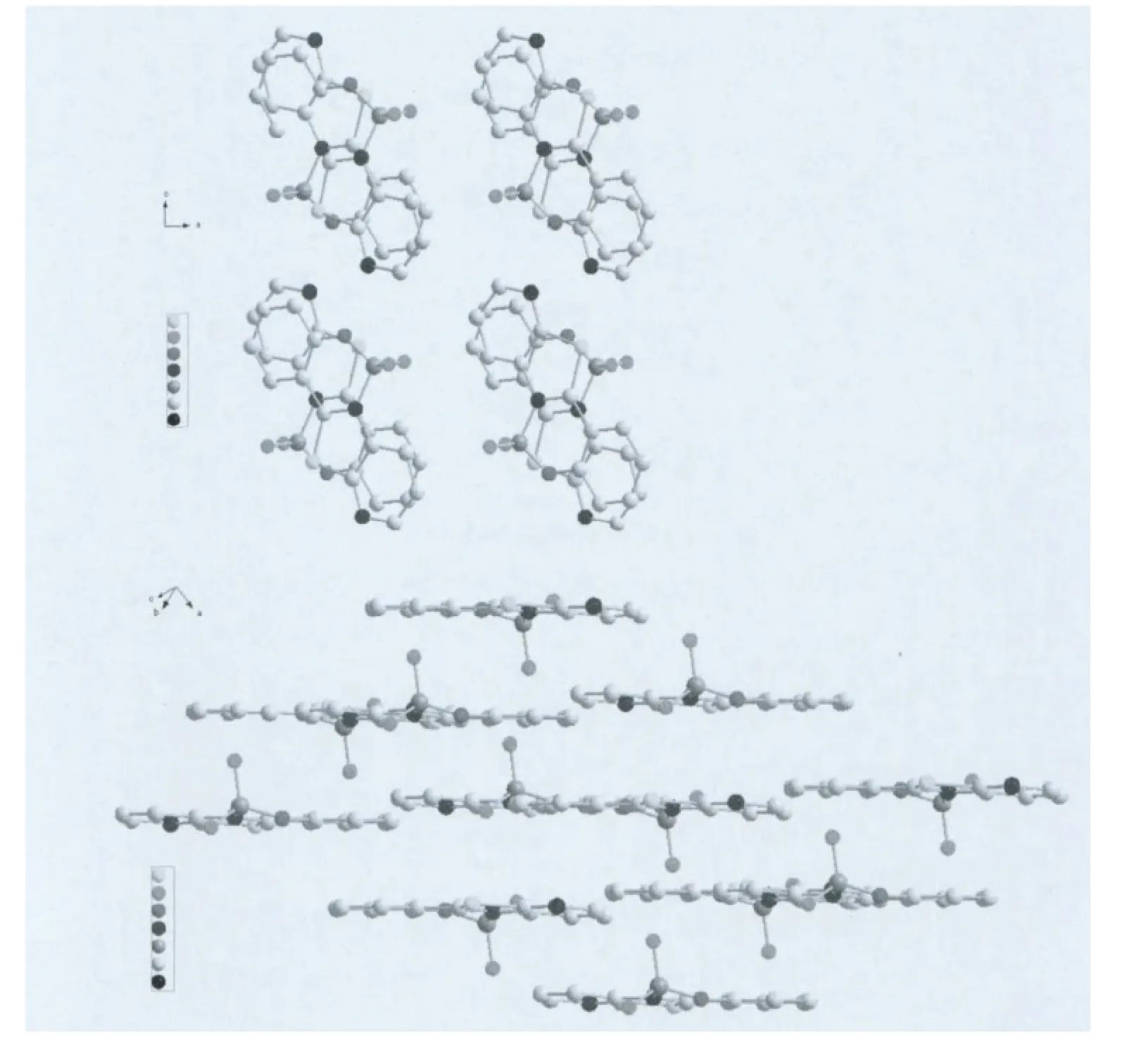
图4 B1的分子堆积图
2.2 光谱性质研究
配体L1、L3和氟硼化合物B1的紫外-可见吸收光谱和发射光谱如图5所示。L1、L3和B1都有两个主要吸收峰:L1(279nm,358nm)、L3(309nm,338nm)、B1 (320nm,368nm),氟硼化合物B1比起配体L1、L3其紫外可见吸收光谱发生了一定的红移,相对于L1红移了10nm,相对于L3红移了30nm,这是因为B原子的引入使得苯环和噻唑环稠合,增大了π共轭体系,降低了电子跃迁所需要的能量,分子的刚性也增强。B1的二氯甲烷溶液在370nm的光激发时,最大发射峰位于434nm处,Stoks位移为66nm(图6)。
我们在L2中引入了萘的结构,配体分子的共轭结构本身就比较大,其吸收光谱已接近可见光区(400nm),生成氟硼化合物以后,共轭结构进一步增大,其紫外-可见吸收光谱已经延伸到450 nm,它们的主要吸收峰有L2(269nm,352nm)、B2(349nm,395nm),对于L2来说B2发生了较大的红移,红移了43nm(图7)。我们测定了B2在二氯甲烷中的发射光谱,其最大发射峰位于455 nm,Stoks位移为60nm(图8)。
本文合成的 2-(2′-羟基苯基)吡啶并噻唑(HPT)是一类典型的具有ESIPT反应的有机分子[17-19],在基态 下,HPT 分子主要 以 烯 醇 式 构 型存在,而HPT分子烯醇式构型又可以如图9所示的几种不同形式存在于溶液体系中,即Ⅰ顺式烯醇式(Syn-enol,分子内O—H…N氢键),Ⅱ反式烯醇式(Anti,分子内O—H…S氢键),Ⅲ为酮式异构体(Keto),Ⅳ为HPT的溶剂化物,称为溶剂化烯醇式(Solvated enol,与溶剂形成分子间氢键)。HPT分子在溶液体系中有如此多构型且彼此间可相互转化,并以一定的动态平衡方式存在,但溶剂极性强烈影响HPT分子各态的分布及其相对含量。
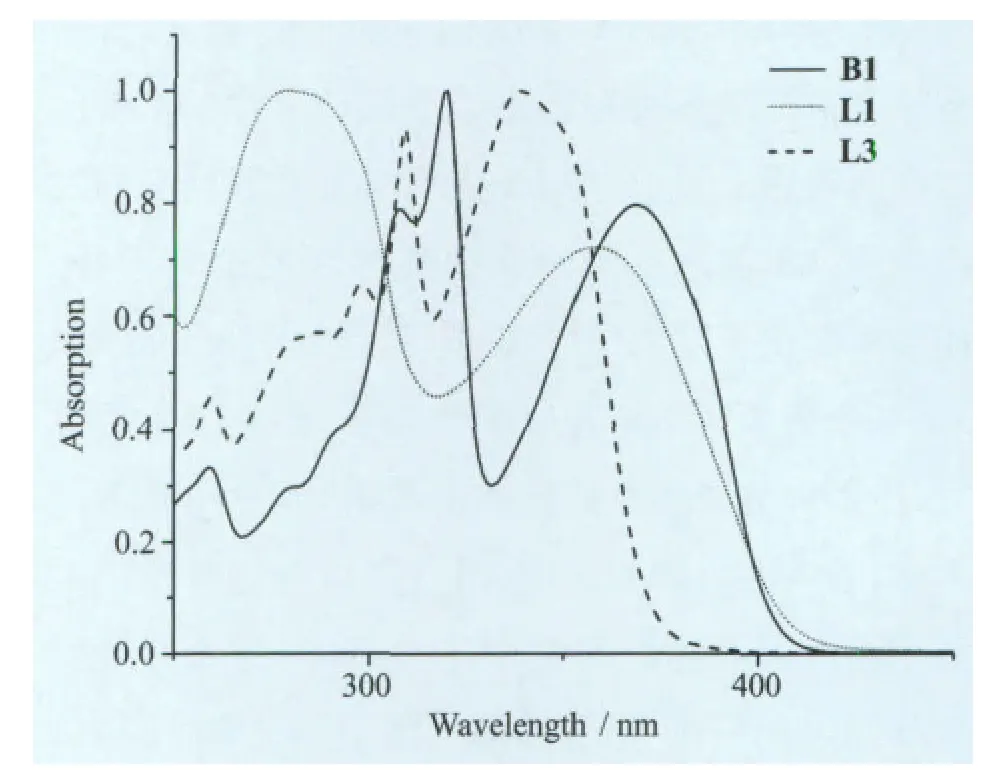
图5 L1、L3和B1的紫外-可见吸收光谱
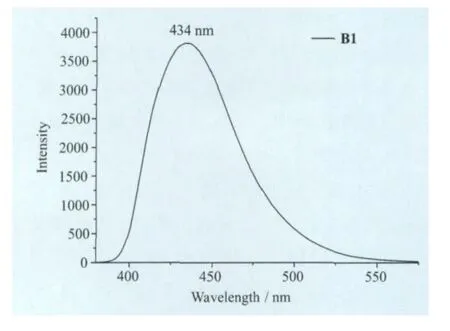
图6 B1的发射光谱

图7 L2、B2的紫外-可见吸收光谱
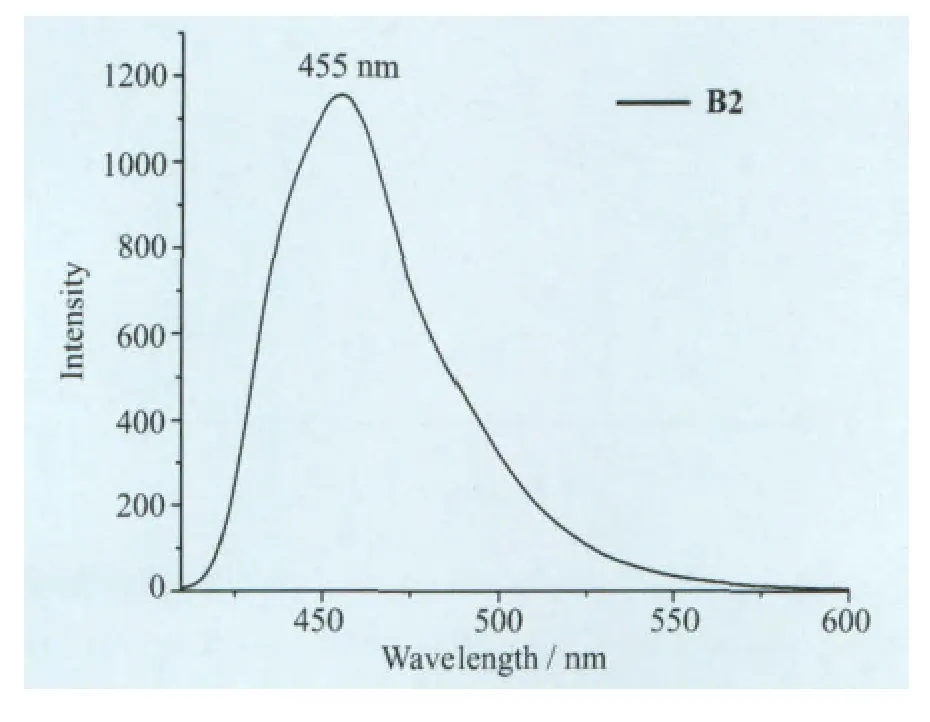
图8 B2在CH2Cl2溶液中的发射光谱
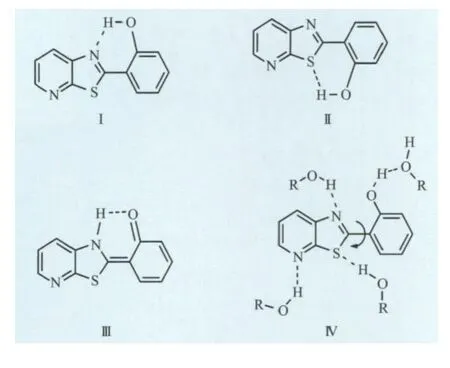
图9 HPT化合物的四种异构体形式
本文还研究了溶剂的极性对L3光谱的影响(见图10、图11),选用甲醇、二氯甲烷和正己烷三种极性依次减小的溶剂来测定它的吸收光谱和发射光谱。
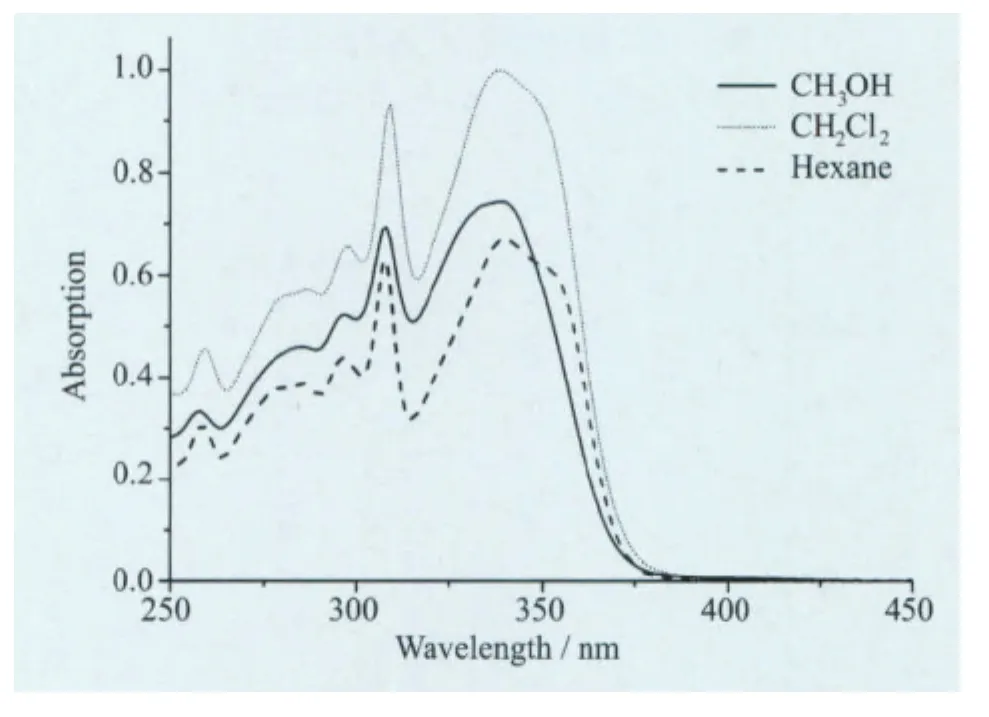
图10 L3在不同极性溶剂中的紫外-可见吸收光谱
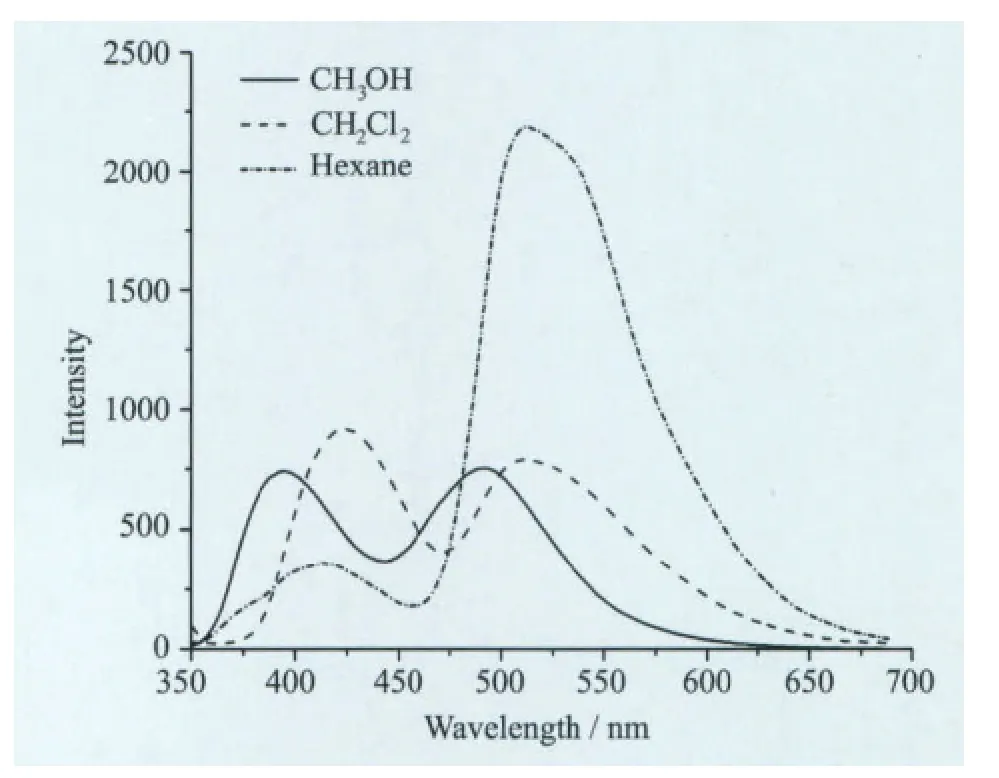
图11 化合物L3在不同溶剂中的发射光谱
从图10可以看出,L3在三种不同极性溶剂中的吸收光谱没有太大变化,主要吸收峰有308 nm和338nm,属于烯醇式构型的π-π*跃迁,说明该化合物在基态时的紫外-可见吸收光谱对溶剂的极性不敏感。图11是L3在不同极性溶剂中的发射光谱,L3在选择的溶剂中都存在两个发射峰。在强极性质子溶剂甲醇中,能看到395nm和491 nm两个发射峰,前者属于吡啶并噻唑母体的发射,后者为分子内电荷转移的发射,其发射强度差不多,表明在甲醇溶剂中,吡啶并噻唑与苯酚间的共平面性因甲醇的氢键作用而破坏,导致共轭程度降低而使发射光谱蓝移。随着溶剂极性的降低,L3分子本身的荧光逐渐减弱,ESIPT效率增强,表明溶剂极性越大,越不有利于分子发生ESIPT效应。在甲醇溶剂中,甲醇分子使得L3分子形成更多的溶剂化烯醇式构型Ⅳ,而常态的烯醇式Ⅰ和Ⅱ相应减少。构型Ⅳ不存在分子内氢键,因而不能发生ESIPT反应,仅有顺式烯醇式Ⅱ才能发生ESIPT反应转变为酮式结构。在二氯甲烷溶剂中,两个发射峰分别位于435nm和521 nm,发射峰发生了红移,发射强度变化不大,分别对应的是正常发射和酮式异构体的发射;在非极性溶剂正己烷中两个发生峰位于423nm和522 nm,并且异构体的发射强度远远强于正常发射,表明在正己烷中,绝大多数的HPT烯醇式构型被光激发后转变为酮式互变异构体,分子ESIPT效率最高。
3 结论
本文合成了三个配体L1、L2和L3以及两个氟硼化合物B1、B2,并得到了L3和B1的晶体结构。氟硼化合物的生成增大了分子的共轭程度,增强了分子的刚性。利用紫外-可见吸收光谱和稳态荧光光谱对所合成的化合物进行了光谱研究。研究表明L3分子内存在较强的分子内氢键,可以发生ESIPT效应,溶剂的极性对其发射光谱影响较大。
[1] Ormson S M,Brown R G.Excited state intramolecular proton transfer.I:ESIPT to nitrogen[J].Progress in Reaction Kinetics and Mechanism,1994,19:45-91.
[2] Dennison S M,Guharay J,Sengupta P K.Intramolecular excited-state proton transfer and charge transfer fluorescence of a 3-hydroxyflavone derivative in micellar media[J].Spectrochimica Acta Part A :Molecular and Biomolecular Spectroscopy,1999,55(4):903-909.
[3] Dorte M,Jens S,Jens D,et al.Coherent vibrational ground-state dynamics of an intramolecular hydrogen bond[J].Chemical Physics Letters,2001,341:56-62.
[4] Wang H,Zhang H,Abou-Zied O K,et al.Femtosecond fluorescence upconversion studies of excited-state protontransfer dynamics in 2-(2′-hydroxyphenyl)benzoxazole(HBO)in liquid solution and DNA[J].Chemical Physics Letters,2003,367(5):599-608.
[5] Wu S Z,Luo S J,She W L,et al.All-optical switching effects in poly(methyl methacrylate)composites[J].Reactive and Functional Polymers,2003,56:83-88.
[6] Guo Y X,Li X P,Zheng J J,et al.All optical switching effect of 7-hydroxyquinolone in dimenthyl sulfoxide solvent[J].Journal of Optoelectronic Laser,2006,17(1):90-93.
[7] Han Y K,Ko B S.Synthesis of new erasable optical data storage polymers and their applications[J].Optical Materials,2003,21(1):621-625.
[8] Zhang H B,Chen W Z,Wang M Q.Study on the optical limiting mechanism of metallo-phthalocyanine/silica gel glasscomposites[J].Materials Letters,2005,59:1395-1399.
[9] Ma L N,Nan J Y,Wu F,et al.Spectroscopic investigation of 3-hydroxyflavone in different polarity and pH values solutions[J].Spectroscopy Spectral Analysis,2009,29(4):994-998.
[10] Angulo G,Organero J A,Carranza M A,et al.Probing the behavior of confined water by proton-transfer reactions[J].The Journal of Physical Chemistry B,2006,110(47):24231-24237.
[11] Lochbrunner S,Wurzer A J,Riedle E.Microscopic mechanism of ultrafast excited-state intramolecular proton transfer:A 30-fs study of 2-(2′-hydroxyphenyl)benzothiazole[J].The Journal of Physical Chemistry A,2003,107(49):10580-10590.
[12] Rios M A,Rios M C.Abinitio study of the hydrogen bond and proton transfer in 2-(2′-hydroxyphenyl)benzothiazole and 2-(2′-hydroxyphenyl)bezimidazole[J].The Journal of Physical Chemistry A,1998,102(9):1560-1567.
[13] Liu Y F,Li Q T,Zhao J Z,Guo H M.BF2-bound chromophore-containing NN Pt(Ⅱ)bisacetylide complex and its application as sensitizer for triplet triplet annihilation based upconversion[J].RSC Advances,2012,2:1061-1067.
[14] Higashi T.Empirical Absorption Correction Based on Fourier Series Approximation.1995.
[15] Sheldrick G M.SHELXS 97,Program for Crystal Structure Solution.Götingen:University of G tingen,1997.
[16] Sheldrick G M.SHELXL 97,Program for the Refinement of Crystal Structure.1997.
[17] Roberts E L,Dey J,Warner I M.Ground-and excited(state structural orientation of 2-(2′-hydroxyphenyl)benzazoles in cyclodextrins[J].The Journal of Physical Chemistry B,1996,100:19681-19686.
[18] Mintova S,Waele V D,Holzl M,et al.Photochemistry of 2-(2′-hydroxyphenyl)benzothiazole encapsulated in nanosized zeolited[J].The Journal of Physical Chemistry A,2004,108:10640-10648.
[19] 胡 睿,郭旭东,杨国强.激发态分子内质子转移化合物的性能及作为荧光化学传感器的应用研究[J].影像科学与光化学,2013,31(5):335-348.Hu R,Guo X D,Yang G Q.Investigation on the property of the excited state intramolecular proton transter compounds and its application as fluorescence chemical sensor[J].Imaging Science and Photochemistry,2013,31(5):335-348.
