多重RT-PCR联合毛细管电泳法检测BCR-ABL融合基因
2014-01-02吕晓楠叶辉铭曾骥孟
吕晓楠,叶辉铭,2,顾 龙,曾骥孟
(1.厦门大学药学院转化医学中心,福建厦门361005;2.厦门大学附属中山医院临检中心,福建厦门361004)
慢性粒细胞白血病(chronic myeloid leukemia,CML)是第一个将染色体异常与特定的肿瘤类型联系在一起的恶性血液性疾病,占成人白血病的15%,在我国年发病率为0.36/10万人[1]。超过95%以上的CML患者由于染色质异常产生基因融合(如BCR-ABL),染色体显带分析为t(9;22)(q34;q11),即费城染色体(philadelphia chromosome,Ph)[2]。融合基因编码一种酪氨酸激酶,诱导多种致癌性的信号通路,这是CML发病的主要分子机制之一。因BCR和ABL基因断裂点不同,产生多种多样的融合形式,临床上最常见的是e1a2、e13a2 和 e14a2[2]。CML 的治疗方案也多是针对Ph阳性细胞系或BCR-ABL蛋白本身进行的,例如利用靶向药物伊马替尼(Imatinib)来抑制BCA-ABL通路[3]。因此BCR-ABL融合基因的检测对于CML的分型诊断、分子机制研究以及治疗方案选择、预后判断等都有着重要意义。
目前融合基因的检测方法主要有染色体核型分析、荧光原位杂交(fluorescence in situ hybridization,FISH)以及逆转录聚合酶链反应(reverse transcription PCR,RT-PCR)等。染色体核型分析虽是临床上常规检测手段,但对样本和技术要求高,检测灵敏度低,尤其对于微小染色体易位难以检测出,故临床上通常还需要分子生物学等手段来进一步验证[4]。FISH虽可清晰的辨认各染色体结构异常,但价格昂贵,操作繁琐,假阳性率较高(>10%),且当Ph阳性细胞数<10%时即不适用[5]。相对于前两者,PCR扩增法对于样本要求不高,且具有检测快速,敏感度高等优点。因此,我们拟采用RT-PCR联合毛细管电泳技术一次性检测BCR-ABL融合基因多种融合形式(如e1a2、e13a2、e14a2),以期建立一种快速、简单、有效的检测方法,用以CML辅助诊断、分型、预后判断以及疗效评价等。
材料和方法
一、对象
血液样本均来源于厦门大学附属中山医院,其中融合基因阳性模板构建样本来自体检中心健康体检者,研究病例来自血液科2010年至2013年住院的CML患者50例,男34例,女16例,年龄15~85岁,全部病例经过临床血象、骨髓象等形态学检测初步确诊,且均进行了染色体核型分析,诊断标准参照血液病诊断及疗效标准,具体见表1[6-8]。正常对照组为18名健康体检者,男10名,女8名,年龄18~70岁。

表1 CML的诊断标准
二、方法
1.血液样本RNA提取和cDNA模板第一链合成 CML患者及体检者外周抗凝全血5mL,采集后尽快进行RNA抽提,以防时间过长或反复冻融后损坏RNA的品质。设备为MagCoreHF16全自动核酸抽提仪及其配套全血RNA抽提试剂盒(厦门芮宝生医股份公司),操作严格按仪器和试剂盒说明书;并用TransScript cDNA第一链合成试剂盒(北京全式金公司)进行反转录后,将cDNA模板分装,置于-20℃保存备用。
2.BCR-ABL融合基因阳性模板构建 采用重叠延伸PCR法[9]构建BCR-ABL的3种融合形式,作为阳性对照品。遵循其原理步骤,我们以正常血液cDNA(无BCR-ABL融合基因)为模板,采用TransGen高保真酶热启动酶FastPfu(北京全式金公司),首先分别扩增ABL和BCR基因,产物进行2%琼脂糖凝胶电泳、对目的片段切胶、用胶回收试剂盒(上海生工)回收,再以2种回收的产物为模板(保持使用量均等),在同1个PCR反应体系里进行融合扩增。每个目标产物设置2个平行,1个阴性对照,阴性对照里不加模板,以检测PCR体系中的试剂是否被污染。将回收的PCR产物连接到 TransGen pEASY-Blunt载体,转化大肠杆菌感受态细胞,挑选单克隆进行测序验证。
3.引物设计 BCR基因以其在NCBI中的登录号NM_004327上的mRNA序列为准,ABL基因则以文献中常见的登录号X16416上的mRNA序列为准。扩增所需引物(表2、表3)的设计均通过软件 Primer Premier v 5.00进行,并经 BLAST比对确认其特异性。设计好的引物由上海生工合成,回来后进行稀释,分装成多管保存在-20℃,避免反复冻融。

表2 构建阳性模板的引物设计

表3 检测融合基因的多重引物设计
4.多重RT-PCR联合毛细管电泳检测体系的建立与优化 初始反应体系:10×PCR缓冲液2.5μL,2.5 mmol Mg2+2μL,2.5 mmol dNTPs 2μL,10 μmol/L 上、下游引物各 0.5μL,5 U/μL TaqDNA 聚合酶 0.4μL,cDNA 模板 5μL,加双蒸水,补足反应总体积为25μL。PCR扩增条件:95℃ 1 min;95℃ 30 s,66~61℃ 30 s(每个循环降低1℃),72 ℃ 20 s,5 个循环;95 ℃ 30 s,61 ℃30 s,72℃ 20 s,25个循环。影响多重RT-PCR反应的因素很多[10],如退火温度、酶用量、引物对的浓度等。本研究采用了退火温度Touchdown的PCR反应程序[11],故在此不再进行退火温度的优化,主要对后两种影响因素进行了条件实验,在其它参数不变的情况下,依次改变1个参数:(1)优化酶用量:从1.0 ~2.5 U,每梯度相差 0.5U;(2)引物浓度:从 0.08 ~ 0.2 μmol/L,每浓度梯度相差0.04 μmol/L。通过考察是否有引物二聚体产生、存在特异引物等选择最佳反应体系。检测体系采用了毛细管电泳检测(BIOptic's Qsep100 DNA-CE,台湾)[12],使用的是熔融态成型的二氧化硅毛细管柱,内径75μL,柱长150 mm,缓冲液为 Mops-Tris(pH 值 7.55)。上样体积0.5μL,25℃下4 kV 15 s电动进样,8 kV恒压电泳,在590 nm处检测激光诱导的溴化乙锭的发射波长。
5.多重RT-PCR联合毛细管电泳检测体系的性能评估 (1)灵敏度分析:将构建的阳性模板(e1a2、e13a2和e14a2)质粒均进行10倍梯度稀释,即稀释成100~107拷贝/μL 8个浓度梯度,在优化的PCR条件下进行反应,分析该方法最低检测拷贝。每个浓度梯度作2个平行反应,每次实验均设置1个阴性对照(以灭菌超纯水为模板);(2)特异性分析:检测18名健康体检者外周血融合基因,观察此方法的特异性;(3)模拟分析:将构建成功的 BCR-ABL融合模板(e1a2、e13a2、e14a2,105 拷贝/μL)分别与正常人血液cDNA(50 ng/μL)进行混合,模拟自建方法检测临床阳性样本的情况。
6.多重RT-PCR体系检测临床样本的BCRABL融合基因 用自建的多重RT-PCR结合毛细管电泳技术平行检测50例CML患者患者。
三、统计学方法
采用SPSS 13.0软件进行统计分析。采用McNemar检验和一致性检验分析,评价建立的多重RT-PCR法的阳性率以及与荧光定量PCR法结果总符合率。P<0.05为差异有统计学意义。
结 果
一、成功构建BCR-ABL融合基因阳性模板
通过重叠延伸法,第1次PCR分别得到扩增产物BCR-1/2/3(468/142/217 bp)和ABL-1/2/3(291/295/297 bp),第2次融合扩增PCR反应得到 BCR-ABL基因的 3种融合形式,即 e1a2(724bp),e13a2(398bp),e14a2(473bp)。2% 琼脂糖凝胶电泳检测,结果见图1、2。以超纯水作为阴性对照。

图1 融合形式e1a2模板构建电泳图

图2 融合形式e13a2和e14a2模板构建电泳图
二、多重RT-PCR联合毛细管电泳检测体系的建立与优化
分别设置的1.0~2.5 U的酶用量梯度以及0.08 ~ 0.2 μmol/L 的引物浓度梯度结果显示BCR-ABL融合基因PCR体系中最佳酶和引物用量分别为 0.2μL 和 0.3μL。因此,建立的多重RT-PCR最佳反应体系为:10 PCR缓冲液2.5μL,2.5 mmol Mg2+2μL,2.5 mmol dNTPs 2μL,10 μmol/L 上下游共 3 条引物各 0.3μL,5 U/μL TaqDNA聚合酶0.2μL,构建的阳性模板 cDNA 5μL,加双蒸水,补足反应总体积为 25μL。PCR扩增产物分别进行毛细管电泳结果与2%琼脂糖电泳,电泳结果一致,但毛细管电泳能够准确的计算出产物长度,进样量少,操作自动化,方便临床大批量样本快速、准确、直观的检测。
三、检测性能评价
1.灵敏度分析 将 e1a2、e13a2和 e14a2 3种模板以10倍梯度稀释,系列稀释样本检测结果见图3。e1a2本法的最低检测限为102拷贝/μL,e13a2和e14a2均为103拷贝/μL。
2.特异性分析 18名健康体检者外周血标本中均未检测到BCR-ABL融合基因,表明本法具有良好的特异性。
3.模拟分析 阳性模板与正常人血液混合后的模拟样本检测结果如图4,3~6号混合标本电泳出现的条带与预期一致,正常血液无阳性电泳结果。

图3 灵敏度分析电泳结果

图4 模拟血液环境中检测到的e1a2、e13a2、e14a2毛细管电泳图
四、临床样本检测
应用自建的多重RT-PCR联合毛细管电泳方法对50例CML的患者外周血进行融合基因检测,BCR-ABL融合基因阳性率为86.0%(43/50),其中e13a2型20.0%、e14a2型66.0%,阳性率较低与本组病例中包括6例复诊者有关。与骨髓细胞培养染色体核型分析比较,本方法检测BCRABL融合基因的阳性符合率为97.6%(41/42),阴性符合率为75.0%(6/8),总符合率为94.0%(47/50),2种方法具有较高的一致性(Kappa=0.765,P >0.05)(表 4)。
以1例CML患者为例,其检测结果见图5。患者的电泳结果与e14a2阳性对照模板处于一个位置,即表示此CML患者存在BCR-ABL融合基因的e14a2融合形式。检测中以正常血液为阴性对照,确保此方法特异性;以构建的阳性模板为阳性对照;以超纯水做模板为空白对照,以排除试剂污染。
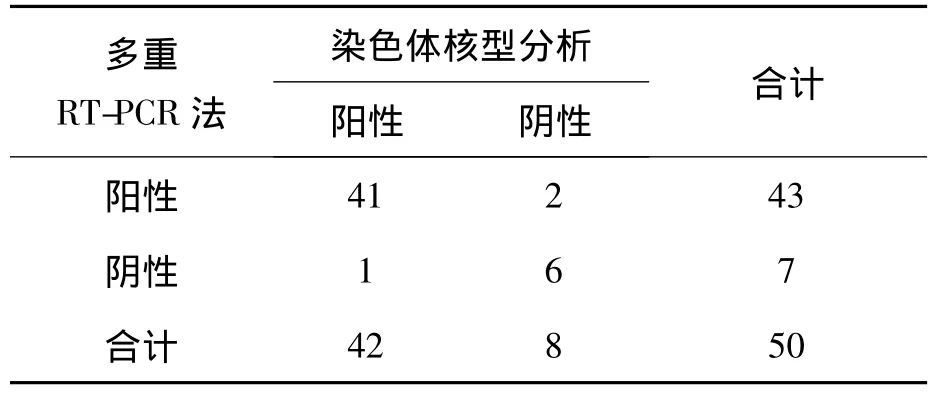
表4 2种方法检测BCR-ABL融合基因结果比较
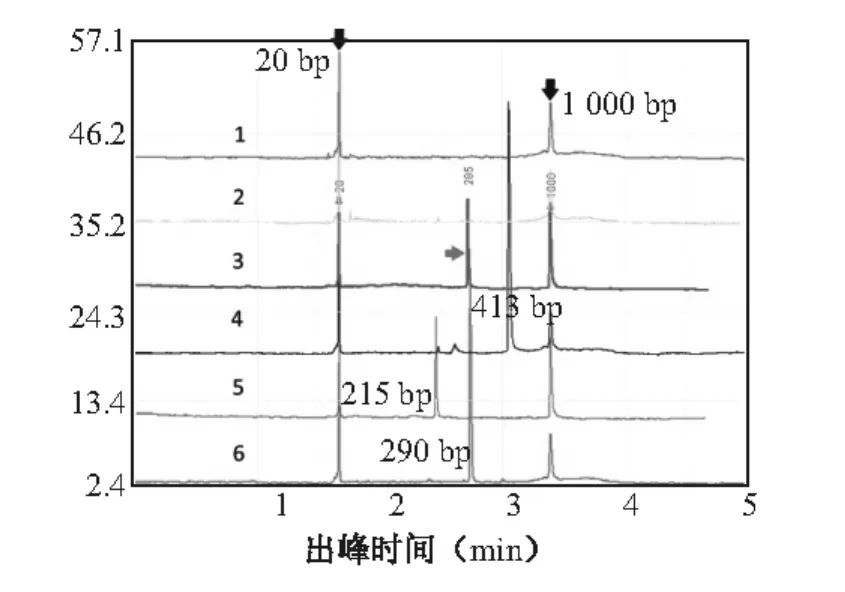
图5 检测患者样本融合基因的色谱图
讨 论
目前,临床实验室进行白血病诊断分型需要联合通过形态学(morphology,M)、免疫学(immunology,I)、细胞遗传学(cytogenetics,C)和分子生物学(molecular biology,M)检查,即MICM 分型系统。就CML而言,由于超过95%患者具有费城染色体,故细胞遗传学方法如核型分析即为初始判断CML的常规手段。然而,这个方法样本要求高,灵敏度低(一般在5%以上),无法检测到细微的染色体易位(约占所有患者的5%)[13],故临床上还需要辅助手段来进一步验证。
早期检测融合基因的PCR法常将多重PCR与巢式PCR结合,该类方法灵敏度(10-4~10-5)高,在微小残留性疾病的监测上具有重要意义[4,14],但是由于进行2次 PCR 反应很容易造成污染导致假阳性,且操作相对繁琐、费时。荧光定量PCR技术具有可定量,自动化程度较高,灵敏度高等优点,在一些大型医疗应用上较广泛,但目前用于白血病BCR-ABL融合基因分析的荧光PCR法多为单项目检测,检测仪器昂贵和试剂的成本高也限制了其临床应用。本研究的目的在于建立一种快速、简单、成本低且能有效检测BCRABL融合基因的方法,主要用以作为临床早期判断费城染色体的辅助手段。本研究设计的检测体系只需在1个PCR反应管里,即可同时检测多种BCR-ABL融合基因亚型,操作更加方便,且极大的降低了试剂成本。此外,本研究采用毛细管电泳作为检测系统,自动化程度高,可一次性快速检测大批量的样本,样本量消耗少(进样量最小为0.5μL),能同时生成电泳图以及色谱图,通过分析软件可直接读出样本扩增长度,若结合自动判读程序,可直接判断出具体的BCR-ABL融合基因亚型。本法可在3 h内完成从标本核酸提取到电泳出结果,给出检测报告,完全满足临床检测要求。初步的性能分析显示建立的PCR法其检测灵敏度高、特异性好;模拟样本显示其具有多重检测能力,可1次性检测出临床上多种融合亚型共存的患者;与骨髓细胞染色体核型分析一致性好。
费城染色体的形成即是位于9号染色体上q34区的ABL基因3端断裂片段连接到22号染色体上q11区的BCR基因5端断裂处,融合形成新型基因BCR-ABL。BCR和ABL基因断裂点并不止一种,故会产生不同的融合形式,最常见的就是ABL基因内含子1和BCR基因内含子1、13或者14位置断裂后融合形成的转录子e1a2、e13a2或 e14a2。其中 e1a2编码 190-kD蛋白 P190,e13a2和e14a2编码1种210-kD蛋白,即 P210,这2种融合形式在CML细胞中以1种存在或共存(5%)[2]。这些融合形式编码的融合蛋白都是一种酪氨酸激酶,但因其结构的差异使得它们在临床特征,对药物的反应性以及预后方面并不相似,因此清晰的区分各融合形式对于药物选择以及疗效评价方面都具有重要意义。染色体核型分析技术虽可辨别出染色体异常现象,但却并不清楚具体异常,PCR法则可针对不同的融合模板进行引物设计来具体区分。融合模板通常可从细胞或质粒中获得,但一种阳性细胞系只对应一种融合形式,故多种融合模板检测需要足够的细胞系,这无疑增加了实验的成本。因此,本研究采用了重叠PCR法来构建融合基因阳性模板(e1a2、e13a2和e14a2),其原理见图6。它的特点就是在2条基因连接处的引物设计中添加了能够与对方基因互补配对的碱基序列尾巴,从而通过碱基互补配对原则将两条基因连接起来,且连接处无添加额外碱基。所以构建融合基因模板的引物设计尤为重要,根据这3种融合形式(e1a2、e13a2和e14a2)具体的融合点,才能获得准确的融合模板。根据本研究的方案,可设计出各种可能融合模式的检测方法,用于CML分子发病机制研究。

图6 重叠延伸PCR法原理
本法在CML诊断分型、药物选择上具有实际应用价值,但在微小残留性疾病监测上还有待进一步研究。课题组正不断搜集各类、各期CML样本,包括典型和非典型的,初/复诊、复发型等。在后续工作中,将以所构建的各融合基因(e1a2、e13a2、e14a2)模板稳定转染到阴性HL-60细胞系中,与正常血液混合后采用本方法定性、定量检测每mL血液中的异常细胞数,为本方法在微小残留性疾病的分析和检测监测上提供进一步的性能评价。此外,费城染色体虽是CML的标志,存在于95%以上的CML患者中,但在急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL),急性髓性细胞白血病(acute myeloid leukemia,AML)患者中也有显著的发生率。其中e1a2主要存在于70%Ph+ALL 以及少数 CML、AML 细胞中[15],e13a2和e14a2则主要存在于95%以上的CML和25%以上的Ph+ALL细胞中[16]。因此,本研究建立的多重RT-PCR方法同样也适用于BCRABL阳性的ALL以及AML患者的早期诊断。总之,本研究建立了一种快速、简便、价廉的多重RT-PCR检测BCR-ABL融合基因常见亚型的方法,该方法适合临床上CML的辅助诊断、分子分型和治疗方案选择。
[1]Faggiano A,Mansueto G,Ferolla P,et al.Diagnostic and prognostic implications of the World Health Organization classification of neuroendocrine tumors[J].J Endocrinol Invest,2008,31(3):216-223.
[2]Quintás-Cardama A,Cortes J.Molecular biology of bcr-abl1-positive chronic myeloid leukemia [J].Blood,2009,113(8):1619-1630.
[3]An X,Tiwari AK,Sun Y,et al.BCR-ABL tyrosine kinase inhibitors in the treatment of Philadelphia chromosome positive chronic myeloid leukemia:a review[J].Leuk Res,2010,34(10):1255-1268.
[4]Garcés-Eisele J.Molecular biology strategies to detect residual disease[J].Hematology,2012,17(Suppl 1):S66-S68.
[5]Zhou RL,Mo YX,Lan M,et al.Detection of BCR/ABL fusion gene by fluorescence in situ hybridization and its clinical application[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2011,19(5):1283-1288.
[6]陈 哲,金敏威,陈 颖,等.慢性粒细胞白血病急变期细胞形态学、细胞遗传学、分子生物学及免疫学表型特征分析探讨[J].中国优生与遗传杂志,2010,30(4):33-34.
[7]胡 敏.244例髓细胞白血病FAB分型与WHO分型关系及其意义[J].检验医学,2007,22(2):132-135.
[8]张之南,沈 娣.血液病诊断及疗效标准[M].第2版.北京:科学出版社,1998:219-228.
[9]Heckman KL,Pease LR.Gene splicing and mutagenesis by PCR-driven overlap extension[J].Nat Protoc,2007,2(4):924-932.
[10]Sint D,Raso L,Traugott M.Advances in multiplex PCR:balancing primer efficiencies and improving detection success [J].Methods Ecol Evol,2012,3(5):898-905.
[11]Korbie DJ,Mattick JS.Touchdown PCR for increased specificity and sensitivity in PCR amplification[J].Nat Protoc,2008,3(9):1452-1456.
[12]Kerékgyártó M,Kerekes T,Tsai E,et al.Lightemitting diode induced fluorescence(LED-IF)detection design for a pen-shaped cartridge based single capillary electrophoresis system [J].Electrophoresis,2012,33(17):2752-2758.
[13]Vardiman JW,Thiele J,Arber DA,et al.The 2008 revision of the World Health Organization(WHO)classification of myeloid neoplasms and acute leukemia:rationale and important changes[J].Blood,2009,114(5):937-951.
[14]孟文彤,贾永前,刘 霆,等.两种巢式PCR检测慢性粒细胞白血病患者骨髓移植后微小残留病的比较[J].检验医学,2004,19(6):497-500.
[15]Cilloni D,Saglio G.Molecular pathways:BCR-ABL[J].Clin Can Res,2012,18(4):930-937.
[16]Burmeister T,Reinhardt R.A multiplex PCR for improved detection of typical and atypical BCR-ABL fusion transcripts[J].Leuk Res,2008,32(4):579-585.
